仿生电活性涂层钛植入材料促进骨结合的实验研究
白云洋 孙晓雯 王逸君 张学慧
医用金属钛(Ti)及其合金由于其良好的可加工性以及优异的生物相容性而被广泛用于口腔和骨科临床[1-2]。然而,钛种植体表面由于生物活性差,导致骨结合效果不理想。国内外学者尝试了许多物理及化学方法来提高的金属钛及其合金表面活性,包括表面改性和活化涂层。表面改性是通过喷砂、酸蚀、微弧氧化以及等离子喷涂等方法来提高钛植入体表面的的生物活性[3-4]。但这类改性的表面尚未提供良好的生物活性,骨结合效果仍然不能满足临床需求。理想的植入体表面应为新骨形成提供一个良好的骨诱导微环境,提高新骨生成和骨结合效果,同时应具备良好的骨结合稳定性。近年来,电活性材料受到研究者的广泛关注,因为这类材料可以通过设计加工实现仿生电活性,为细胞功能分化和新骨生成提供适宜的电学微环境[5-6]。聚偏氟乙烯(polyvinylidene fluoride,PVDF)及其共聚物如聚偏氟乙烯三氟乙烯[polyvinylidene fluoride trifluoroethylene,P(VDF-TrFE)]具有良好的压电性、力学性能及生物相容性,适合用于钛表面改性的电活性膜[7-8]。为了进一步增强PVDF压电聚合物的力学性能,并便于设计调节实现仿生电活性,本课题组前期通过掺杂并调节钛酸钡(BaTiO3,BTO)纳米颗粒含量,实现了仿生电活性BaTiO3/P(VDF-TrFE)纳米复合膜材料的稳定可控制备,并通过体外细胞实验、体内动物实验证实了该材料促进骨再生与修复的有效性[9-10]。本研究将前期优化后的仿生电活性BaTiO3/P(VDF-TrFE)纳米复合材料技术用于钛植入材料的表面涂层改性,拟通过比较仿生电活性涂层和左旋聚乳酸(Poly L-lactic acid,PLLA)涂层对促进兔骨结合的作用差异,旨在验证和稳定仿生电活性BaTiO3/P(VDF-TrFE)纳米复合材料作为种植体涂层材料的可行性和有效性。
资料与方法
一、资料
1.主要材料、设备和实验动物:聚偏氟乙烯-三氟乙烯P(VDF-TrFE)(70/30,PIEZOTECH,法国)、钛酸钡纳米颗粒(BTO,粒径100 nm,阿拉丁,上海);左旋聚乳酸(PLLA,分子量7 000,山东省医疗器械研究所);N,N-二甲基甲酰胺(国药集团化学试剂公司,北京)、三氟乙醇(国药集团化学试剂公司,北京);纯钛棒(直径为2 mm,长度为5 mm,自备)、盐酸多巴胺(Alfa Aesar,美国);电晕极化装置(HYJH-20KV,陕西惠研新材料科技有限公司);准静态D33测量仪(ZJ-3AN, 中科院声学所,北京);新西兰大白兔(雄性,2.5~3 kg,购自北京大学口腔医学院实验动物中心,许可证号:SYXK[(京)2016-0007];硬组织切磨系统(EXAKT,德国);骨形态分析仪(BIOQUANT,美国)。
2.仿生电活性涂层钛植入材料的设计和制备:根据文献[9-10]方法,称取一定量的经多巴胺改性后的钛酸钡纳米颗粒,分散于N,N二甲基甲酰胺溶液中。超声/搅拌各30 min(交替3次),之后加入P(VDF-TrFE)形成均匀稳定的悬浊液。按照设定钛酸钡的含量配制含体积分数5%钛酸钡纳米颗粒的混合液。对纯钛柱先用SiO2颗粒在0.4 mPa压力条件下进行喷砂处理,然后用10% H2SO4与10% HCl混合液在60 ℃恒温条件下酸蚀30 min。取50 μl上述BTO/P(VDF-TrFE)溶液均匀涂覆在喷砂-酸蚀处理后的钛柱表面,在80 ℃下烘干2 h以蒸发溶剂并在钛柱表面形成均匀涂层。相同方法制备PLLA涂层钛柱材料作为对照组。将电活性涂层钛柱置于电晕极化装置样品台上,设置样品与极化极头间距离为15 mm,施加电压15 kV;在常温条件下极化30 min。
二、方法
1.表面形貌观察:样品经喷金处理后,在扫描电子显微镜下观察不同涂层植入材料的表面形貌,并利用X线微区分析方法(energy dispersive spectrometer,EDS)对元素组成进行分析。
2.表面粗糙度检测:采用原子力显微镜检测不同涂层植入材料的表面粗糙度,扫描选取范围为10 μm×10 μm。
3.亲疏水性检测:将不同涂层植入材料样品固定在载玻片上,然后置于载物台上,调整蒸馏水液滴约2 μl,滴在样品表面,利用量角法计量液滴接触角大小。每组材料取5个平行样,求平均值。
4.电学性能检测:将BTO/P(VDF-TrFE)电活性涂层钛植入材料置于d33准静态测量仪中进行压电常数d33测试,并将样品置于37 ℃无血清细胞培养基中孵育7 d后再行d33测试。每次测试取5个测试点,求平均值。
5.动物实验:本实验研究获北京大学医学部伦理委员会审批。取新西兰大白兔6只,胫骨皮肤剃毛、铺巾、消毒。在双侧胫骨外侧位置作皮肤切口直达骨面,剥离骨膜暴露胫骨。利用2 mm列钻在每侧的胫骨外侧面制备3个直径为2 mm的圆形单侧骨壁穿透缺损,缺损间距为1 cm。在左侧胫骨缺损处植入PLLA涂层对照钛柱;右侧胫骨缺损处植入仿生电活性涂层钛柱(图1)。术后缝合、消毒。术后4周和12周分别取材,树脂包埋。采用硬组织切磨系统制备硬组织切片,亚甲蓝染色。最后通过骨形态分析仪对植入体周围的骨结合率(BIC)进行分析。

图1 BTO/P(VDF-TrFE)涂层钛植入材料植入兔胫骨缺损手术(黄色箭头所示植入材料)

结 果
一、仿生电活性涂层钛植入材料的表面形貌与结构
扫描电镜观察结果显示,纯钛表面可见深浅不一的凹坑结构(图2A-B),微坑直径约为2~5 μm(图2C)。EDS能谱分析证实材料的主要成分为钛(图2D)。PLLA涂层表面可见一层较为均匀而致密的聚合物膜附着于钛表面(图2E-G)。EDS能谱分析结果显示材料表面的主要元素组成为Ti、C和O(图2H)。仿生电活性BTO/P(VDF-TrFE)涂层钛植入材料表面可见钛酸钡纳米颗粒均匀分散在压电聚合物P(VDF-TrFE)中(图2I~K),并经EDS检测证实其主要成分为Ti、Ba和F等(图2L)。表面粗糙度检测结果显示,仿生电活性BTO/P(VDF-TrFE)涂层的表面粗糙度略高于PLLA涂层,仿生电活性BTO/P(VDF-TrFE)涂层表面粗糙度为(162.2±19.4)nm;PLLA涂层表面粗糙度为(145.2±18.4)nm,但差异无统计学意义。水接触角测试结果显示,仿生电活性BTO/P(VDF-TrFE)涂层表面的水接触角为(92.0±2.5)°;PLLA涂层表面的水接触角为(89.1±1.9)°,两组之间差异无统计学意义。

图2 不同聚合物涂层钛植入材料表面形貌扫描电镜观察和EDS成分表征结果 A~D 无涂层钛表面及EDS检测结果 E~H PLLA涂层钛表面及EDS检测结果 I~L BTO/P(VDF-TrFE)涂层钛表面及EDS检测结果;SEM图片显示标尺分别为1、200 μm和10 μm
二、仿生电活性涂层钛植入材料的电学性能
压电常数测试结果显示,BTO/P(VDF-TrFE)涂层的压电常数d33为6.27 pC/N,接近天然骨组织的压电常数量级。体外放置7 d后的压电常数d33为6.03 pC/N,仍保持初始压电常数的96%以上。仿生电活性BTO/P(VDF-TrFE)涂层具有良好的早期电学稳定性,可能对其生物学性能起到积极作用。
三、仿生电活性涂层钛植入材料的骨结合性能
术后4周,仿生电活性BTO/P(VDF-TrFE)涂层材料表面和新骨结合紧密,涂层材料稳定无降解。PLLA涂层材料表面由于PLLA属于可降解高分子,材料有部分降解导致新骨结合较差(图3A-D)。骨结合率检测显示,仿生电活性BTO/P(VDF-TrFE)涂层的骨结合率明显高于PLLA涂层(图3E)。术后12周,两组的新骨成熟程度均明显增加,骨陷窝结构明显,仿生电活性BTO/P(VDF-TrFE)涂层仍然保持稳定状态,与成熟的新骨结合紧密。PLLA涂层进一步发生降解,和新骨结合程度弱于电活性涂层组(图4),可能会影响其骨结合稳定性。
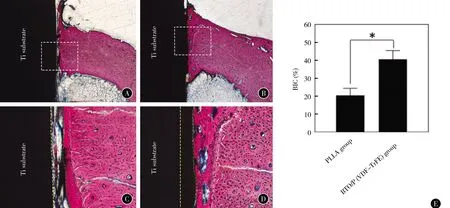
图3 两种聚合物涂层钛植入材料植入兔胫骨缺损术后4周的硬组织检测结果(A,B ×4;C,D ×200) A PLLA涂层钛表面 B BTO/P(VDF-TrFE)涂层钛表面 C PLLA涂层钛表面 D BTO/P(VDF-TrFE)涂层钛表面 E 骨结合率;C和D分别为A和B中虚线框区域的放大图片,黄色虚线为钛基底与涂层界面,绿色虚线为涂层与新骨界面

图4 两种聚合物涂层钛植入材料植入兔胫骨缺损术后12周的硬组织检测结果 A PLLA涂层钛植入材料 B BTO/P(VDF-TrFE)涂层钛植入材料。黄色虚线为钛基底与涂层界面,绿色虚线为涂层与新骨界面(×200)
讨 论
骨结合是评价种植修复效果的金标准,材料性能直接决定植入体骨结合效果。以往大量研究主要集中于对植入体材料表面的拓扑结构、表面粗糙度、表面亲疏水性设计及活性因子的负载等,仍然无法满足目前的临床需求。因此,开发更为有效的促进植入体材料骨结合效果的材料设计策略成为当前植入体材料功能化设计的主要发展方向。
骨组织处于电磁环境中,电磁环境对组织修复与功能维持起到关键作用[11-13]。基于这一理论背景,相继有利用电刺激成功治疗骨折愈合和骨不连的病例报道[14-17]。骨“压电效应”的提出为电刺激成骨的进一步研究奠定了重要理论基础。国内外学者针对骨骼的电学特性和电刺激成骨开展了大量的实验研究。电刺激可促进骨形成,骨折愈合,促进骨骼的生长和发育,并且在临床上得到证实与应用。对于骨再生修复研究,骨组织的天然压电特性在骨重建修复过程中的关键作用为人工骨修复支架材料的仿生电学设计提供了思路。
近年来,大量的压电材料逐渐应用于骨修复支架材料领域,并取得了长足的发展。如钛酸钡压电陶瓷、铌酸钾钠无铅压电陶瓷、聚偏氟乙烯压电聚合物等作为主要成分的电响应性活性材料,大量体内外研究证实了这些材料具有良好生物相容性和骨诱导功能[18-20]。如最早提出的用羟基磷灰石/钛酸钡(HABT)作为骨修复支架材料[21],植入犬下颌骨后,组织学观察结果显示HABT较纯HA有更为明显的骨生长和愈合程度,并且在HABT植入材料周围有大量有序排列的胶原形成,提示HABT复合材料的压电活性对骨再生产生了关键作用。随后在钛酸钡/羟基磷灰石压电复合陶瓷材料方面也取得了系列成果[22-23]。在钛酸钡和聚偏氟乙烯PVDF复合压电活性材料方面,从材料设计、体外细胞响应,到体内促进成骨一系列研究证实了电活性材料在骨缺损修复过程中的有效性和可行性[24-25]。
然而,以上材料在结构设计方面存在陶瓷颗粒分散性差导致的材料电学均匀性、稳定性差以及由此造成的临床效果不稳定等不足。更重要的是并没有从根本上进行仿生电生理效应这一角度出发来进行材料的电响应性设计。本研究前期已经成功制备出具有仿生电生理效应的BaTiO3/P(VDF-TrFE)纳米复合膜材料并对该材料体系的理化特性包括力学性能、表面结构、亲疏水性、电学特征以及电学稳定性等进行了系列评价与优化,实现了仿生电活性BaTiO3/P(VDF-TrFE)纳米复合膜材料的稳定可控制备,并通过体外细胞实验、体内动物实验证实了该材料促进骨再生与修复的有效性[9-10]。
本研究进一步将仿生电活性BaTiO3/P(VDF-TrFE)纳米复合材料技术用于钛植入材料的表面涂层改性,以增强植入体的骨结合效果。首先将钛表面进行喷砂-酸蚀处理是为了增加材料表面粗糙度以更好地与涂层结合。两种不同涂层的表面粗糙度、亲疏水性均无明显差异,说明两者之间的生物学性能差异主要来自于材料的电学特性;且经过压电性能测试证实了BTO/P(VDF-TrFE)涂层良好的仿生电学特性和稳定性。此外,在前期报道中已对钛酸钡/聚偏氟乙烯三氟乙烯压电纳米复合膜的电学特性进行了系统评价,结果显示该纳米复合膜具有生理量级的表面电位(约-76.8 mV),而且在体内外均呈现出良好的电学稳定性[9-10]。
在设计植入体表面涂层材料时,涂层材料的稳定性直接决定了植入体骨结合效果和长期稳定性。本研究选取的BTO/P(VDF-TrFE)电活性涂层属于不可降解材料,植入体内后材料具有优异的稳定性,能够保持长期稳定的电学特性。这可能是动物实验结果所呈现良好骨结合效果的重要原因。而PLLA涂层由于PLLA植入体内后会发生缓慢降解,尤其在植入后期会由于材料降解影响骨结合效果。本研究结果提示,在植入体材料的表面功能化设计中,应兼顾材料功能特性和材料本身的稳定性。
综上所述,仿生电活性BaTiO3/P(VDF-TrFE)可能作为一种具有促进骨整合功能的种植体涂层材料。

