一株暗褐网柄牛肝菌的分离与培养基优化
HASSAN Sidik Mohamed,郭旭新,吴峥妍,潘晨晨,徐孟涛,柳永,2,3*
(1.浙江科技学院 生物与化学工程学院,浙江 杭州 310023; 2.浙江省农产品化学与生物加工技术重点实验室,浙江 杭州 310023;3.浙江省农业生物资源生化制造协同创新中心,浙江 杭州 310023)
暗褐网柄牛肝菌[Phlebopusportentosus(Berk.& Broome)Boedi jn.]俗称黑牛肝菌,属小牛肝菌科(Boletinellaceae)脉柄牛肝菌属(Phlebopus)可食用真菌[1],味道鲜美、价格昂贵。自然条件下,暗褐网柄牛肝菌可与凤凰木、菠萝蜜、柚子、咖啡等多种植物形成外生菌根[2]。弱酸性(均值6.04)和高速效钾土壤(均值231.17 mg·kg-1)有利于暗褐网柄牛肝菌出菇[3]。人工平板菌丝培养条件下,葡萄糖、酵母膏、KH2PO4和MgSO4分别是暗褐网柄牛肝菌的最适碳源、氮源和无机盐[4];深层液态培养条件下甘露醇和酵母膏分别为其最适碳源和氮源[5]。暗褐网柄牛肝菌生产母种优选培养基为添加1.0 g·L-1MgSO4、1.0 g·L-1KH2PO4和2.0 g·L-1酵母膏的改良PDA培养基[6],但继代次数不宜超过2次[7]。
国内人工栽培研究表明,在稳定的栽培模式下,袋栽暗褐网柄牛肝菌鲜品产量可达100 g·袋-1,出菇周期60 d左右。出菇后的废菌渣可于林下仿生栽培,第2年每667 m2产鲜菇60 kg左右[8]。人工覆土以全碳、总磷较高的菜园土为佳,出菇数量和单菇质量均得到显著提高[9]。泰国Kumla等[10]和Sanmee等[11]分别以高粱粉-宿主营养液-草粉和橡胶树粉-米糠等复配物料实现了暗褐网柄牛肝菌成功出菇,但离产业化应用尚远。
大量菌根菌与宿主植物通过“碳水化合物和磷交易”的方式实现互利共生,在森林地下碳水化合物和磷的运输与交换中发挥着重要作用[12]。同时,菌根菌是13C标记光合产物的首要受体,且6 d后系统内剩余13C标记光合作用产物中的26.8%被转移到地下[13]。作为外生菌根菌家族的一员,暗褐网柄牛肝菌极有可能在自然界中扮演着相似的角色,与宿主植物间拥有丰富的互动[14]。在从宿主获取营养物质的同时,暗褐网柄牛肝菌如何感知季节的变化,进而完成子实体发育呢?植物体内伴随季节波动的激素水平,是否可能为暗褐网柄牛肝菌感知适宜繁殖季节的到来提供“信号”呢?本文介绍了暗褐网柄牛肝菌对几种常见天然营养物和植物生长调节剂的响应性测试结果,希望能为后续暗褐网柄牛肝菌的栽培应用提供有益参考。
1 材料与方法
1.1 材料
暗褐网柄牛肝菌子实体采自云南省木水花野生菌批发市场(昆明市),PDA培养基购自杭州百思生物公司,全土豆粉购自甘肃正阳农业科技公司,酵母抽提物购自OXOID公司,小牛浸膏购自杭州微生物试剂有限公司,活性炭购自中国医药集团有限公司,鲜蛋黄为市售鲜鸡蛋的蛋黄,小麦麸皮、花生秸秆粉、毛竹粉、杨木屑分别来自安徽省淮南市、山东省莱芜市、浙江省安吉县和江苏省连云港市。MgSO4、KH2PO4、维生素B1(VB1)、葡萄糖、无水乙醇等均为国产分析纯,琼脂粉购自天津致远化学试剂公司。脱落酸(ABA)、细胞分裂素类植物生长调节剂6-BA、生长素类植物生长调节剂2,4-D均为Sigma公司产品。
1.2 暗褐网柄牛肝菌菌种分离与鉴定
取暗褐网柄牛肝菌子实体1个,用75%乙醇棉擦拭表面后,切开菌柄,从断面处挖取组织小块,接种于改良PDA培养基上,于28 ℃培养15 d左右即可获得分离株。改良PDA培养基配方:PDA粉末 46.1 g·L-1,全土豆粉30 g·L-1,硫酸镁1.5 g·L-1,磷酸二氢钾3 g·L-1,VB110 mg·L-1,琼脂10 g·L-1,pH 6.8。121 ℃高压灭菌30 min,倒平板备用。分离株采用ITS序列对比法进行分子鉴定,DNA提取方法为FDEB法[15]。ITS扩增引物为ITS1:TCCGTAGGTGAACCTGCGG和ITS4:TCCTCCGCTTATTGATATGC。PCR条件为:94 ℃ 2 min;94 ℃ 15 s,52 ℃ 15 s,72 ℃ 30 s,35个循环;72 ℃ 5 min,16 ℃保温。PCR扩增产物经测序后提交NCBI网站进行BLASTn序列比对,选取相似度99%以上序列的菌种信息作为分离株物种鉴定结果。
1.3 天然物料对暗褐网柄牛肝菌分离株生长速度的影响
选取长势健壮的暗褐网柄牛肝菌分离株DN18开展后续生长性能研究。DN18在改良PDA培养基上生长缓慢,推测可能与缺乏某种营养成分有关。在改良PDA培养基基础上,分别添加6 g·L-1酵母抽提物(PDY)、小牛浸膏(PDB)、活性炭(PDC)、鲜蛋黄(PDE)、小麦麸皮(PDF)、花生秸秆粉(PDG)、毛竹粉(PDM)和杨木屑(PDW),配制成8种固体培养基。接种DN18菌种后于28 ℃培养28 d,观察暗褐网柄牛肝菌长势。
1.4 6-BA、ABA、2,4-D对菌丝长势的影响
在固体改良PDA培养基中,分别添加2、3、5 mg·L-1的6-BA、ABA或2,4-D。各处理制备5个固体培养基,每个培养皿中培养基量约为20 mL。接种DN18后于28 ℃培养28 d,测量和统计各平皿中DN18菌落直径和菌囊数量,计算平均值。
1.5 植物生长调节剂对菌丝长势的影响
在改良固体PDA培养基中,分别添加不同比例的6-BA和2,4-D或6-BA和ABA,6-BA与2,4-D或ABA的质量比分别为1∶1、2∶1、4∶1、8∶1。其中,6-BA质量体积分数固定为4 mg·L-1,根据比例关系分别添加适量2,4-D或ABA。菌丝生长速度测定和菌囊数量统计方法同1.4节所述。
2 结果与分析
2.1 暗褐网柄牛肝菌分离株鉴定
暗褐网柄牛肝菌组织分离与ITS序列扩增结果见图1。图1中,A为暗褐网柄牛肝菌子实体外观与横切面; B图中箭头所示为子实体根部的菌囊样结构,可能与子实体分化有关,后续培养基筛选中把菌囊形成数量纳入考量指标之一;C图为DN18分离株,其生长旺盛,菌落边缘整齐;D图中M1为DNA分子质量标准DL 15 000,1号泳道是基因组DNA提取结果,条带规则,无明显拖尾,提取效果良好;E图中4号为DN18 ITS扩增产物,条带单一明亮,大小介于500~800 bp。测序结果与Genbank收录的暗褐网柄牛肝菌的ITS序列具有99%相似度,判断分离株DN18为暗褐网柄牛肝菌(Phlebopusportentosus)。

A为暗褐网柄牛肝菌子实体外观与横切面; B图中箭头所示为子实体根部的菌囊样结构;C图为DN18分离株;D图中M1为DNA分子量标准DL 15 000,1号泳道是基因组DNA提取结果;E图中4号为DN18 ITS扩增产物。图1 暗褐网柄牛肝菌组织分离株及其ITS序列扩增产物
2.2 添加物对DN18长势的影响
改良PDA培养基中额外添加活性炭、花生秸秆粉、酵母抽提物、鲜蛋黄、毛竹粉、小牛浸膏、小麦麸皮和杨木屑后,DN18菌落外观见图2。从图2可以看出,9种培养基上DN18的生长速度和菌落颜色等均有一定差异。生长速度方面,PDW=PDG>PDM=PDB>PDF>PDC>改良PDA=PDE>PDY;菌落颜色方面,PDF、PDG、PDW培养基上DN18菌落颜色均呈暗褐色;PDM培养基上,菌落中部呈深褐色,外围颜色仍为黄色;其他培养基上菌落颜色以黄色为主。

PDY、PDB、PDC、PDE、PDF、PDG、PDM、PDW分别为添加酵母抽提物、小牛浸膏、活性炭、鲜蛋黄、小麦麸皮、花生秸秆粉、毛竹粉和杨木屑的改良PDA培养基。图2 DN18在9个培养基上的菌落形貌
2.3 单一植物生长调节剂对DN18长势的影响
DN18在添加植物激素培养基上的生长速度和菌囊数量统计结果见表1,菌落形态见图3。从表1可以看出:添加2、3、5 mg·L-1ABA未表现出促进DN18生长的效应;6-BA和2,4-D促进了DN18菌丝体生长,尤其5 mg·L-12,4-D和3 mg·L-16-BA促进DN18生长效应较为突出。5 mg·L-12,4-D较无激素对照(改良PDA培养基)生长速度提高了37.3%。此外,添加6-BA和2,4-D对菌落颜色有一定影响,添加浓度越高,菌落颜色越深(图3)。

表1 3种外源激素处理下DN18长势
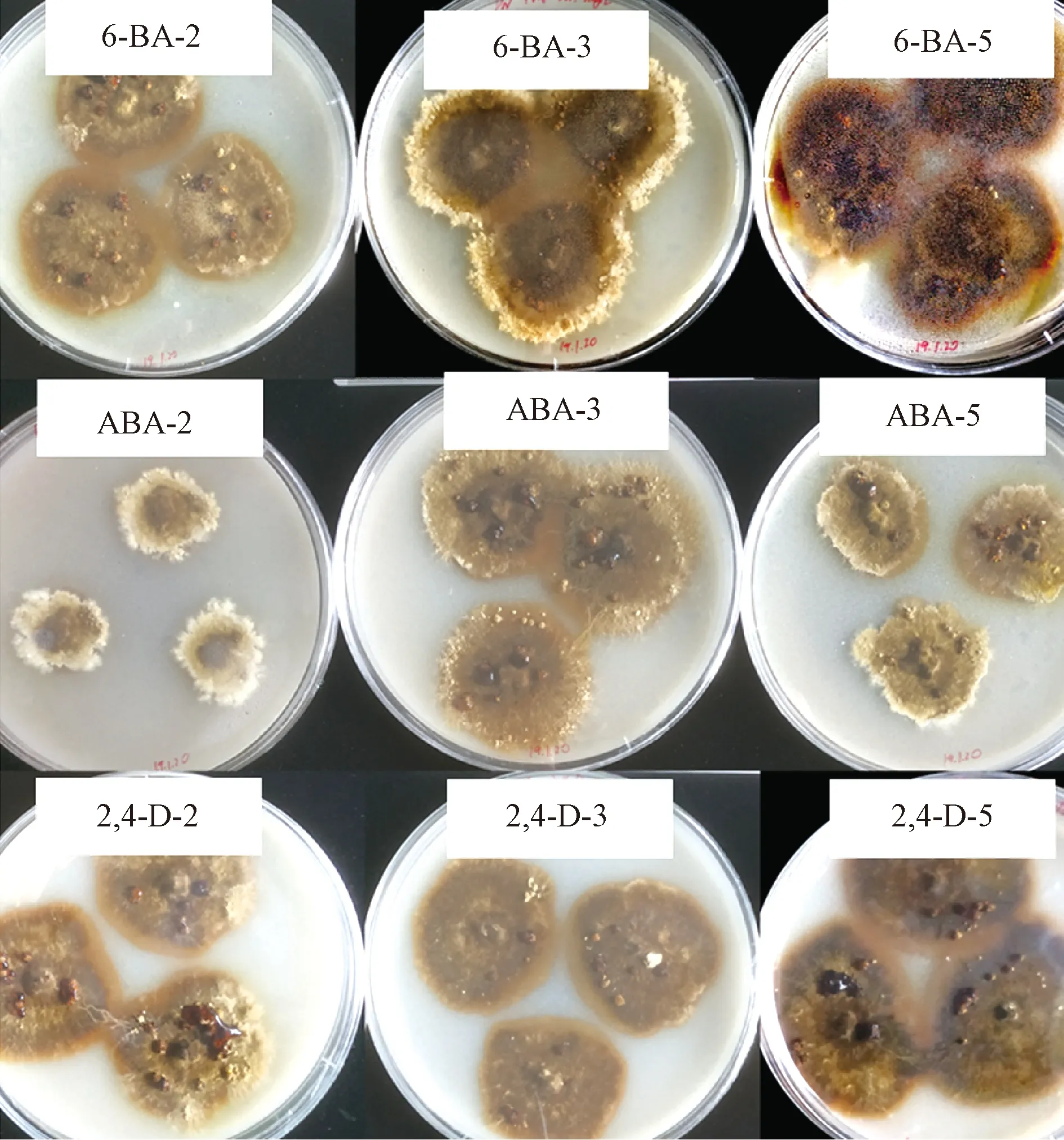
图3 DN18在不同植物激素培养基上的菌落形态
从表2和图4可以看出,6-BA、2,4-D质量比为1∶1时,DN18生长速度快于其他处理组,与单独添加5 mg·L-12,4-D效果相当。6-BA、ABA质量比为4∶1、8∶1时,菌囊数量明显增多。菌丝生长速度与菌囊数量没有明显关联,菌囊的生物学意义还有待后续挖掘。

表2 DN18在混合植物激素培养基上的生长情况
3 讨论
对比PDF和PDG培养基成分可以发现,PDF中小麦麸皮蛋白质含量(12%~18%)[16]高于PDG中花生秸秆蛋白质含量(6.6%~11.6%),PDF中非淀粉多糖含量(46%左右)[17]低于PDG中花生秸秆的中性与酸性洗涤纤维含量(65%~81%)[18]。结合DN18在富含蛋白质营养的PDY和PDB培养基上的长势,可以推测蛋白质并非DN18在改良PDA培养基上生长的主要限制营养因子。厚壁毛竹中棕纤维含量约为46%~56%[19],均低于花生秸秆粉和杨木屑的蛋白质含量[20],但与小麦麸皮中较低的非淀粉多糖含量(46%左右)接近,由此推测,导致菌落颜色呈暗褐色的因素可能是非淀粉多糖中的某一类组分。从图3中5 mg·L-16-BA、3 mg·L-1ABA、5 mg·L-12,4-D与其他处理的菌落颜色差异,以及图4中6-BA、BA质量比2∶1处理突出的深褐色菌落可以发现,DN18的菌落颜色与激素水平有关。同时大量研究表明,在菌根菌与其宿主植物间的共生关系中,激素调控扮演着极为重要的作用。一方面,外生菌根真菌可以产生吲哚乙酸(IAA)、赤霉素(GA)、脱落酸(ABA)和细胞分裂素等植物激素[21],在菌根共生关系形成过程中,对植物根部的发育产生影响。另一方面,菌根菌的生长特性也受到植物激素的调控:GAs在菌根共生关系建立中扮演负调控因子,外源施加活性GA3时,丛植菌根菌的分支减少;ABA在低浓度下促进菌根菌在植物根部的定殖,高浓度下同样具有降低丛枝菌根菌分支数量的效应。在杨树和番茄外生菌根菌研究中发现,菌根真菌能诱导根尖生长素的累积,菌根和生长素共同调控植物的生长发育[22]。当前的菌根共生关系研究中,默认以植物为中心研究对象,作为地下物质交换中心的菌根菌则被忽视,植物激素对菌根菌生长发育的影响鲜有研究。菌根类食用菌分离难、栽培难或许就与栽培介质中缺乏某些重要植物源活性因子有关。
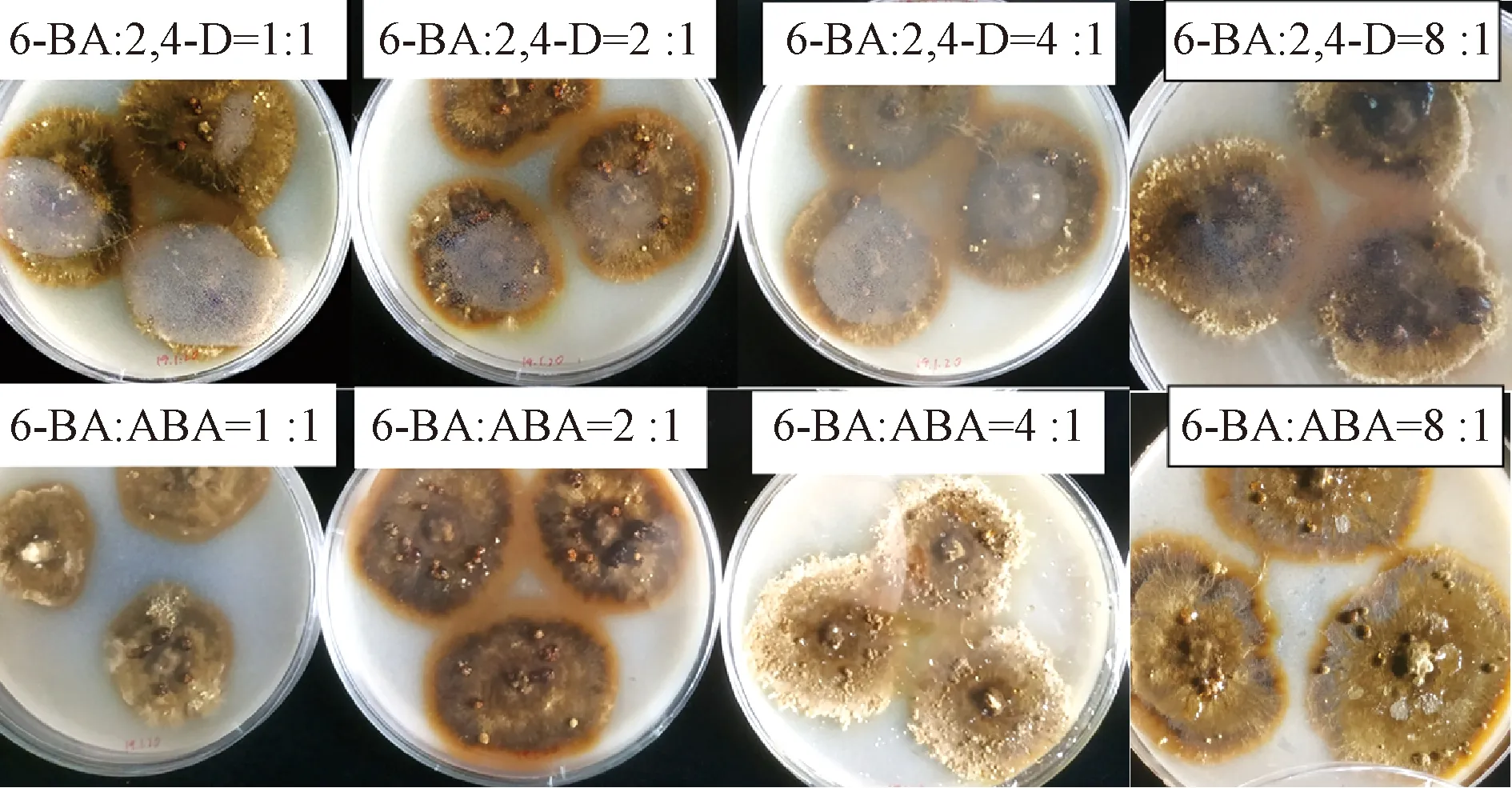
图4 DN18在混合植物激素培养基上的菌落形态

