自噬调节在膀胱癌发展和治疗中的作用
呼宁宁,安瑞华
(哈尔滨医科大学附属第一医院泌尿外科,哈尔滨 150001)
膀胱癌是人类最常见的恶性肿瘤之一,病死率较高,发病率逐年上升,根据国际癌症研究机构的报告显示,2018年全世界新发膀胱癌549 393例,死亡199 922例[1],新发病例中70%~80%被诊断为非肌肉浸润性膀胱癌[2-4]。尽管膀胱癌的治疗经历了外科手术联合术后膀胱灌注化疗,但仍有高达50%的非肌肉浸润性膀胱癌患者复发,而20%的患者在5年内病情继续进展[5]。因此,迫切需要开发新的疗法。自噬是一种基本的分解代谢过程,可以通过各种细胞应激来激活该过程,包括营养剥夺、细胞器损伤、放化疗等[6]。在癌症发展的初始阶段,自噬通过维持基因组完整性并防止癌细胞增殖,在抑制肿瘤方面发挥重要作用[7]。但在癌症确定后,癌细胞可能会利用自噬在不利的微环境中抵抗细胞应激[8]。此外,自噬被认为是治疗癌症的“双刃剑”。抗癌治疗诱导的细胞保护性自噬在癌细胞的耐药过程中起重要作用。因此,自噬抑制可以增加癌细胞对抗癌治疗的敏感性。相反,自噬促进可能诱导Ⅱ型程序性细胞死亡,称为自噬细胞死亡[9]。现就自噬调节在膀胱癌发展和治疗中的研究进展进行综述。
1 自噬调节与膀胱癌
目前,已有30多种自噬相关基因和同源蛋白被确定为自噬所必需的[10]。因此,响应各种压力的自噬激活会导致自噬相关蛋白[包括微管相关蛋白轻链3(microtubule-associated protein light chain 3,LC3)、Beclin1等]表达水平发生变化。LC3是自噬体形成的特定蛋白质标记。在类自噬相关基因(autophagy-related gene,ATG)8泛素结合系统中,LC3首先被ATG4(一种特定的半胱氨酸蛋白酶)裂解,从而暴露出C端半胱氨酸。随后,LC3通过ATG7、ATG3与磷脂酰乙醇胺偶联,从而促进细胞质LC3-Ⅰ向膜结合型LC3-Ⅱ的转化[11]。Ojha等[12]比较非肌肉浸润膀胱癌患者的组织样本与正常膀胱尿路上皮组织样本发现,在高级别和低级别尿路上皮癌标本中,作为自噬诱导标志物的LC3均显著升高,且在高级别尿路上皮癌标本中升高更显著。与正常的尿路上皮细胞相比,饥饿诱导的自噬在高级别和低级别尿路上皮癌中均更容易发生。当膀胱癌组织暴露于自噬抑制剂,如磷脂酰肌醇-3-激酶(phosphatidylinositide-3-kinase,PI3K)抑制剂、3-甲基腺嘌呤(3-methyladenine,3-MA)或氯喹时,在类似的饥饿条件下,高级别膀胱癌的细胞死亡率明显高于低级别膀胱癌,表明在外部有害因素作用下,自噬对膀胱癌细胞起保护作用,且在高级别膀胱癌细胞中作用更加明显。Beclin1是一种多域蛋白,可调节自噬和凋亡之间的相互干扰。Ⅲ类PI3K复合体已被确认为调节自噬通量并平衡自噬和凋亡过程的重要信号枢纽。一方面,Beclin1依赖于Beclin1-PI3K催化亚基3型复合体促进吞噬泡的聚集与组装而参与自噬体的形成,另一方面,Beclin1与其他相关蛋白共同作用而调节自噬体的成熟。因此,Beclin1作为Ⅲ类PI3K调节亚基,在通过磷酸化和泛素化作用调节自噬中起重要作用[13]。王振龙等[14]采用分支DNA-液相芯片法检测53例膀胱癌组织标本和20例癌旁组织标本中 Beclin1的表达水平,结果显示,膀胱癌组织中Beclin1 mRNA的高表达率低于癌旁正常组织。提示在膀胱癌发生早期,细胞自噬可能被抑制,Beclin1 mRNA的高表达率与膀胱癌病理分级、生长方式、TNM分期和淋巴结转移等预后因素有关,肿瘤分化程度越低,Beclin1 mRNA高表达率越低。在恶性程度更高的膀胱癌(T2~4期)中,Beclin1 mRNA高表达率更低。李飞[15]采用免疫组织化学法研究Beclin1蛋白在膀胱癌组织中的表达,表明在膀胱癌发展恶化过程中Beclin1基因表达起重要作用。可见,自噬调节与膀胱癌密切相关。因此,利用细胞自噬研发新型药物将极大地促进膀胱癌预防与治疗策略的改进与发展。
2 自噬调节在膀胱癌治疗中的作用
在肿瘤形成过程中,自噬通过维持基因组完整性并防止癌细胞增殖而在抑制肿瘤的发生和发展中起主要作用[7]。Zhu等[16]研究证明,ATG7在侵袭性膀胱癌中明显过表达,这种蛋白的敲低能够显著抑制膀胱癌的侵袭,提示ATG7可能参与膀胱癌的发育调控。自噬在癌症治疗中具有双重作用:一方面,抑制自噬可以增加化疗和放疗等治疗的细胞毒性作用[17-19];另一方面,自噬的过度激活可能导致自噬细胞死亡,也称为Ⅱ型程序性细胞死亡,与细胞凋亡相似,被定义为在溶酶体存在下的细胞死亡[19-24]。因此,为了开发新的治疗药物,确定自噬在癌细胞中的作用至关重要。
2.1抑制膀胱癌的保护性自噬 外科手术结合膀胱灌注化疗药物是降低膀胱癌患者肿瘤复发率的常规治疗。然而,尽管进行了有效的治疗,大多数患者仍然经历疾病复发并最终因肿瘤转移而死亡[25]。预后不良通常归因于对各种治疗干预措施的抵抗力。研究表明,癌细胞可以通过多种机制实现抗药性,包括细胞内在和外在因素,如遗传异质性[26]、自噬[27]、肿瘤微环境[27]和癌症干细胞因子[28]。此外,自噬可以通过提供细胞能量需求并在低氧、氧化应激、炎症和细胞因子释放等应激条件下防止细胞毒性来影响肿瘤的微环境。此外,自噬可能通过促进干细胞的维持而影响肿瘤干细胞的稳态调节[29]。大量研究表明,通过多种途径抑制保护性自噬的方法包括药物抑制剂[17,19,30-31]、RNA干扰剂[30,32]和天然生物活性化合物[33-34](表1),能够提高膀胱癌对治疗干预措施的敏感性。
2.1.1自噬抑制剂氯喹 氯喹是一种抗疟疾药物,是抑制自噬的最常用和最有效的药物。目前氯喹及其衍生物羟氯喹是美国食品药品管理局批准的唯一临床可用的自噬抑制剂[35]。氯喹及其衍生物羟氯喹是弱亲脂性碱基,具有在溶酶体中积累的能力,从而增加了溶酶体的pH值。随后,溶酶体的碱化作用阻止其与自噬体融合,并使溶酶体酸性蛋白酶失活,从而防止自身溶酶体中的货物降解。研究表明,氯喹介导的溶酶体功能障碍可使癌细胞对化疗和放疗敏感,从而增强这种治疗方法的抗癌作用。一项氯喹联合顺铂处理膀胱癌细胞的研究表明,自噬的抑制作用增强了顺铂的细胞毒性[19]。另一项研究揭示了相同的结果,即使用氯喹抑制顺铂诱导的自噬可显著增加膀胱癌细胞对顺铂的敏感性,从而增强其细胞毒性[30]。上述研究表明,顺铂可诱导自噬作为膀胱癌细胞的一种保护机制,而抑制自噬可显著增强顺铂耐药细胞的化学敏感性。
2.1.2自噬抑制剂3-MA 3-MA是Ⅲ类PI3K抑制剂。PI3K是脂质激酶的多样化家族,在细胞过程中起重要作用,包括细胞增殖、代谢和自噬调节[36-37]。Ⅲ类PI3K是哺乳动物细胞中三类PI3K之一,是自噬的激活剂,在自噬体形成早期阶段起重要作用。Fan等[31]进行了一项研究,旨在评估防己碱(一种在Stephania tetrandra中发现的天然产物)对膀胱癌的抗肿瘤作用,结果显示,防己碱能够诱导膀胱癌细胞自噬和凋亡,3-MA抑制自噬可导致防己碱诱导的凋亡增强,胱天蛋白酶(caspase)-3的分裂增加是明显的证据[31]。上述研究表明,保护性自噬的抑制可以增强抗癌药物的凋亡率。
2.1.3针对RNA干扰 近年来已经进行了越来越多的针对RNA干扰的研究,以进一步探索保护性自噬抑制作用对抗癌治疗的影响。Kang等[32]证明通过禁用ATG12(自噬体形成和完成的关键转录基因之一)对自噬的遗传抑制能够增强表皮生长因子受体抑制剂对膀胱癌细胞的抗癌作用。将siRNA转染到膀胱癌细胞中通过阻断ATG12抑制自噬。随后,将转染的细胞用表皮生长因子受体抑制剂拉帕替尼或吉非替尼处理,流式细胞术分析证实,与表皮生长因子受体抑制剂联合使用时,ATG12-siRNA抑制自噬协同增加凋亡细胞死亡,表明自噬是膀胱癌细胞的一种保护机制[32]。此外,Lin等[30]将自噬抑制剂短发夹RNA为基础的慢病毒与顺铂结合,证明利用短发夹RNA通过敲除ATG7/ATG12或Beclin1来抑制自噬,能够协同增强顺铂对膀胱癌5637和T24细胞的抗癌能力。结果表明,短发夹RNA抑制自噬可增加顺铂诱导的凋亡,这可通过caspase-3裂解的增强来证明,表明顺铂与自噬抑制剂的组合能够增加膀胱癌细胞对顺铂的敏感性,从而增强这种化疗药物的细胞毒性[30]。总之,自噬已被确定为导致癌症治疗耐药性的关键机制。此外,自噬被认为是与常规疗法结合的涉及自噬抑制剂疗法的潜在靶标。保护性自噬的抑制可能增加膀胱癌对化疗或放疗的敏感性,为癌症治疗过程中自噬的有效调节提供重要信息。
2.2膀胱癌自噬细胞死亡的激活 自噬在癌症治疗中起双重作用,除细胞保护性自噬外,细胞毒性自噬是细胞自噬的另一种主要形式,可单独或与凋亡相关联地促进细胞死亡。从功能上分析,细胞毒性自噬能够减少活细胞的数量和(或)降低治疗后的克隆形成存活率[38]。Gewirtz[38]推测自噬在癌症治疗中的双重作用可能与自噬机制的特定信号通路和(或)底物有关。此外,高自噬水平可能会诱发Ⅱ型程序性细胞死亡,这也称为自噬细胞死亡[20]。基于这一概念进行了多项研究,以探讨自噬细胞死亡在不同癌症治疗领域的治疗潜力。在膀胱癌中,帕唑帕尼的化学疗法[21]、氟利昂碱氟化物的生物疗法[22]和替代疗法[23-24,39]均发现自噬细胞死亡(表2)。
2.2.1血管内皮生长因子 在抗血管生成剂中,我国自主研发的靶向抑制血管内皮生长因子受体2的抑制剂阿帕替尼可竞争性结合该受体胞内酪氨酸ATP结合位点,高度选择地抑制血管内皮生长因子受体2酪氨酸激酶活性,阻断血管内皮生长因子结合后的信号转导,抑制肿瘤血管生成[40]。靶向血管内皮生长因子受体的口服酪氨酸激酶抑制剂帕唑帕尼已被批准用于转移性肾细胞癌和软组织肉瘤的治疗[21]。但帕唑帕尼用于膀胱癌的开发仍处于临床研究的初始阶段。先前的研究(其中用帕唑帕尼处理膀胱癌细胞)表明,这种抗血管生成剂能够通过增加胞外信号调节激酶1/2磷酸化来诱导自噬,如LC3-Ⅱ/LC3-Ⅰ比例增加,酸性泡状细胞器的形成,p62蛋白降解和自噬通量[21],表明帕唑帕尼诱导的自噬细胞死亡与组织蛋白酶B活性增加有关。在分子水平上对膀胱癌细胞的基因表达进行比较分析表明,帕唑帕尼通过影响自噬基因的表达(如ATG9B的上调和肿瘤蛋白p73基因的下调)诱导细胞毒性自噬[21]。
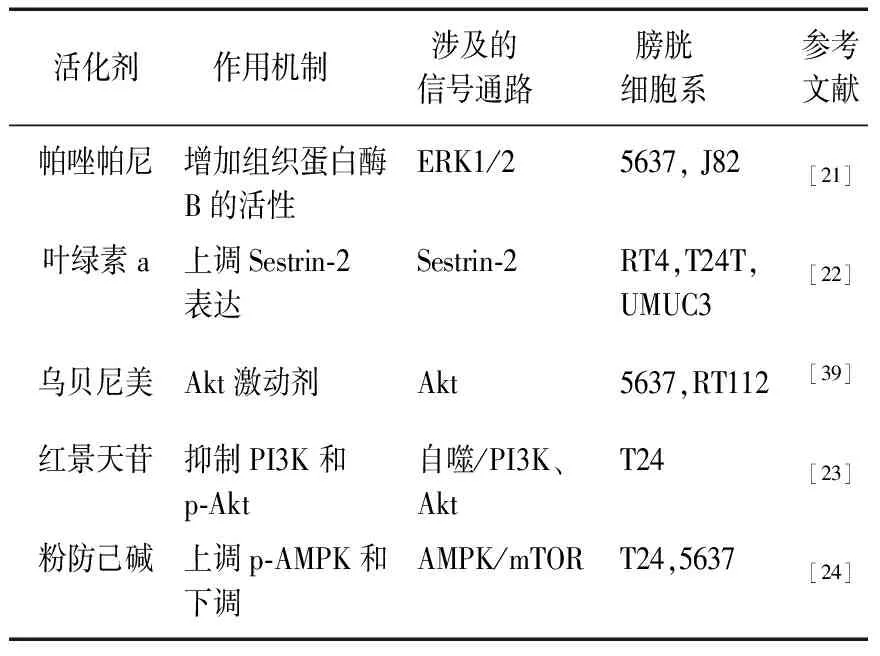
表2 自噬细胞死亡的激活剂
2.2.2红景天苷 红景天苷是从玫瑰红景天中分离出来的一种生物活性酪氨酸衍生的酚类化合物,具有抗疲劳、缺氧、心血管疾病和癌症的特性[41]。此外,红景天苷已被证明能诱导自噬细胞死亡以及膀胱癌细胞凋亡[23]。研究证实红景天苷通过自噬/PI3K/蛋白激酶B和基质金属蛋白酶9信号通路引起细胞凋亡[23]。Kou等[24]指出,粉防己碱诱导的自噬可能通过调节AMP活化蛋白激酶/哺乳动物雷帕霉素靶蛋白信号通路协同增强人膀胱癌细胞的凋亡。
2.2.3氨基肽酶N 氨基肽酶N被称为细胞表面分子CD13,参与多种细胞生命活动,包括细胞存活、血压调节、血管生成、肿瘤细胞的侵袭和转移[42]。有研究显示,氨基肽酶N通过下调氨基肽酶N表达抑制蛋白激酶B信号转导途径诱导自噬,从而抑制膀胱癌细胞的增殖、迁移和侵袭[39]。相反,3-MA的自噬抑制逆转了乌苯美司的抗增殖特性,表明乌苯美司能够诱导膀胱癌细胞自噬细胞死亡[39]。
3 结 语
尽管在过去的几十年进行了大量的研究来证实膀胱癌的新治疗方法,但是膀胱癌患者的治疗和长期存活率仍然相对停滞,临床结果没有显著改善。自噬已被证明是一个复杂的细胞过程,在治疗膀胱癌中具有不同的作用。自噬激活剂和抑制剂的应用为开发针对人膀胱癌新型治疗的选择提供了进一步认识。自噬抑制剂(包括氯喹和3-MA)可能更有利于膀胱癌治疗,因为它们能增加癌细胞对化疗或放疗的敏感性。因此,更好地了解自噬在膀胱癌发生发展各个阶段的机制及其在膀胱癌治疗中的作用对于选择靶向自噬途径的有效药物至关重要。

