外泌体在肺癌诊断及治疗中的应用前景
王丽 顾岩
肺癌是我国最常见恶性肿瘤。据我国2019年1月,国家癌症中心发布的最新全国癌症统计数据显示,发病率和死亡率位居首位的仍是肺癌[1]。肺癌起病隐匿,多数患者首次就诊时已处于中晚期,丧失了最佳治疗时机。肺癌病理类型中非小细胞肺癌(non-small cell lung cancer NSCLC)最常见,约占80%~85%。Ⅰ期非小细胞肺癌患者术后5年生存率可达80%, 而晚期患者术后5年生存率仅为15%左右, 且术后复发率较高[2]。因此高效的肺癌诊断标志物,是患者得到早期诊断、及时治疗、改善生活质量、延长患者生存期的有效途径。近年来多项研究表明,外泌体作为细胞间生物信息媒介,在肺癌的发生发展中起着重要作用,同时发现了在诊断和治疗方面的价值。本文着重从外泌体在肺癌诊断、治疗方面的作用进行综述。
外泌体概述
一、外泌体形成及其生物成分
外泌体(exosomes EXs)是组织细胞分泌的直径约40~160 nm纳米级脂质双膜层结构的细胞外多囊泡体(extracellular vesicle MVB)。主要指由细胞膜内陷,起源于内小体的多囊泡体称为exosomes,即外泌体,而由胞膜出芽方式分泌的囊泡,如微粒、微囊泡和大囊泡称为Extosomes[3]。EXs最初细胞膜内陷形成早期内体,早期内体与细胞器相互作用,进一步形成管腔内囊泡(intraluminal vesicle,ILV),ILV进一步成熟形成 MVBs[4]。MVB一部分与细胞膜融合以胞吐方式释放外泌,另一部分被溶酶体降解,还有一部分经胞内高尔基体再循环[5]。
外泌体含有多种生物活性物质,如核酸、蛋白质、脂质等。核酸包括:信使RNA(mRNA)、非编码RNA(miRNA、lncRNA)、单链DNA(ssDNA)、双链DNA(dsDNA)等。脂质成分主要含有磷脂酰丝氨酸、鞘磷脂、神经酰胺、胆固醇[6]。蛋白质成分最为丰富,如整合素和四跨膜蛋白(CD9、CD63、CD81和CD8)、热休克蛋白(如Hsp70、Hsp84)、Rab蛋白、肿瘤易感基因101蛋白(TSG101)、ALG-2相互作用蛋白X(ALix)、信号转导蛋白、膜融合蛋白、基质金属蛋白酶2(MMP2)等参与外泌体形成和分泌[3,7]。
二、外泌体细胞间通讯
外泌体携带其活性物质由细胞分泌到胞外,通过多种机制,进入靶细胞内,产生生物效应,改变受体细胞的生理病理状态。外泌体可经自身表面蛋白分子,直接与靶细胞膜融合,也可以通过受体-配体介导的各种信号通路(MAPK/MAP、mTOR、TGFR-β)进入靶细胞[8];而受体细胞通过网格蛋白依赖性内吞作用(clathrin-independent endocytosis,CIE)和巨胞饮作用(micropinoc-ytosis,MP)主动从其周围环境中的摄取外泌体[3-4,9]。EXs进入靶细胞后,调节受体细胞基因表达及功能。EXs通过上述途径参与肿瘤细胞增殖、转移侵袭、血管生成、免疫抑制、耐药等促进肿瘤发生发展过程。
外泌体在肺癌的诊断中的作用
外泌体因有脂质双层膜分子结构保护,其内容物(蛋白质、miRNA)可保持稳定存在,研究显示EXs在4℃, -20℃及-80℃条件下可保存3月至5年的时长[10]。肿瘤细胞分泌的EXs含有特异性蛋白质和核酸,能确切反映亲代细胞特征。EXs广泛存在于机体各种体液中,如血浆、唾液、泪液、尿液、羊水、支气管灌洗、脑脊液、腹腔液、胸腔积液和精液等[11]。EXs与活组织检查相比较,具有微创、取材方便、低风险、低成本,且能实时监测肿瘤动态等优势,具有成为新型肿瘤标志物的潜力。
一、外泌体miRNA
肺癌患者和健康个体的组织和外周循环中外泌体miRNA表达谱不同,因而外泌体miRNA对肺癌早期诊断具有潜在的临床价值。Rabinowits等[12]对肺腺癌患者血浆外泌体研究,结果显示肺腺癌组的平均外泌体浓度为2.85 mg/mL(95%CI: 1.94~3.76),对照组0.07 mg/mL (95%CI: 0.68~0.86);肺腺癌组的平均外泌体miRNA 浓度为158.6 ng/mL (95%CI: 145.7~171.5) ,明显高于对照组68.1ng/mL( 95%CI: 57.2~78.9),差异表达均有统计学意义(P<0.001),并且证实了周围循环外泌体miRNA与肿瘤细胞分泌的外泌体imRNA结构极为相似,认为循环中外泌体miRNA在肺癌患者和对照组中的差异表达有助于肺癌筛查。Grimolizzi等[8]研究中纳入45例NSCLC患者和31例健康个体,分别检测早期NSCLC、晚期NSCLC和健康对照组的血清、外泌体、无外泌体血清中的miRNA-126,发现晚期NSLCL患者血清miRNA-126水平显著下调。分析miRNA-126的分布情况,NSCLC的miRNA-126主要存在于外泌体中,且晚期NSCLC患者外泌体中miRNA-126水平更高,而健康对照组miRNA-126在血清和外泌体中分布均匀。评估血清miRNA-126和外泌体miRNA-126在肺癌诊断效能,受试者操作特征曲线分析(ROC)结果提示,外泌体miRNA-126的诊断肺癌的准确性更高。将NSCLC细胞来源外泌体与非肿瘤性上皮细胞(BEAS-2B)和内皮细胞共同孵育,观察到NSCLC外泌体可使BEAS-2B细胞恶性转化和血管生成。NSCLC细胞(A549)与人脐静脉内皮细胞来源外泌体(富含miRNA-126)共同孵育,发现A549细胞中miRNA-126水平明显升高,抑制A549细胞的增殖。表明NSCLC外泌体miRNA-126可诱导支气管上皮细胞血管形成和恶性转化,正常内皮细胞来源外泌体miR-126抑制NSCLC细胞的生长。发现miRNA-21也有促进肿瘤血管生成和恶性转化的作用,通过激活STAT3基因,增加受体细胞中血管内皮生长因子(VEGF)的水平。可见,外泌体miRNA-126、miRNA-21作为肺癌的诊断性生物标志物和治疗方法具有重要的应用前景。Zhang等[13]分析172名NSCLC患者和137名健康志愿者血清外泌体,发现miR-17-92家族中miR-17-5p在NSCLC患者血清中显著上调(P<0.001),其诊断效能评估,曲线下面积( AUC)值 0.746 (95%CI=0.677~0.806), 敏感度70.0%,特异度82.2%。外泌体miR-17-5p联合3种肿瘤标志物(癌胚抗原,CEA;细胞角蛋白片段19,CYFRA21-1;鳞状细胞癌抗原,SCCA)诊断效能明显高于单个miR-17-5p诊断结果,其AUC为0.860 (95%CI=0.802~0.906), 敏感度63.0% ,特异度93.3%,同时观察到高水平的miR-17-5p与肺癌淋巴结转移有显著相关性,因此miR-17-5p可用于肺癌辅助诊断及预后的生物标志物。有学者在外泌体促进尘肺患者癌变的研究中纳入了54例尘肺患者和100例健康个体,通过实时定量PCR分析(RT-qPCR)方法检测尘肺血清中外泌体,发现尘肺患者组外泌体let-7a-5p表达水平比健康对照组降低了21.67%,并在let-7a-5p中检测到BCL2L1、IGF1R基因在肺癌中表达上调具有统计学意义(P<0.001)。BCL2L1基因高表达降低患者生存率HR (95%CI)=1.75(1.33~2.30),而IGF1R基因表达对生存期无明显影响 HR (95%CI) =0.79(0.62~1.02)。因而认为外泌体let-7a-5p通过调控BCL2L1靶基因促进尘肺患者的癌变。let-7a-5p、BCL2L1基因表达水平可用于肺癌早期诊断和预后监测[14]。此外,Kanaoka等[15]采用miRNA微阵列法分析6例NSCLC患者中复发者的血浆外泌体,发现miR-451a表达量显著高于无复发及健康对照组。分析另外285例NSCLC患者(178例Ⅰ期、59例Ⅱ期、48例Ⅲ期肺癌患者)血浆中miR-451a表达,结果显示,miR-451a表达水平随疾病进展而增加,且与疾病分期、淋巴转移相关。miR-451a的上调可降低肺癌患者总生存率及无病生存率,表明外泌体miR-451a在肺癌发展中起着促进作用。进一步研究发现经质粒将miR-451a载入NSCLC细胞系中可通过下调RAS相关蛋白抑制肿瘤细胞增殖。因此深入探究外泌体miRNA在肺癌中的差异表达及其作用机制,有利于肺癌早期诊断、预后监测生物标志物的开发和应用。
二、外泌体蛋白
外泌体内蛋白质含量最为丰富,在外泌体生物合成及细胞间信息传递中起着关键作用。在肺癌细胞来源外泌体蛋白质,如表皮生长因子、脂多糖结合蛋白质、转化生长因子-β、整合素(α6β4 、α6β1)、四跨膜蛋白(TSPAN8)、信号转导相关的蛋白质(GRB2 、SRC)等,在肺癌中的差异表达促进肿瘤细胞增殖、肿瘤微环境形成、促血管生成及肿瘤转移等作用,在NSCLC诊断生物标志物开发有重要的临床意义。Sandfeld-Paulsen 等[16]分析431例肺癌患者和150例对照者血浆外泌体中的蛋白质,发现CD151、CD171和TSPAN8蛋白在肺癌患者中表达显著高于正常对照组(P<0.001),且能区分肺癌组织类型:CD151、CD171在肺腺癌中上调明显,而CD151、TSPAN8蛋白在肺鳞癌中表达明显,而在小细胞肺癌中CD151是唯一表达水平升高的蛋白标志物。进一步采用多种标志物组合模型评估诊断肺癌的效能,结果显示多种组合模型标志物诊断肺癌的准确率明显优于单一外泌体蛋白质的诊断结果。Wang等[17]研究中纳入89例转移性NSCLC患者和94例NSCLC患者,分析肺癌细胞来源外泌体蛋白质的诊断作用,首先从部分非转移性NSCLC患者、转移性NSCLC患者及健康个体中鉴定出628种蛋白质,其中522种蛋白质被量化,发现43种蛋白质的差异表达(34种上调,9种下调)在NSCLC中具有调节肿瘤细胞的生物学功能和转移作用。其中脂多糖结合蛋白质(lipopolysaccharidebind-ing proteins LBP),在转移性NSCLC患者外泌体中上调水平最明显,是非转移性肺癌外泌体中的含量高1.845倍,其诊断效能:曲线下面积(AUC):0.803,灵敏度为:83.1%,特异度为:67.9%。推测LBP是NSLCL转移的驱动因子。另外,有研究分析NSCLC患者和慢性肺炎患者外泌体,发现NSCLC组外泌体中表皮生长因子受体(EGFR)表达量是慢性肺炎组的4倍,进一步研究肺癌来源外泌体携带的EGFR对树突状细胞(Dendritic cells,DC)的影响,结果显示,外泌体EGFR可诱导肿瘤特异性调节T细胞(Tregs),抑制肿瘤抗原特异性CD8T细胞的功能,从而促进肿瘤发生发展[18]。EGFR也可激活肿瘤细胞MAPK和 Akt 信号通路,促进肿瘤血管形成、促进发生发展,为肺癌诊断及靶向治疗提供可靠依据[19]。
综上研究显示外泌体miRNA、蛋白质在肺癌的诊断、预后监测等方面有巨大应用价值,有望成为有效的肺癌诊断生物标志物。
外泌体在肺癌的治疗中的双向作用
一、外泌体可引起肿瘤细胞耐药性,促进肿瘤发展
目前晚期肺癌的治疗以化学、放射、分子靶向及免疫治疗的综合治疗为主,但患者预后普遍较差,而治疗中产生耐药是治疗失败的重要原因之一。肿瘤细胞分泌的外泌体可介导肿瘤细胞产生耐药,进而促进肿瘤的发展。Xiao等[20]研究发现顺铂(cisplatin,DDP)处理肺癌细胞(A549)后,富含miR-21的外泌体分泌量增加,将DDP处理的A549细胞与野生型细胞共同孵育,引起野生型细胞miR-21表达水平上调,并对DDP产生耐药。NSCLC细胞miR-425-3p靶向作用于AKT1,上调肿瘤细胞自噬水平,降低NSCLC细胞对铂类药物的反应性,而导致耐药[21]。另有研究表明吉西他滨耐药NSCLC细胞(A549-GR)分泌的外泌体携带miRNA-222-3p(GR-Exo)经胞吞作用进入吉西他滨敏感细胞(A549-P),从而引起A549-P的耐药。miRNA-222-3p通过直接靶向细胞因子信号转导抑制因子3(SCSO3)下调,促进肿瘤的复发和转移[22]。外泌体还可以通过排除肿瘤细胞内药物引起肿瘤细胞的耐药性。Luciani等[23]在研究质子泵抑制剂对肿瘤细胞耐药性影响的研究中发现,多种肿瘤细胞通过分泌外泌体排除化疗药物(铂类、阿霉素类),而产生耐药。肿瘤细胞来源外泌体可以改变肿瘤细胞对放疗的敏感性。研究证实经放疗治疗的NSCLC患者血清外泌体中miR-208a明显上调,通过靶向P21基因和激活AKT/mTOR信号通路,降低NSCLC细胞对放射的敏感性,促进肿瘤细胞的G1期停滞[24]。有研究报道,吉非替尼耐药的肺癌细胞分泌的外泌体富含miR-21,可引起吉非替尼敏感的细胞耐药,认为miR-21是引起耐药的关键分子[25]。可见miR-21不仅能引起常规化疗药物顺铂耐药[26],还能降低靶向药物的治疗效果。外泌体miRNA可通过多种方式介导肿瘤细胞产生耐药,进而促进肿瘤发展。
二、外泌体抑制肿瘤作用
近年来外泌体在肺癌治疗方面的研究越来越多,认为外泌体在肺癌的治疗领域中有望为新的治疗靶点。多项研究发现可通过减少外泌体含量、调控特异性miRNA的表达,增强肿瘤细胞对药物敏感性、提高抗肿瘤免疫等途径促进肿瘤细胞凋亡,抑制肿瘤细胞增殖、侵袭及转移。以外泌体为靶点抑制肿瘤方式大致概括如下:①减少外泌体含量。有学者报道经血液透析减少循环系统中外泌体含量,为抗肿瘤治疗提供辅助作用[27]。Fabbri等[28]在研究中发现给予肺癌小鼠注射外泌体抑制剂(GW4869)后,可抑制肺癌细胞增殖。②调控特异性外泌体的表达:Li等[29]证实耐紫杉醇肺腺癌细胞(A549/PTX)、顺铂耐药肺癌细胞(A549/PTX)中mi R-181a过度表达,促进肺腺癌细胞(A549)细胞上皮间充质转化(EMT),而抑制miR-181a表达,可逆转A549/PTX和A549/PTX细胞EMT表型,并增强肺腺癌细胞对紫杉醇和铂类化疗敏感性。上调外泌体miR-630在NSCLC细胞中的表达,通过靶向LM03蛋白,可抑制肿瘤细胞的生长增殖及转移[26]。③外泌体提高抗肿瘤免疫。树突状细胞来源外泌体,具有激活免疫细胞、杀伤肿瘤细胞,促进瘤细胞调亡作用。在一项Ⅱ期临床实验中观察到,22例对铂类不敏感晚期NSCLC患者接受口服环磷酰胺联合树突状细胞来源外泌体(皮下注射),发现部分患者病情无进展,且体内NK细胞明显被活化[30]。④增强药物敏感性。Adi Harel等[31]研究证实,通过表观修饰(DNA甲基化或组蛋白去乙酰化)激活miR-512和miR-373,增强肺癌细胞对顺铂的敏感性,促进细胞凋亡,抑制细胞增殖迁移。外泌体miRNA也可以诱导肿瘤细胞对放射敏感,增强放射治疗效果。外泌体miR-1246通过靶向死亡受体 5(DR5)来调节肺癌细胞对放射治疗的敏感性[32]。⑤外泌体制剂,靶向肿瘤组织作用。Kim等[33]将紫杉醇(PTX)载入外泌体中制成外泌体紫杉醇制剂(exoPTX),研究NSCLC中抗肿瘤作用,发现外泌体能够将药物足量有效的运送至肿瘤细胞内,并且对耐药肺肿瘤有显著治疗效果。另有研究发现,在体内及体外实验中载有雷公藤的外泌体制剂,对肺癌肿瘤的抑制作用明显高于游离雷公藤的治疗效果,且血液学及肝肾功能检测表明无明显毒副作用[34]。因此,肺癌相关外泌体的研究,将为肺癌精准有效的治疗方面提供新的思路。
小结和展望
目前肺癌筛查相关辅助检查(低剂量胸部CT、肿瘤标志物等)效率较低,而活组织检查为侵入性检查,风险高、并发症多、无法进行多次活检,难以了解肿瘤动态变化。外泌体内富含多种生物活性物质,能确切反应亲代细胞特征,作为细胞间交流的重要媒介,可将其携带的生物活性物质传递给受体细胞,改变受体细胞的生物学行为,在肺癌的发生、发展、转移中有重要意义。肺癌细胞源外泌体所含特异性成分,在肺癌的诊断及治疗中显示出重要的临床价值。外泌体存在于机体多种体液中,作为潜在的新型肿瘤标志物,相对于传统肺癌相关检查,外泌体具有微创、取材方便、低风险、低成本,且能反复取样,实时监测肿瘤动态等优势。外泌体为脂质双膜层结构分子,作为潜在的新型药物载体,具有低免疫原性、高生物相容性、低毒性等优势,直接靶向肿瘤组织,实现抗肿瘤治疗。总之,肺癌细胞来源的外泌体在肺癌的诊断及治疗中,有巨大的临床价值。随着对外泌体发生、细胞间信息传递机制的深入探究,相信外泌体将会在肺癌诊断及治疗领域带来良好的临床应用前景。
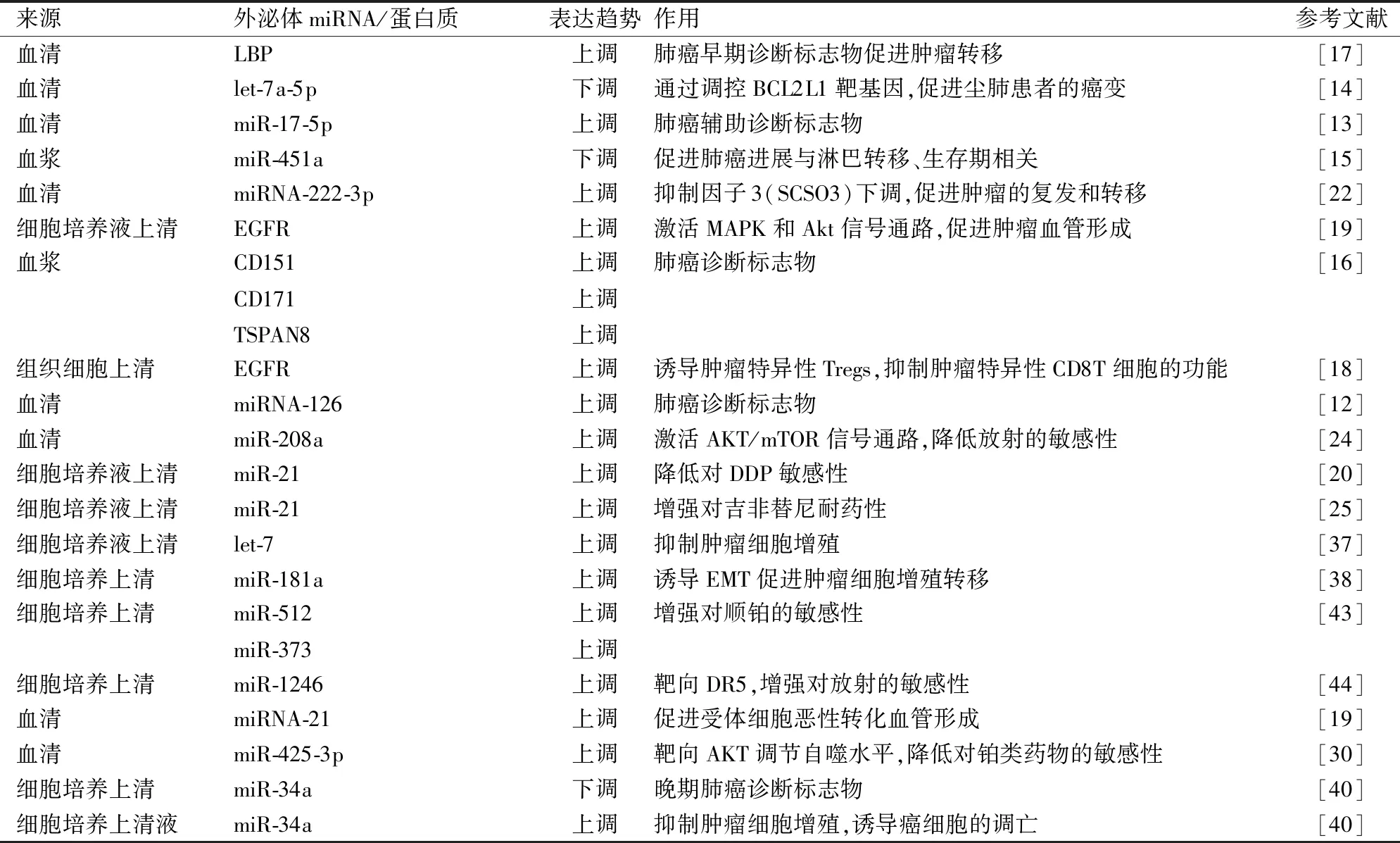
表1 外泌体在肺癌中的作用
——外泌体与老年慢性疾病相关性的研究进展

