八棱海棠耐盐株组培方法及其后代的耐盐性研究*
胡爱双,吴雅琴,程和禾,张小栋,李凯超,孙 宇,王文成
(1 河北省农林科学院滨海农业研究所,唐山063200)(2 国家林业和草原局盐碱地中心)(3 河北省盐碱地绿化技术创新中心)(4 河北省农林科学院昌黎果树研究所)
据估计,全球约有1/5 的灌溉土地受到盐渍化影响,这严重影响了当地农林业生产及生态环境建设[1-3]。种植耐盐植物改良盐碱地,成本低,效果好,是开发利用盐碱地的有效途径[4]。八棱海棠(MalusrobustaRehd.)属蔷薇科苹果属,小乔木,树姿优美,花量大,观赏价值高;根系发达,树体强健,抗寒、抗旱、耐盐碱、耐贫瘠等[5],是苹果常用的砧木。八棱海棠中有极强的耐盐株和耐碱株,是优异的耐盐碱种质资源[6-9]。八棱海棠为高度杂合种,生产上多采用实生繁殖,优良性状在子代中不能保持。组织培养是保持八棱海棠优良性状的重要途径。郑志新等[10]、李文然等[11]、赵亮明等[12]对八棱海棠组织培养进行过研究,但未形成完整的体系,关于耐盐八棱海棠植株的组织培养也未见报道。我们以前期筛选得到的耐盐八棱海棠植株[13]为试材,对其开展组培快繁体系研究,并对其组培后代的耐盐性进行鉴定,以期为耐盐八棱海棠在滨海盐渍地区的景观或苹果产业中的推广应用提供参考。
1 材料与方法
1.1 试验材料
耐盐八棱海棠植株由河北省农林科学院滨海农业研究所筛选获得,并定植于该所现代农业成果转化基地,5 年生;普通八棱海棠植株的组培苗由河北省农林科学院昌黎果树研究所提供。
1.2 试验方法
1.2.1组织培养
(1)外植体。试验在河北省农林科学院昌黎果树研究所生物技术室进行。2018 年3 月中旬从八棱海棠耐盐植株上剪取无病虫害、叶芽饱满的1 年生枝条,带回实验室,插入自来水中,放置于培养室培养。约1 周后叶芽萌动,枝条剪成单芽茎段,剥去鳞片,露出绿色叶片,用自来水冲洗干净,在无菌条件下,放入100 mL 灭菌的三角瓶中,用70%酒精消毒30 s,无菌水冲洗3 次,0.1%HgCl2消毒8~10 min,无菌水冲洗3~5 次,用手术刀切下休眠芽,接种到诱导培养基上,置于培养室培养。培养温度为(25±2)℃,光照16 h/d,光照强度为2 000 lx。
(2)诱导培养基的筛选。MS(30 g/L 白砂糖,6.5 g/L 琼脂,pH 值5.8)+0.1 mg/L NAA(萘乙酸),加入不同浓度6-BA(6-卞基腺嘌呤),浓度分别为1.0、1.5、2.0 mg/L。每瓶接种4 个芽,每个处理接种30 瓶,30 d 后统计各处理的芽诱导率。
(3)继代培养基的筛选。将诱导萌发的芽接种在继代培养基上。试验设4 个组合,MS(30 g/L白砂糖,6.5 g/L 琼脂,pH 值5.8)+0.05 mg/L NAA,加入不同浓度6-BA,浓度分别为0.3、0.5、1.0、1.5 mg/L。每瓶接种4 个芽,每个处理接种30 瓶,30 d 后统计各处理芽的增殖系数。
(4)生根培养基的筛选。继代培养30 d 左右,选取长1.5~2.0 cm 且有3 片以上舒展叶片的健壮苗,从基部切下,转移到生根培养基上诱导生根。生根培养用1/2 MS 培养基(20 g/L 白砂糖,6.5 g/L琼脂,pH 值5.8),附加0.3 mg/L IAA(吲哚乙酸)+0.3 mg/L IBA(吲哚丁酸)、0.5 mg/L IAA+0.5 mg/L IBA 或1.0 mg/L IAA+0.5 mg/L IBA,每瓶接种5 株苗,每个处理接种30 瓶,30 d 后统计各处理生根株率,记录根系生长情况。
(5)炼苗与移栽。幼苗长出不定根3~5 条、长3 cm 左右,移到日光温室进行炼苗,用遮阳网遮阴,1 周后去掉遮阳网。炼苗15~20 d 后打开瓶盖,3 d 后移栽。移栽时用镊子从瓶中轻轻取出苗,用水洗净根部琼脂,栽植在装有灭菌处理的蛭石、草炭土和细沙(1∶1∶1)的营养钵中,搭塑料小拱棚,温度保持在25 ℃左右,湿度控制在85%~95%,1 周后逐渐通风,2 周后有新根产生,3 周后撤去塑料布。在温室生长1 个月后,营养钵中的苗移入田间。
1.2.2组培苗耐盐性鉴定
在耐盐株系和普通株系的继代增殖培养基中附加不同浓度的NaCl,浓度分别为0、0.15%、0.3%、0.45%、0.6%、0.75%,八棱海棠耐盐株系和普通株系每个盐浓度处理接种12 瓶,每瓶接种4 个芽。14 d 后观察,根据叶片受害程度确定盐害等级,计算各处理组培苗的盐害指数。
盐害分级标准:0 级,全株无盐害症状;1 级,轻度盐害,小于20%的叶片边缘轻微发黄、枯焦;2 级,中度盐害,近50%的叶片发黄、枯焦或脱落;3 级,重度盐害,50%以上的叶片发黄、枯焦或脱落;4 级,极重度盐害,90%以上的叶片枯焦、脱落或植株死亡。
盐害指数(%)=[∑(受害株数×相应级值)/(调查总株数×4)]×100
2 结果与分析
2.1 组织培养
2.1.16-BA 浓度对耐盐株系芽萌发的影响
在MS+0.1 mg/L NAA 培养基中,在1.0~2.0 mg/L 范围内,6-BA 浓度越高,芽萌发率越高,但是6-BA 浓度为2.0 mg/L 的培养基,芽萌发后需转入低浓度培养基才能正常生长,否则,叶片皱缩、畸形。诱导芽萌发的最适宜培养基为MS+1.5 mg/L 6-BA+0.1 mg/L NAA。
2.1.26-BA 浓度对耐盐株系芽增殖的影响
从表1 可以看出,在MS+0.05 mg/L NAA 培养基中,6-BA 浓度对芽增殖和新梢生长的影响较大。随着6-BA 浓度的增加,芽的增殖系数增加。6-BA浓度为0.3 mg/L 时,幼苗生长较弱;6-BA 浓度为1.5 mg/L 时,随着培养时间的延长,幼苗玻璃化现象严重;6-BA 浓度为1.0 mg/L 时,1 代苗生长健壮(图1),但连续3 代苗培养基中都附加1.0 mg/L 6-BA,幼苗容易产生玻璃化现象;6-BA 浓度为0.5 mg/L 时,幼苗生长健壮。建议试管苗继代增殖培养基交替使用MS+0.5 mg/L 6-BA+0.05 mg/L NAA 和MS+1.0 mg/L 6-BA+0.05 mg/L NAA,以保证新梢的正常生长。
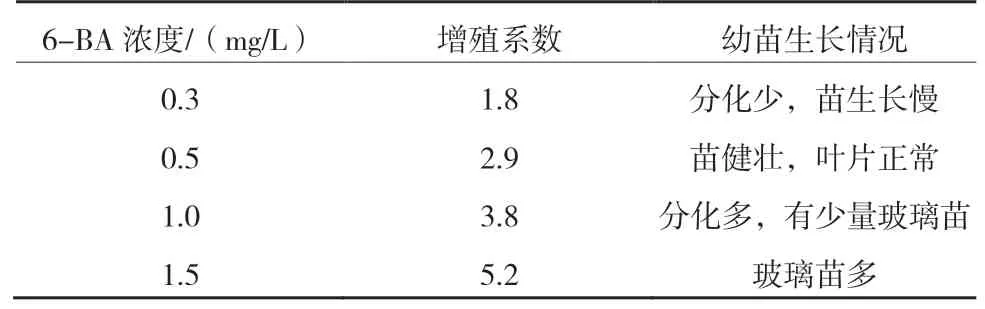
表1 八棱海棠耐盐株系在不同6-BA 浓度培养基中的增殖培养情况
2.1.3IAA 和IBA 组合对耐盐株系生根的影响
从表2 可以看出,以1/2 MS 为基本培养基,IAA和IBA 的浓度配比明显影响根的质量和生长状况。当配比为1.0 mg/L IAA+0.5 mg/L IBA 时,幼苗的生根数最多,生根株率也高,但根多数由愈伤组织发生,移栽时易碰掉;当配比为0.3 mg/L IAA+0.3 mg/L IBA 时,根生长正常,但生根数较少,生根株率也较低;当配比为0.5 mg/L IAA+0.5 mg/L IBA时,生根数较多,生根株率最高,根系正常且健壮(图2)。
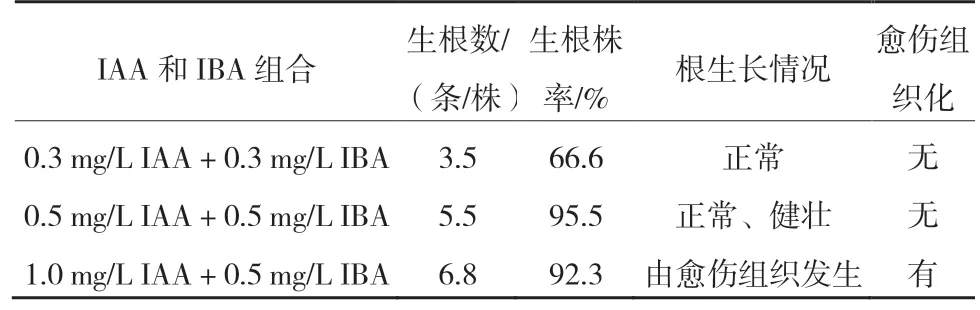
表2 八棱海棠耐盐株系在不同浓度IAA 和IBA 培养基中的生根培养情况
2.1.4炼苗与移栽
经过在日光温室进行强光和开口炼苗后,再移栽至装有灭菌基质的营养钵中,罩小拱棚保持温湿度,耐盐株系组培苗移栽成活率达90%(图3)。

图1 八棱海棠耐盐株系组培苗

图2 八棱海棠耐盐株系组培苗生根情况

图3 八棱海棠耐盐株系苗的生长情况
2.2 组培苗耐盐性鉴定
从图4 和图5 可知,随着培养基中盐浓度的增加,八棱海棠耐盐株系和普通株系组培苗盐害指数均升高,同一NaCl 浓度,普通株系盐害指数明显高于耐盐株系。NaCl 浓度为0.45%时,耐盐株系的盐害指数仅为8.33%,盐害非常轻微,而普通株系盐害指数已达到58.33%,盐害较重;NaCl 浓度为0.75%时,耐盐株系的盐害指数虽然达到41.67%,但组培苗尚都存活,普通株系已出现死亡现象。
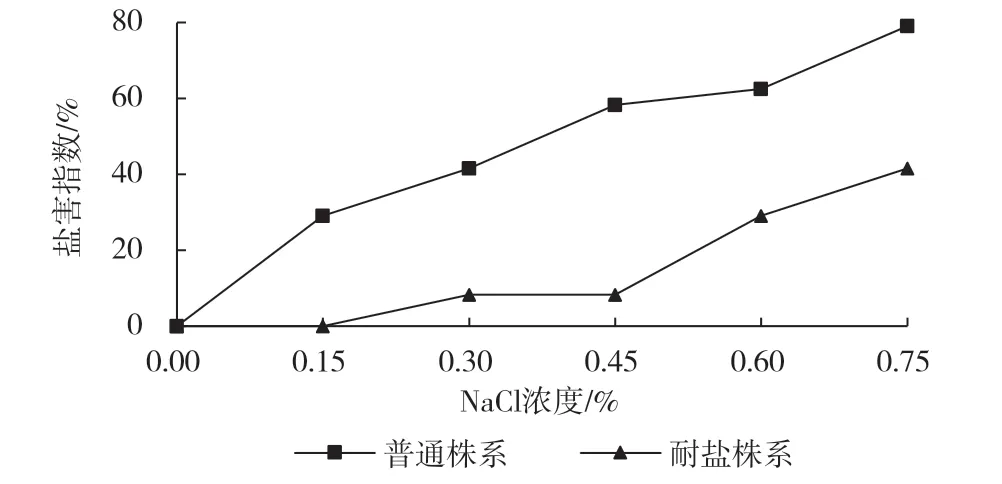
图4 八棱海棠耐盐株系和普通株系盐害指数随NaCl 浓度上升的变化情况

图5 八棱海棠耐盐株系和普通株系在不同NaCl 浓度胁迫下的组培苗生长情况
3 结论与讨论
本试验的研究结果显示,诱导八棱海棠耐盐株系芽萌发的最适培养基为MS+1.5 mg/L 6-BA+0.1 mg/L NAA,茎尖膨大,叶片正常;建议试管苗继代增殖培养基为MS+0.5 mg/L 6-BA+0.05 mg/L NAA和MS+1.0 mg/L 6-BA+0.05 mg/L NAA 交替使用,增殖系数为2.9~3.8,苗壮、健康;最佳生根培养基则为1/2 MS+0.5 mg/L IBA+0.5 mg/L IAA,生根株率可达95.5%。在温室进行强光和开口炼苗后,移栽至装有灭菌基质(蛭石∶草炭土∶细沙=1∶1∶1)的营养钵中,罩小拱棚保持温湿度,移栽成活率可达90%。
盐害指数是根据植株生长表现性状来反映植株受盐害程度的指标[14-15],盐害指数越高,说明植株受到的盐害越重。本试验结果显示,普通株系盐害指数明显高于耐盐株系,说明耐盐株系组培苗有较强的耐盐性,且其耐盐性在组培后代中得以遗传。

