基于自噬基因mRNA-microRNA研究白杨素抑制LPS所致RAW264.7细胞炎症的机制
胡子旋,蔡大可,李钰婷1,,黄雪君,甘海宁,黄丹娥,姚楠,陈玉兴*
(1. 广州中医药大学第五临床医学院,广东 广州 510405; 2.广东省中医药工程技术研究院,广东 广州 510095; 3.广东省中医药研究开发重点实验室,广东 广州 510095)
炎症是机体抵御生理应激的基本防御机制,常见于组织创伤、感染性或缺血性疾病以及代谢紊乱、自身免疫应激等各种疾病过程中[1-2]。适度的炎症可以清除损伤组织,启动防御性愈合,恢复机体内稳态,但过强的炎症反应也会引起机体损伤,加重疾病过程[3-4]。白杨素是黄酮类化合物中最具生物活性的成分之一,有文献表明白杨素具有较强的抗炎、抗氧化等药理活性[1,5],其抗炎机制与消除细胞中的活性氧及调控NF-κB通路有关[6],但是白杨素的抗炎作用是否与其调控自噬过程相关,未见报道。
自噬是真核细胞中的一种高度保守的分解代谢过程,其在能量匮乏时重新利用细胞内成分获取能量,在应激条件下吞噬有害蛋白和细胞器,形成一种对抗细胞内病原体的重要防御机制[7-8]。有文献报道了自噬作为细胞保护方式参与机体免疫和炎症调控的机制[9],有利于成为拓展开发抗炎药物的新靶点。microRNA是一种转录后调节因子,可以通过靶向调控mRNA的转录进而调节自噬过程的不同阶段[8],在疾病的预防与治疗中发挥着重要作用。本研究着重评估自噬以及自噬相关microRNA与白杨素抗炎作用的相关性,为深入探索白杨素抗炎作用提供基因水平和表观遗传学方面的基础。
1 材料与方法
1.1 药品与试剂
RAW264.7小鼠巨噬细胞系购自上海中科院细胞库。纯度为98.5%的白杨素(北京坛墨质检科技有限公司,中国,批号BW5648);脂多糖(LPS,广州奕元生物技术有限公司,中国,批号20200115);二甲亚砜(DMSO,上海生工生物工程有限公司,中国,批号EB26BA0032);MEM-alpha高糖培养基(Gibco公司,美国,批号8118414);胎牛血清(Bovogen公司,澳大利亚,批号1909A);Penicillin-Streptomycin Solution双抗(上海生工生物工程有限公司,中国,批号G402FA0002);CCK8试剂盒(北京索莱宝科技有限公司,中国,批号616A011);总RNA提取试剂Trigol(北京鼎国昌盛生物技术有限公司,中国,批号NEP019-2);RT-qPCR试剂盒(TaKaRa公司,日本,批号1904856A);Mir-XTMmiRNA试剂盒(TaKaRa公司,日本,批号1809671A)。
1.2 主要仪器
细胞培养箱(ThermoFisher公司,美国);Bio-RAD全自动酶标仪(ThermoFisher公司,美国);IQ5荧光定量PCR仪(ThermoFisher公司,美国);CKX41型倒置显微镜(奥林巴斯,日本)。
1.3 方法
1.3.1 细胞培养 使用含有10%(φ)胎牛血清与1%双抗的MEM-alpha培养基培养RAW264.7细胞。将细胞置于37 ℃、5%(φ)CO2恒温培养箱中,每隔24 h置于倒置显微镜下观察细胞生长状态,取对数生长期的细胞用于实验。
1.3.2 细胞活性检测 将RAW264.7细胞接种于96孔板,调节细胞浓度为104/mL孔,细胞培养箱中培养24 h。白杨素纯度为98.5%,摩尔质量为254.24,称取9.6 mg的白杨素溶于185 μL DMSO溶液中,配成200 μmol/L的白杨素溶液。将白杨素用MEM-alpha培养基稀释成不同药物浓度(0、3.125、6.25、12.5、25、50、100、150、200 μmol/L)。更换细胞培养液,加入不同浓度的药物,继续培养24 h。加入CCK8试剂10 μL/孔,培养1 h后用酶标仪检测在562 nm波长下各孔的A(λ)值,计算存活率。
存活率=实验组A(λ)均值/对照组A(λ)均值×100%
1.3.3 实时定量荧光PCR检测 将4×105/mL的RAW264.7细胞接种于6孔板,培养24 h后,更换培养液,设置空白对照组,LPS模型组(0.1 μg/mL),LPS+白杨素高、中、低剂量组,每组设3个平行孔,继续培养24 h。弃去上清,Trigol处理细胞样品,提取总RNA,按照PCR试剂盒说明书操作,逆转录为cDNA。
将1 μL cDNA、11 μL ddH2O、0.25 μL前引物F、0.25 μL后引物R、12.5 μL SYBRGreen、0.5 μL ROX混合后,以94 ℃×5 min→94 ℃×30 s→5 ℃×30 s→72 ℃×50 s(45个循环);72 ℃×7 min进行扩增,运用2-ΔΔCt法计算基因表达量。引物设计利用Primer 5.0生物软件,基因的引物由上海英潍捷基公司合成,引物序列如表1所示。
1.3.4 microRNA 检测方法 总RNA提取方法同“1.3.3”,按照microRNA试剂盒说明书操作,逆转录为cDNA。将2 μL cDNA、9 μL ddH2O、0.5 μL特异引物、0.5 μL通用引物Mrq3'primer、12.5 μL SYBR Green、0.5 μL ROX混合后,以95 ℃×10 s→ 95 ℃×5 s→ 60 ℃×20 s→ 95 ℃×60 s→ 55 ℃×30 s(40个循环);60 ℃进行扩增,运用2-ΔΔCt法计算基因表达量。引物由Takara公司合成,引物序列如表2所示。

表1 扩增的基因引物信息
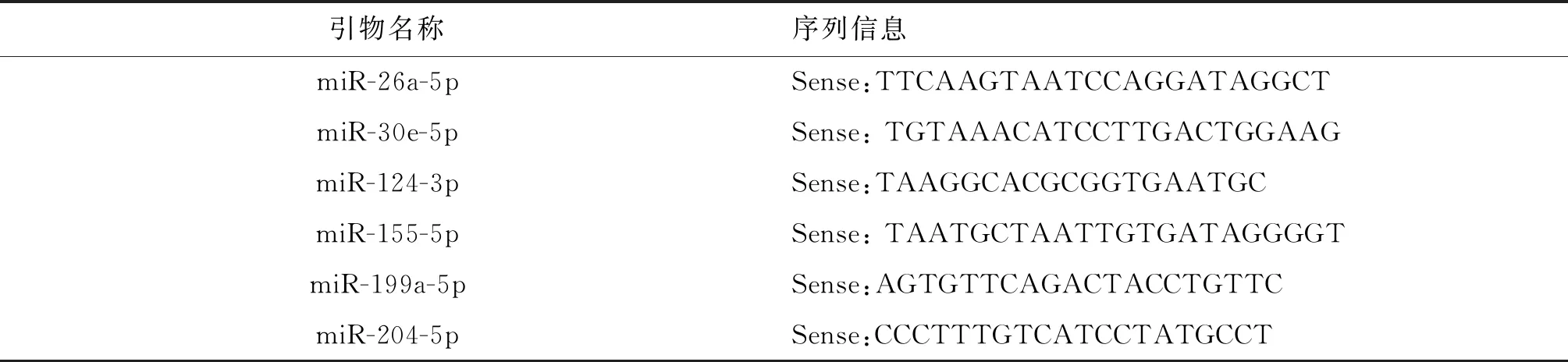
表2 microRNA引物序列
1.3.5 数据统计 由IBM SPSS22.0软件进行数据统计,多组间比较采用单因素方差分析;组间两两比较,方差齐采用SNK法,方差不齐采用DunnettT3检验,P<0.05为差异有统计学意义。
2 结果
2.1 白杨素对RAW264.7细胞存活率的影响
CCK8检测不同浓度白杨素对Raw264.7细胞的毒性。结果如图1,细胞存活率随着白杨素浓度的升高而降低,12.5~200 μmol/L时细胞存活率低于90%,6.25 μmol/L时对RAW264.7细胞活力没有显著影响,可作为白杨素抗炎及机制的安全浓度范围。因此实验采用5、0.5、0.05 μmol/L浓度作为白杨素高、中、低剂量。
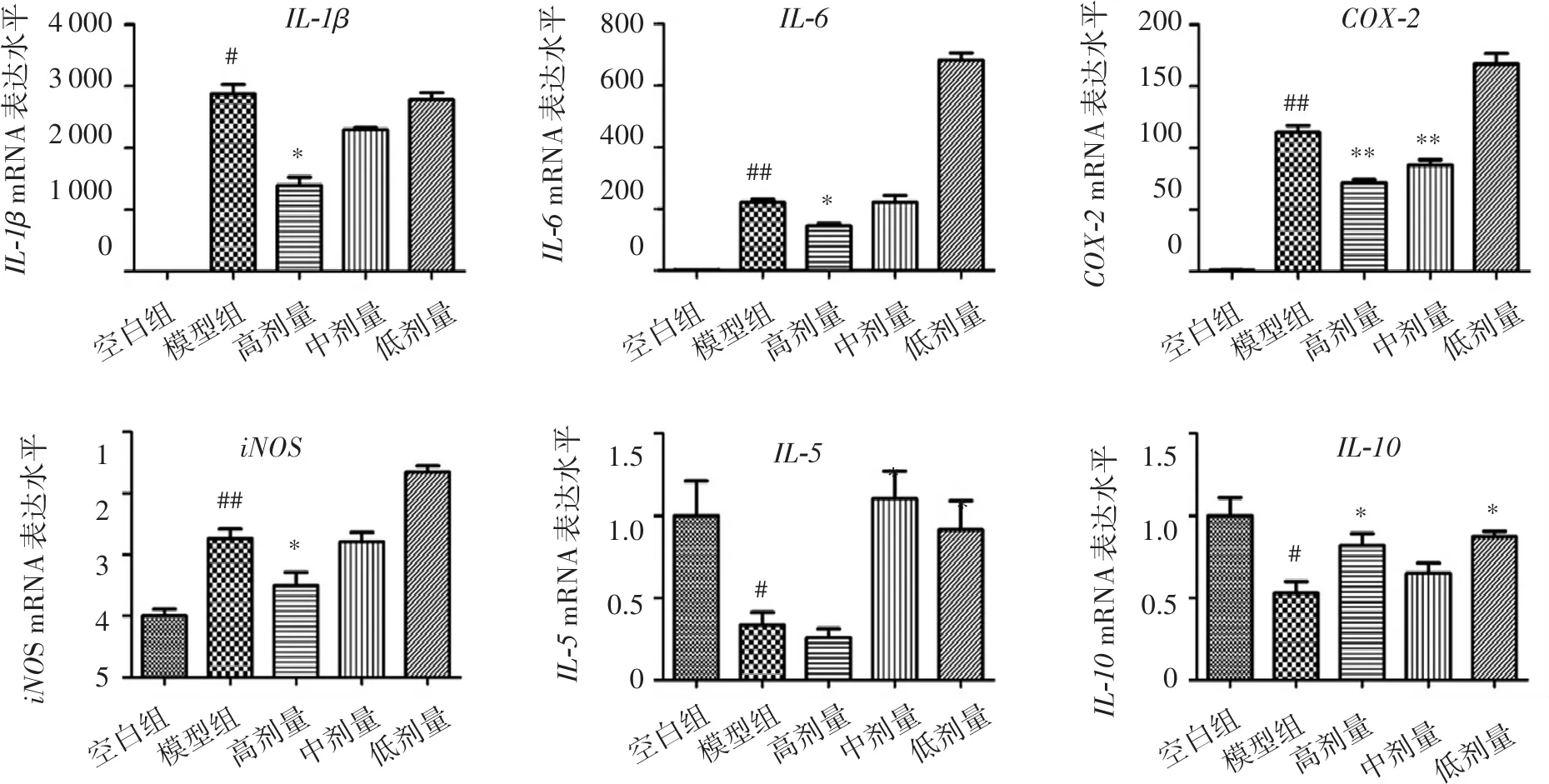
2.2 白杨素对炎症和自噬相关基因表达水平的影响
白杨素对炎症相关基因的影响如图2。与空白组相比,LPS组中IL-1β、IL-6、COX-2、iNOS基因表达显著上升(P<0.05或P<0.01),药物干预后,IL-1β、IL-6、COX-2、iNOS的表达水平显著下降(P<0.05或P<0.01);与空白组相比,模型组IL-5、IL-10基因表达明显下降(P<0.05),白杨素给药组中IL-5、IL-10有明显上调作用(P<0.05)。
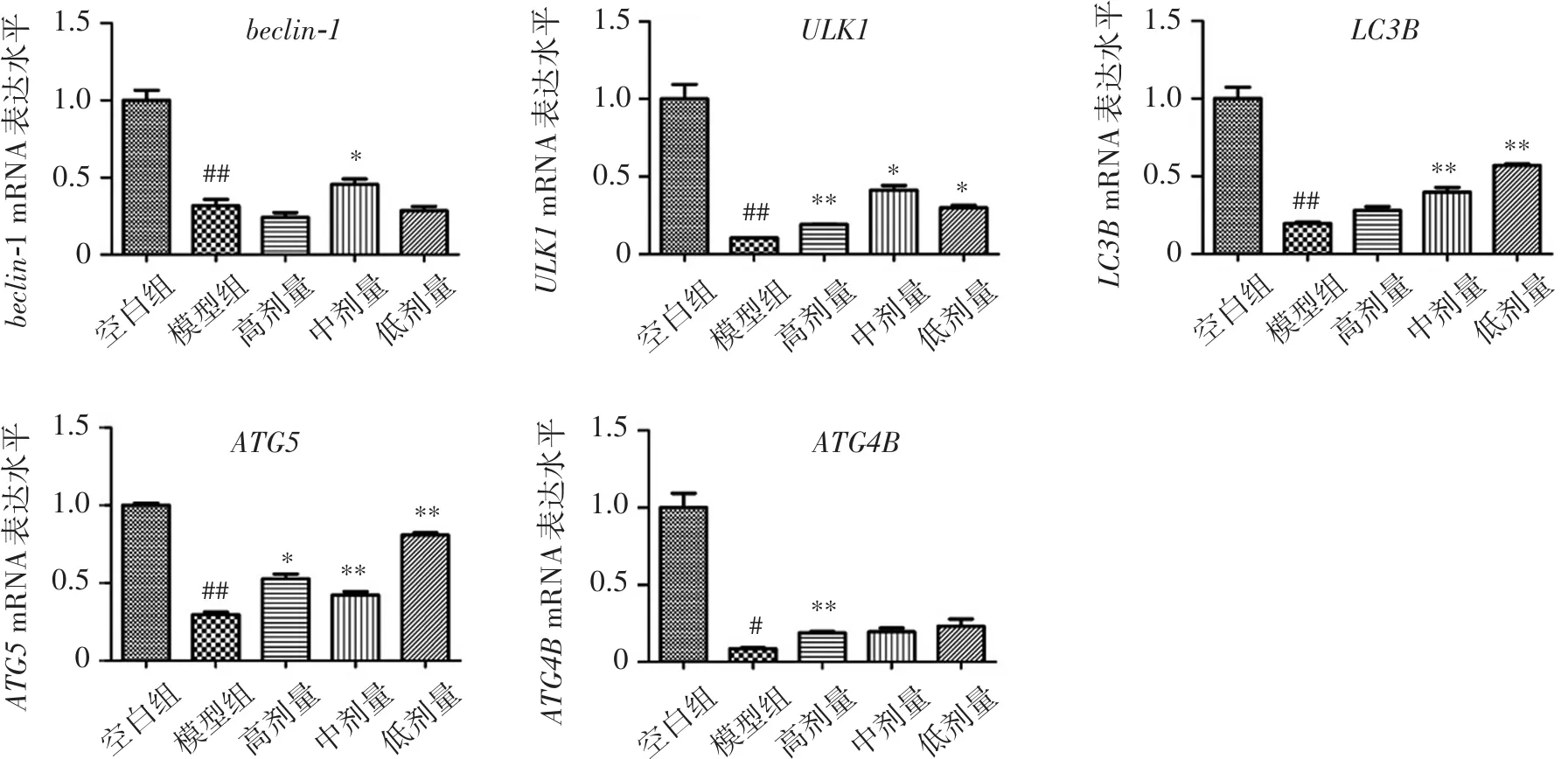
自噬相关基因表达结果如图3。与模型组相比,白杨素组能明显上调beclin1、ULK1、LC3B、ATG5、ATG4B基因的表达(P<0.05或P<0.01)。
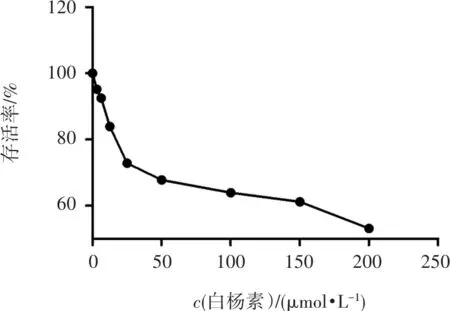
图1 白杨素对RAW264.7细胞存活率的影响
2.3 白杨素对microRNA表达的影响
自噬相关microRNA的表达结果如图4。与空白组相比,模型组miR-26a-5p、miR-30e-5p、miR-124-3p、miR-155-5p、miR-199a-5p、miR-204-5p的表达显著上升(P<0.05或P<0.01);与模型组相比,白杨素组miR-26a-5p、miR-30e-5p、miR-124-3p、miR-155-5p、miR-199a-5p、miR-204-5p的表达显著下降(P<0.05或P<0.01),并呈现浓度依赖性。
与空白组比较:#P<0.05,##P<0.01; 与模型组比较:*P<0.05,**P<0.01。
与空白组比较:#P<0.05,##P<0.01; 与模型组比较:*P<0.05,**P<0.01。

与空白组比较:#P<0.05,##P<0.01; 与模型组比较:*P<0.05,**P<0.01。
3 讨论
巨噬细胞是一种具有较强的可塑性和异质性的细胞群体,在不同微环境下分化成具有不同生物学特性和功能的亚型,主要可分为M1和M2型。M1型巨噬细胞通过IFN-γ和脂多糖LPS活化,产生促炎因子(如IL-1β、IL-6),引发免疫反应,同时可激活炎症相关酶类(iNOS、COX-2),加剧对健康有害的炎症过程;M2型巨噬细胞通过Th2免疫应答分泌抗炎因子IL-10和TGF-β,抑制炎症反应,减少促炎因子引起的组织损伤[10-11]。本研究结果显示白杨素能显著降低IL-1β、IL-6、COX-2、iNOS的基因水平,抑制巨噬细胞的炎症反应,显示出良好的抗炎活性。同时白杨素能上调抗炎因子IL-10和调节因子IL-5的表达水平,促进组织修复而减少炎症反应,提示白杨素能够促进RAW264.7细胞向M2转化。结果中白杨素调控IL-5、IL-10等炎症因子不呈现剂量相关性,可能由于这些炎症因子的调控不属于白杨素的直接靶点,是白杨素多靶点调控巨噬细胞的结果。
鉴于自噬与巨噬细胞中炎症的调控有着密切的关系[12],因此推测白杨素的抗炎机制与自噬相关。自噬体的形成是多种基因共同调控的结果,特别是自噬的激活以及自噬通量对于减少炎症的损伤有关键意义[13]。本实验将beclin1、ULK1、LC3B、ATG5、ATG4B作为自噬启动的检测指标,研究白杨素调控炎症的分子机制。有研究表明白杨素可通过抑制mTOR从而激活自噬,发挥抗炎作用[14]。同时有报道PI3K/Akt-Beclin1通路负向调节NF-κB依赖的炎症反应从而抑制TNF-a、IL-1β的产生[15]。本实验中也发现白杨素发挥抗炎作用的同时上调了炎症模型中自噬基因的表达,说明在巨噬细胞的抗炎调控中与文献报道机制相似。在脂多糖刺激的巨噬细胞中,iNOS可与自噬受体p62相互作用并共定位,同时可与LC3部分共定位,作为自噬底物被招募到自噬体进行降解[16]。本实验结果中LC3B表达量与iNOS表达量变化趋势相反,本实验结果验证巨噬细胞通过自噬降解iNOS从而抑制炎症反应的机制,同时提示白杨素发挥抗炎药理作用的分子机制与自噬相关基因的mRNA水平调控密切相关。综上所述,在LPS所致炎症过程中,自噬相关蛋白LC3B、beclin1、ATG5、ULK1、ATG4B等在转录阶段已经受到抑制,LPS可能抑制上述蛋白聚集而形成的自噬小体,特别是对于自噬小体囊膜构成具有重要意义的LC3B、beclin1基因[17-18],也使得后续发挥降解蛋白功效的自噬溶酶体无法形成。白杨素可能通过逆转LPS所致自噬抑制的机制而发挥抗炎作用,而自噬相关mRNA受到抑制的原因可能与调控mRNA水平的因素相关,为了进一步探索其机制,本研究从负性调控mRNA的microRNA进行了探索。
白杨素显著调控与自噬启动、生成相关的mRNA,而microRNA对mRNA具有负性调控作用,能够在细胞质内降解目标mRNA[8],于是检测了多个自噬相关microRNA(如表3)。结果表明白杨素可下调miR-26a-5p、miR-30e-5p、miR-124-3p、miR-155-5p、miR-199a-5p、miR-204-5p表达水平,而且白杨素对于microRNA的调控呈现剂量依赖关系。有研究发现ULK1是miR-26a-5p的一个重要靶点,miR-26a-5p通过抑制ULK1的表达而抑制自噬的启动[19]。在双膜延伸阶段,miR-124-3p能够直接作用于beclin1而下调自噬水平,阻止吞噬泡的形成[18]。miR-204-5p能靶向调控LC3B,从而影响自噬体的形成[20]。可见多个microRNA调节着自噬过程的不同阶段,研究结果中白杨素调控多个microRNA,也提示白杨素的作用机制可能是多靶点的,与多个通路相关的。本研究提示白杨素作为黄酮类成分具有多靶点调控的特点,与文献报道有类似的地方[1]。鉴于表观遗传学角度探讨白杨素抗炎作用的报道较少见,本研究从microRNA和mRNA关联调控着手,为深入剖析白杨素调控的关键靶点提供前期基础。
本研究从microRNA和mRNA的水平上探索了白杨素调控自噬与抑制炎症的相关性,但确切的关联机制及关键信号通路有待挖掘。
综上所述,白杨素能有效抑制RAW264.7细胞的炎症反应,同时白杨素发挥抗炎作用可能是调控自噬相关mRNA和microRNA共同作用的结果。

表3 microRNA对应调控的基因靶点及其功能

