毛果杨NAC128基因在次生壁形成中的功能*
李 媛 陈金焕 金 曌 侯景丫 姜玉松 邢海涛
(1. 重庆文理学院 经济植物生物技术重庆市重点实验室 重庆 402168;2. 北京林业大学 林木分子育种高精尖创新中心 北京 100083)
木材是木本植物最重要的可再生资源,不仅广泛用于建筑、家具生产和造纸业,而且是生物质能源的重要来源。次生壁是木材的主要成分,主要由木质素、纤维素、半纤维素以及少量的结构蛋白和酶构成。次生壁的积累由次生壁组分合成基因和转录因子共同调控(Taylor-Teeplesetal., 2015)。因此,解析次生壁物质形成中的关键调控因子及其作用机制,可为利用分子生物学手段提高木材的生长速率和产量,改良木材品质提供理论基础。
转录因子是一类重要的调控因子,一般通过结合特异的顺式作用元件从而激活或抑制下游基因的转录,从而参与植物的生长发育和抗性响应等生物学过程。NAC (NAM, ATAF1/2 和CUC2)是植物特有的且最大的转录因子家族之一。随着高通量测序技术的发展,越来越多的植物NAC基因被发掘和鉴定,在拟南芥(Arabidopsisthaliana)、水稻(Oryzasativa)、大豆(Glycinemax)、毛果杨(Populustrichocarpa)和毛竹(Phyllostachysedulis)中分别鉴定出117、151、152、163、93个NAC家族成员(Nuruzzamanetal., 2010; Huetal., 2010; Sunetal., 2018; Shanetal., 2019)。NAC 转录因子在 N 端含有1个约160个氨基酸残基大小的保守区域,该保守区域被进一步细分为 A、B、C、D、E 5个亚结构域,亚结构域C、D序列中含有核定位信号, 可能与转录因子核定位及启动子上特定顺式元件的识别有关(Aidaetal.,1997; Ookaetal., 2003); 高度变异的C端序列存在转录调控域,激活或抑制靶基因的转录,C端序列的多变与NAC蛋白功能的多样化密切相关(Duvaletal., 2002; Hegedusetal., 2003; Jensenetal., 2010)。
在植物中,NAC转录因子参与调控植物的生长发育和激素信号转导(Parketal., 2011; Wangetal., 2015; Kimetal., 2016),同时也参与植物各类生物和非生物胁迫应答过程(孙利军等, 2012)。在水稻中,过表达OsNAC5基因显著增强了抗旱性(Jeongetal., 2013)。在拟南芥中,NAC1能够介导生长素信号,促进侧根发育(Guoetal., 2005);CUC1和CUC2参与器官边界建成和分生组织的形成(Aidaetal.,1997)。Tran等(2004)从拟南芥中分离的3个NAC基因 (ANAC019、ANAC055和ANAC072)均受干旱胁迫诱导表达, 过表达这些NAC基因能显著提高植株的耐旱能力。NAC基因家族在次生壁形成中也发挥了关键调控作用。近几十年来研究表明,NAC转录因子作为植物细胞次生壁合成的第1级主开关, 能够激活一系列下游转录因子和次生壁组分合成基因的表达(李慧等, 2020)。拟南芥SND1不仅可以直接诱导木质素合成基因PAL1、CCoAOMT和4CL3的表达, 以及半纤维素合成基因IRX9、纤维素合酶类基因CSLB02、阿拉伯半乳糖蛋白基因FLA12的表达,而且能够激活MYB46基因的表达, 诱发次生壁相关基因的高度上调表达, 促进纤维素、木聚糖、木质素在细胞次生壁的沉积(Zhongetal., 2007; 2011a; Ohashi-Itoetal., 2010)。拟南芥NST1和NST2调控花药开裂所必需的花药内皮层细胞的次生壁增厚(Mitsudaetal., 2007); 同时,NST2也参与茎秆纤维细胞次生壁合成的调控,nst1nst2nst3/snd1三突变体植株纤维细胞次生壁完全缺失, 表明NST2、NST1以及NST3/SND1协同调控纤维次生壁的合成(Zhongetal., 2015)。杨树基因PtrWNDs在拟南芥中的异源表达可以恢复snd1nst1双突变体的表型,PtrWNDs的过表达引起次生壁合成基因的表达上调(Zhongetal., 2010; 2011b; Ohtanietal., 2011), 在PtrWNDs表达量下降的转基因杨树中, 木质部导管和纤维细胞的次生壁加厚受到抑制(Zhongetal., 2011b)。上述研究表明,NAC转录因子在调控植物次生壁形成过程中发挥重要作用,因而对NAC转录因子的分离和鉴定将有助于解析植物细胞次生壁形成机制。
2006年完成了毛果杨全基因测序(Tuskanetal., 2006),并建立了稳定的遗传转化体系,因此,以杨树为模式树种,解析次生壁形成的调控网络将为林木定向育种奠定重要理论基础。目前,次生壁合成的关键酶基因已经基本克隆出来并进行了功能分析,但其转录层面的研究仍有待完善。Hu等(2010)研究表明,毛果杨NAC基因家族包含163个成员,其中14个PtrNACs基因特异地在发育中的木质部高表达。本研究通过转录组分析,筛选到1个在毛果杨木质部高表达的基因PtrNAC128并分离出基因全长序列,通过生物信息学软件分析该基因的结构及进化,利用qRT-PCR分析PtrNAC128在不同组织中的表达差异; 利用农杆菌介导法将PtrNAC128导入毛白杨(Populustomentosa)中进行功能分析。本研究将有助于在转录调控层面揭示木质素合成调控机制。
1 材料与方法
1.1 试验材料及试剂
试验材料为毛果杨、毛白杨组培苗及温室培养苗、烟草 (Nicotianabenthamiana) 幼苗。AxyPrep PCR清洁试剂盒、AxyPrep质粒DNA小量试剂盒、AxyPrep胶回收试剂盒采购自AXYGEN公司。PCR高保真酶购自大连宝生物科技有限公司;XcmⅠ 限制性内切酶购自NEB公司; Peasy-T1、大肠杆菌(Escherichiacoli)感受态细胞、根癌农杆菌(Agrobacteriumtumefaciens)GV3101感受态细胞均购自全式金生物有限公司。DAPI、CM-Dil 染色剂购自上海翊圣生物科技有限公司。
1.2 毛果杨PtrNAC128 基因的克隆和序列分析
根据Hu等(2010)关于毛果杨NAC转录因子基因家族的报道,获得PtrNAC128基因ID (Potri.006G152700.1),并在Phytozome网站下载PtrNAC128基因序列。根据PtrNAC128基因序列,设计引物(表1),以毛果杨叶cDNA为模板,PCR扩增获得该基因,并连接到Peasy-T1载体,测序验证所克隆的PtrNAC128基因序列。分别使用在线软件Gene Structure Display Server 2.0 和MEME分析PtrNAC128基因结构和基序(Motif)。使用MEGA X对已知参与调控木质部生长发育的NAC结构域蛋白构建系统进化树。
1.3 PtrNAC128基因的qRT-PCR分析
毛果杨组培苗经炼苗后,移植于10 cm×10 cm×15 cm容器中,1个月后移植入大盆内,室外培养。生长6个月后,取其嫩叶(顶芽下第2片叶)、老叶(顶芽下第7片)、嫩茎(第2节间)、老茎(第6节间)和根,迅速清洗材料表面,用滤纸吸净表面水分后液氮冻存。提取总RNA、反转录获得cDNA模板。以Pto18S为内参基因,设计特异性引物(表1),以各组织cDNA为模板,进行qRT-PCR反应。qRT-PCR 反应条件为: 95 ℃预变性30 s; 95 ℃变性5 s, 60 ℃退火30 s, 72 ℃延伸45 s,40个循环。生物学重复3次,技术重复5次。基因表达量分析采用2-△△Ct法 (Livaketal., 2001)。利用SPPSS软件分析显著差异,用GraphPad Prism 5软件作图。
1.4 PtrNAC128基因植物过表达载体的构建及毛白杨遗传转化
利用在线软件DNAMAN分析PtrNAC128基因CDS区域的酶切位点,设计含BglⅡ、SpeⅠ的上下游引物(表1),构建35S∷PtrNAC128-GFP重组载体,经菌检、测序验证。转化至农杆菌GV3101,参照Li等(2018)方法进行毛白杨遗传转化。经诱导愈伤、分化生芽、生根形成完整转基因植株。炼苗后移至室外培养。提取转基因植株叶片总RNA,用潮霉素筛选标记特异性引物,进行阳性植株PCR鉴定。
1.5 亚细胞定位分析
将1.4中构建的35S∷PtrNAC128-GFP重组载体,以及携带35S∷GFP未重组载体为对照,参照宁波新芝公司高压气体基因枪GJ-1000的操作手册,在烟草叶片中进行瞬时表达,再在荧光显微镜下观察,同时用核染料DAPI染细胞核,利用激光共聚焦荧光显微镜观察荧光信号,明确PtrNAC128在细胞中的位置。
1.6 毛白杨茎横切面解剖观察
取毛白杨野生型及转基因植株茎的第6节间,制作石蜡切片,滴加甲苯胺蓝染色,之后在解剖镜下观察,蓝色部分即为木质素沉积的部分。
1.7 次生壁组分含量测定
1.7.1 木质素含量测定 参照 Jung 等(1999)和Dence(1992)分别测定Klason 木质素和酸溶木质素含量。取生长6个月的野生型和PtrNAC128过表达的毛白杨茎部作为材料,烘干后研磨成粉,过40目筛,称取材料0.2 g,随后用苯∶乙醇(体积比2∶1)抽提8 h,将风干的材料转移至质量分数72%的浓硫酸(3 mL)中, 20 ℃ 2 h,用蒸馏水定容至100 mL,121 ℃ 1 h,最后,105 ℃干燥12 h。采用重力法测定酸不溶木质素含量,滤液中酸溶木质素在205 nm波长下检测。参照Liyama 等(1988),采用乙酰溴法测定总木质素。
1.7.2 纤维素及半纤维素含量测定 纤维素及半纤维素的含量参考Van Soest等(1967)方法测定。
1.8 次生壁组分合成关键酶基因及转录因子的表达分析
取野生型和PtrNAC128过表达(PtrNAC128-OE)毛白杨组培苗嫩茎,提取总RNA、反转录获得cDNA模板。利用qRT-PCR 分析木质素合成途径关键酶基因(CAD1、C3H3、COMT2、C4H2、CCoAOMT1、CSE1、HCT1、F5H2、CCR2、PAL1和4CL5)、纤维素合成酶基因(CesA7-A和CesA4)和半纤维素合成酶基因(GT8D、GT43B和GT43D)的表达差异(Shietal., 2010; Vanholmeetal., 2013; Songetal., 2010; Leeetal., 2011)。另外,对参与调控次生壁组分合成的已知NAC、MYB 转录因子(MYB028、MYB090、MYB152、MYB161、MYB168、MYB175、MYB192、NAC105、NAC154和NAC156) 在不同株系中的表达情况进行分析(Lietal., 2018)。qRT-PCR同1.3,引物见表1。
2 结果与分析
2.1 毛果杨PtrNAC128基因克隆及结构分析
毛果杨PtrNAC128基因,转录本长度2 379 bp,ORF长度1 374 bp,编码蛋白457个氨基酸(图1A),包含6个外显子(图1B),分子量51.47 kDa,A. PtrNAC128与拟南芥同源基因的氨基酸序列比对(深蓝色代表完全一致氨基酸序列,上划线代表NAC 保守结构域); B.PtrNAC128基因结构分析; C. PtrNAC128氨基酸序列保守模块预测; D. PtrNAC128与其他参与调控次生壁发育的NAC蛋白系统进化树分析。Ptr: 毛果杨; Os: 水稻; Zm: 玉米; Eg: 巨桉; 其余为拟南芥。A. Multiple sequence alignment between PtrNAC128 and the 3 homologes ofArabidopsis(Identical amino acids are shaded in dark blue, the conserved NAC domain are overlined); B. Gene structure ofPtrNAC128; C. Structure of PtrNAC128 protein potential motifs; D. Phylogenetic analysis of PtrNAC128 and other NAC proteins by the neighbor-joining method using MEGA version X. Ptr:Populustrichocarpa; Os:Oryzasativa; Zm:Zeamays; Eg:Eucalyptusgrandis; Others:Arabidopsisthaliana.
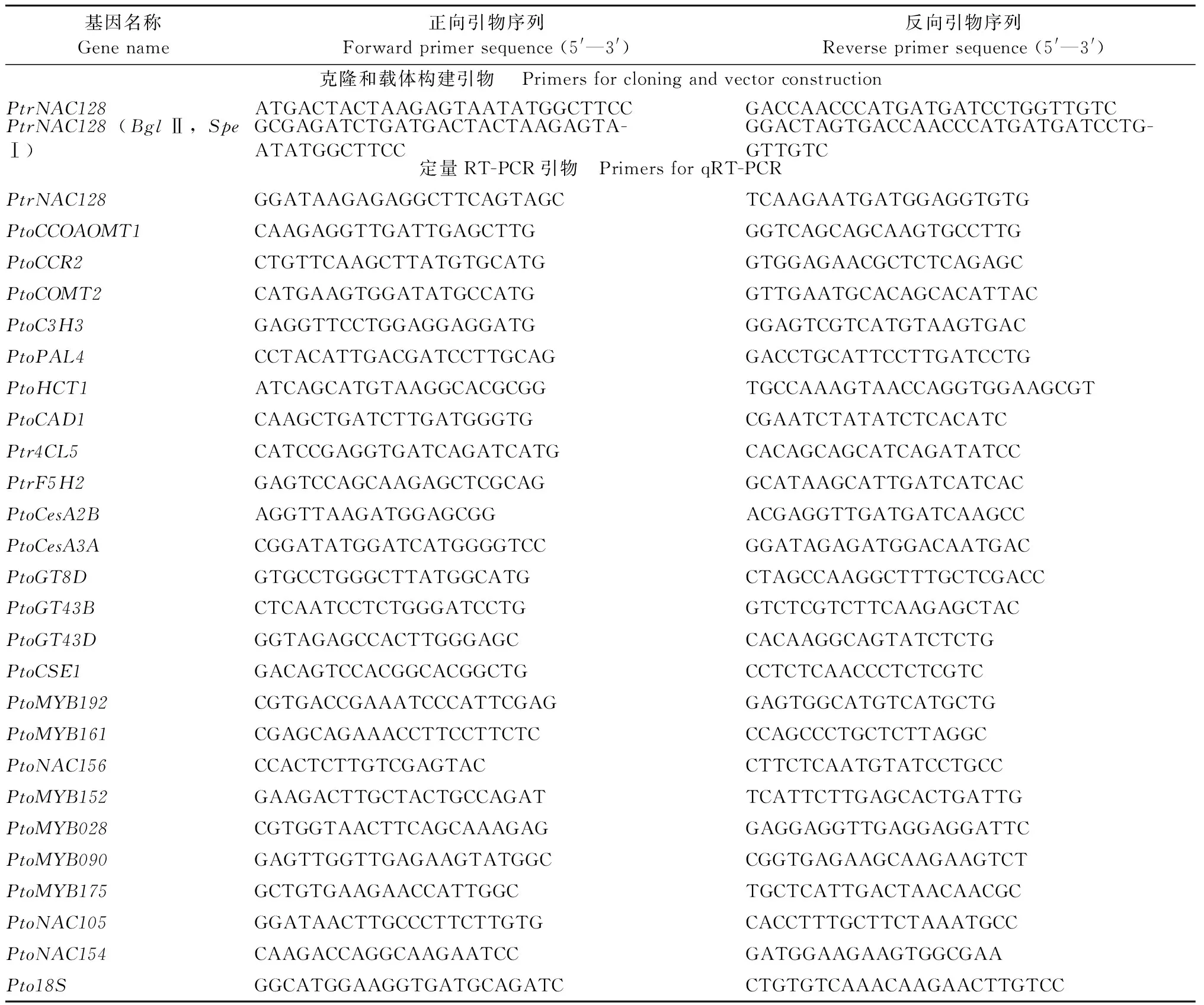
表1 引物序列Tab.1 List of primers
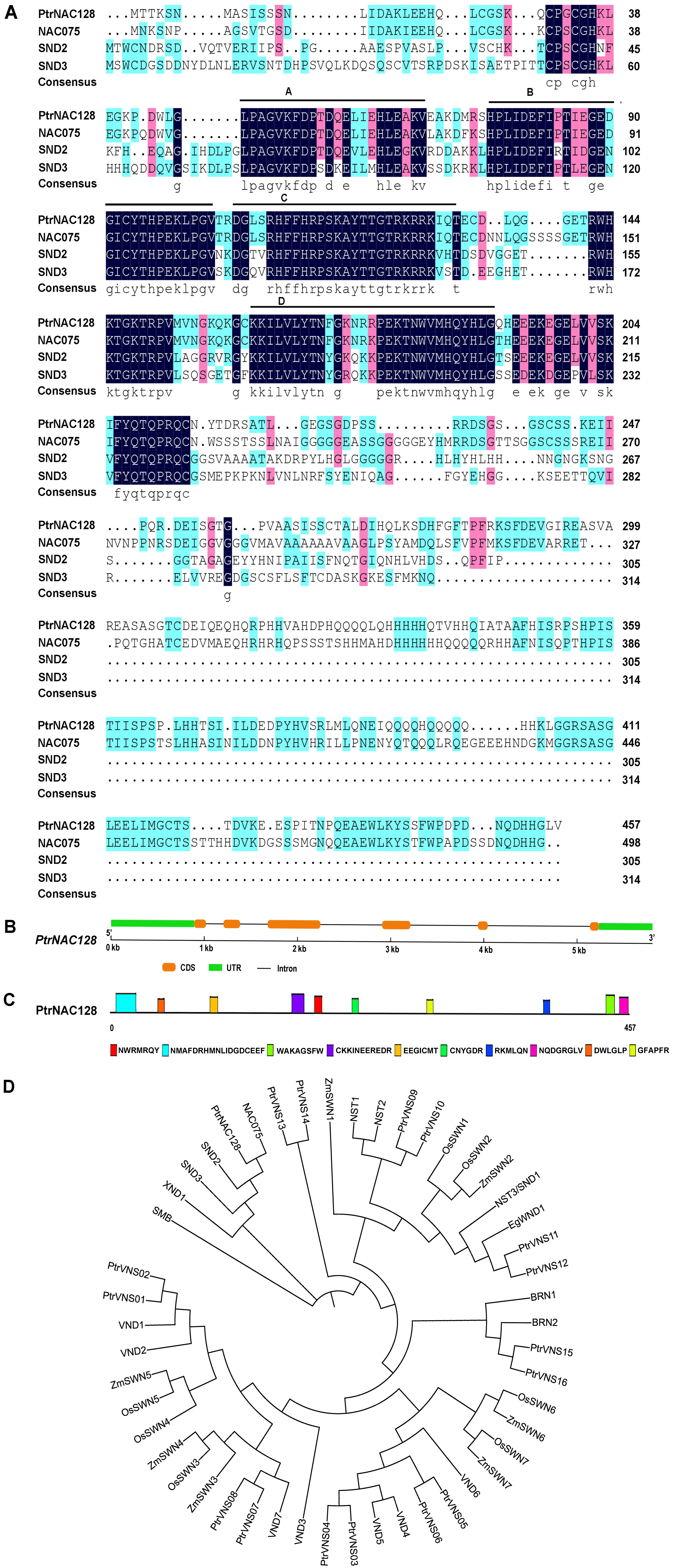
图1 PtrNAC128与其他物种NAC蛋白序列的比较Fig.1 Comparison of PtrNAC128 with other NAC amino acid sequences
等电点(pI)6.51。在线软件Pfam scan分析PtrNAC128蛋白结构域的结果表明,PtrNAC128蛋白N端(48—189 aa) NAC保守结构域包含A、B、C、D 4个亚结构域(图1A)。MEME 的分析表明PtrNAC128蛋白含有10个较为保守的Motif,均匀分布在蛋白序列间,没有聚集分布特征(图1C)。搜集已知物种中参与调控木质部发育的NAC 家族氨基酸序列构建系统发育进化树(图1D),结果显示,PtrNAC128与拟南芥NAC075、SND2、SND3在同一支。PtrNAC128与拟南芥NAC075氨基酸序列相似性是63.69%,且主要集中在N端,C端差异明显。这些结果表明,PtrNAC128在DNA结合区具有较强的保守性,但其激活区在进化上具有较大的差异。
2.2 PtrNAC128基因的组织表达分析
取室外培养6个月的毛果杨扦插苗的根、嫩茎、老茎、嫩叶、老叶样品,提取RNA,进行PtrNAC128基因的qRT-PCR分析(图2)。PtrNAC128基因在根、茎、叶中均有表达。在嫩叶中表达量最低; 老茎中表达量最高,老茎和嫩茎中的基因表达量分别约为嫩叶中的23.49倍和11.44倍。
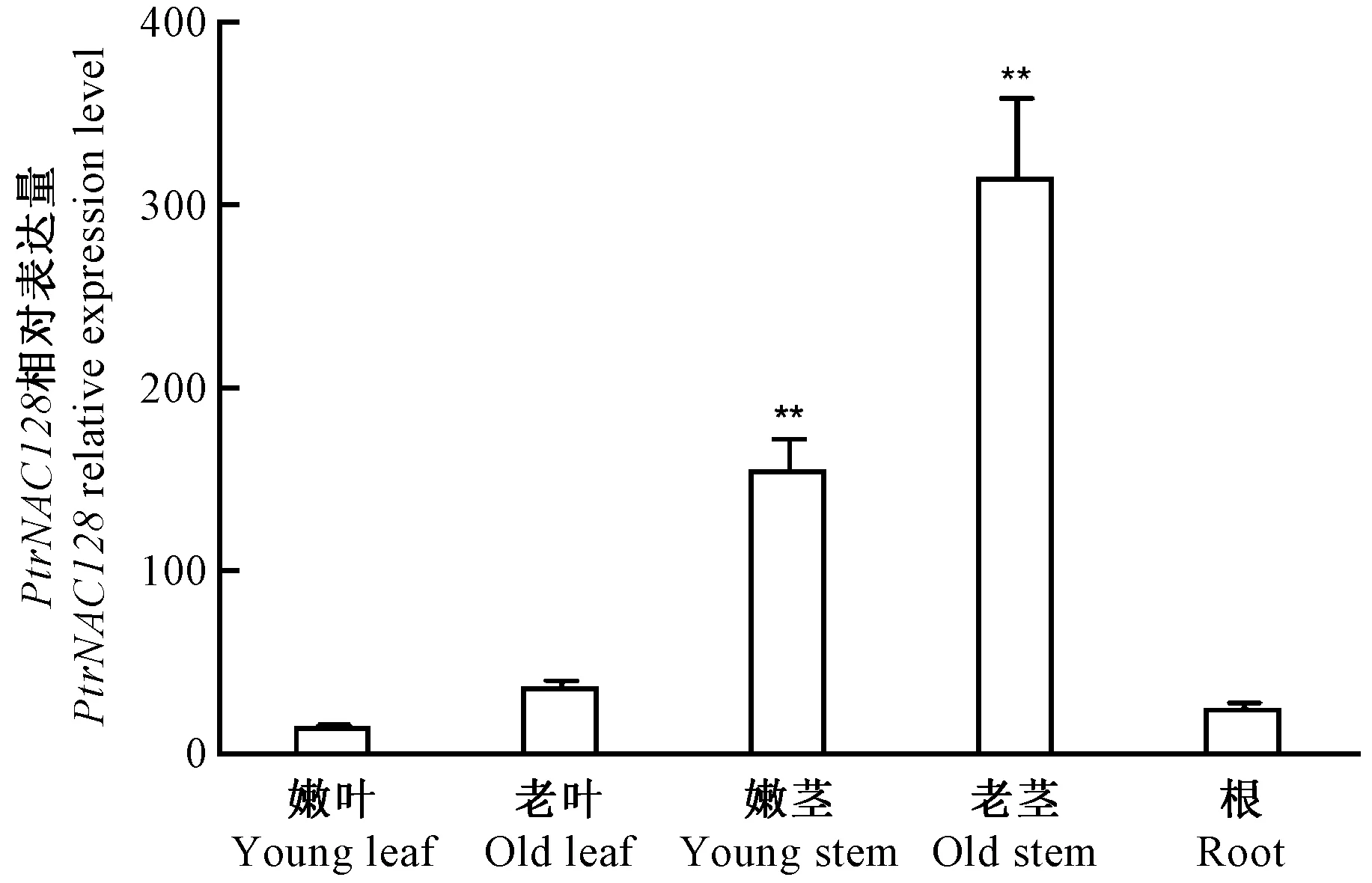
图2 PtrNAC128 组织特异性表达模式分析Fig.2 Expression patterns of PtrNAC128 in different tissues of poplar采用t检验,*表示差异显著(P < 0.05),**表示差异极显著(P < 0.01)。The single and double stars indicate significant difference at 0.05 and 0.01 levels of the gene expression in different tissues according to Student’s t-test.
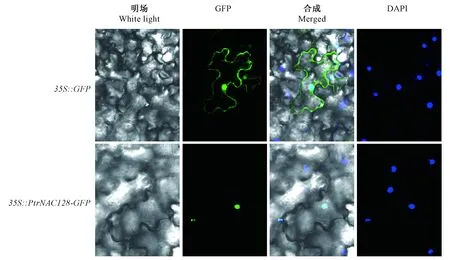
图3 PtrNAC128亚细胞定位分析Fig.3 Subcellular localization analysis of PtrNAC128荧光共聚焦显微镜追踪PtrNAC128-GFP定位在细胞核内,对照组显示自由GFP均匀分布在细胞核和细胞膜上。DAPI为细胞核染料。Confocal images of localization of PtrNAC128-GFP in tobacco(Nicotiana benthamiana) leaf epidermal cells. Bright field and fluorescent micrographs show the nuclear localization of PtrNAC128-GFP and free GFP expressed both in nuclear and cytomembrane localization in tobacco leaf epidermal cells. DAPI (40, 6-diamidino-2-phenylindole dihydrochloride), a nuclear staining dye.
2.3 亚细胞定位分析
利用基因枪法将35S∷PtrNAC128-GFP重组载体在烟草表皮细胞瞬时表达,进行亚细胞定位(图3)。结果表明,与对照相比,PtrNAC128蛋白集中分布在细胞核内,表明其编码核定位蛋白。
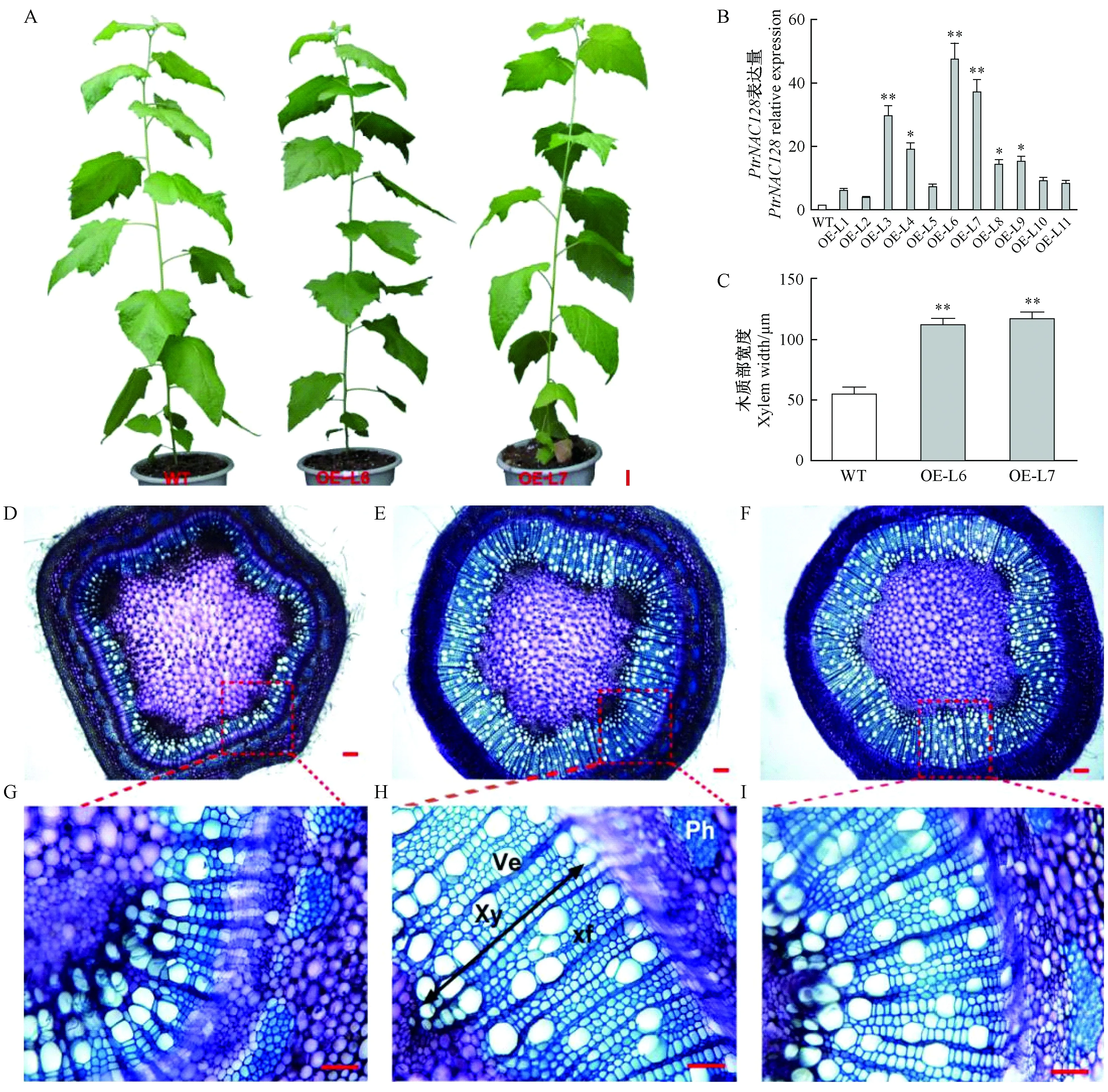
图4 过表达PtrNAC128对毛白杨次生木质部的影响Fig.4 Effects of PtrNAC128 overexpression on secondary xylem of Populus tomentosa stems标尺 Scale bars A: 5 cm; D, E, F: 50 μm; G, H, I: 20 μm. A. 温室培养6个月,野生型(WT)和过表达PtrNAC128代表性株系L6、L7(OE-L6、OE-L7)的表型; B.野生型和各转基因材料(OE-L1-11)中PtrNAC128的相对表达量; C. 第6节间木质部宽度统计; D.野生型(WT)毛白杨第6节间茎横切面; E、F分别为过表达PtrNAC128的OE-L6和OE-L7第6节间茎切片材料; G、 H、 I分别为D、E、F的局部放大图。Ph: 韧皮部; Xy: 木质部; Ve: 导管; Xf: 木纤维。t 检验结果: *表示差异显著(P < 0.05); **表示差异极显著(P < 0.01); 下同。A. Phenotypes of representative 6-month-old wild-type(WT) and transgenic lines(OE-L6 and OE-L7); B. The relative expression levels of PtrNAC128 in transgenic(OE-L1-11) and wild-type poplar; C. Xylem width of wild-type and PtrNAC128 overexpression lines (OE-L6 and OE-L7). D,E,F are stem sections from the 6th internode of wild-type(D) and transgenic plants OE-L6(E)and OE-L7(F); G, H, I are the enlarged view of red rectangular in D, E, F, respectively. Ph: Phloem; Xy: Xylem; Ve: Vessel; Xf: Xylary fiber. The single and double stars indicate significant difference at 0.05 and 0.01 levels according to Student’s t-test, the same below.
2.4 PtrNAC128 过表达载体的构建与遗传转化
构建35S∷PtrNAC128-GFP植物表达载体,通过叶盘法进行遗传转化,使PtrNAC128在毛白杨中过量表达。利用9 mg·L-1的潮霉素选择压力进行筛选,筛选出阳性植株。另外,通过qRT-PCR分析PtrNAC128表达情况,获得PtrNAC128过量表达的阳性转基因苗(图4A、B)。
2.5 转基因毛白杨植株表型分析
从营养生长发育过程看,过表达PtrNAC128毛白杨各株系与野生型相比没有明显差异(图4A)。选取过表达株系L6和L7,进一步通过解剖对茎横切面进行观察。结果表明,过表达PtrNAC128较野生型的次生木质部显著增厚,为野生型的1.42~1.51倍(图4C-F); 木质部细胞层数增加,约为野生型的1.22~1.31倍(图4G-I)。
2.6 木质部细胞次生壁中木质素、纤维素、半纤维素含量测定
毛白杨野生型植株木质素含量一般为189.7 mg·g-1, 过表达PtrNAC128各转基因株系中Klason木质素含量为212.7~231.9 mg·g-1,较野生型增加12%~22%; 利用乙酰溴法也发现同样的趋势(表2)。在过表达PtrNAC128各转基因株系中,半纤维素的含量未发现显著差异。过表达PtrNAC128各株系纤维素的含量为476.4~511.5 mg·g-1,较野生型(443.6 mg·g-1)增加7.4%~13.1%(表2)。
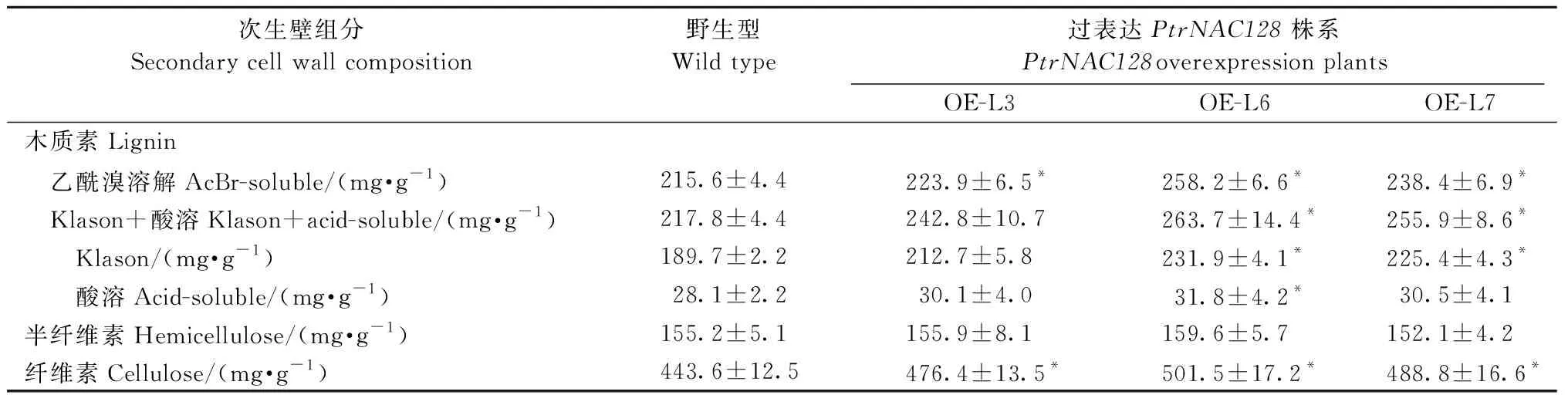
表2 过表达PtrNAC128和野生型毛白杨次生壁组分含量分析①Tab.2 Secondary cell wall composition analysis of the stems in PtrNAC128 overexpression and wild-type P. tomentosa
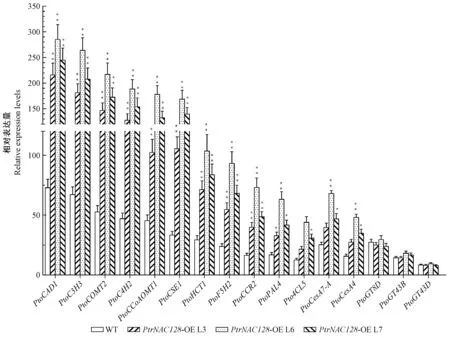
图5 次生壁组分合成关键酶基因的表达Fig.5 Gene expression analysis of secondary wall biosynthetic genes
2.7 木质部细胞次生壁组分关键合成酶基因及转录因子的表达检测
为了探究PtrNAC128调控次生壁各组分合成的分子机制,利用qRT-PCR,对木质素、纤维素和半纤维素合成途径的关键酶基因的表达差异进行分析。结果表明,木质素合成途径酶基因(PtoCAD1,PtoC3H3,PtoCOMT2,PtoC4H2,PtoCCoAOMT1,PtoCSE1,PtoHCT1,PtoF5H,PtoCCR2,PtoPAL1,Pto4CL5)表达水平均有显著提高; 纤维素合成酶基因(PtoCesA7-A和PtoCesA4)表达量提高1.57~2.7倍; 而半纤维素合成酶基因(PtoGT8D,PtoGT43B和PtoGT43D)没有明显的变化(图5)。
MYB、NAC转录因子在调控木质素和纤维素的生物合成过程中发挥重要作用。用qRT-PCR检测毛白杨植株中可能参与调控木质素、纤维素合成的转录因子(PtoMYB028、PtoMYB090、PtoMYB152、PtoMYB161、PtoMYB168、PtoMYB175、PtoMYB192、PtoNAC105、PtoNAC154、PtoNAC156)表达情况。结果表明,PtoMYB028、PtoMYB152、PtoMYB161、PtoMYB192、PtoNAC105、PtoNAC156在过表达PtrNAC128各株系中均显著上调(图6)。这表明,PtrNAC128通过激活木质素和纤维素相关调控因子的表达,影响木质部次生壁各组分的合成。
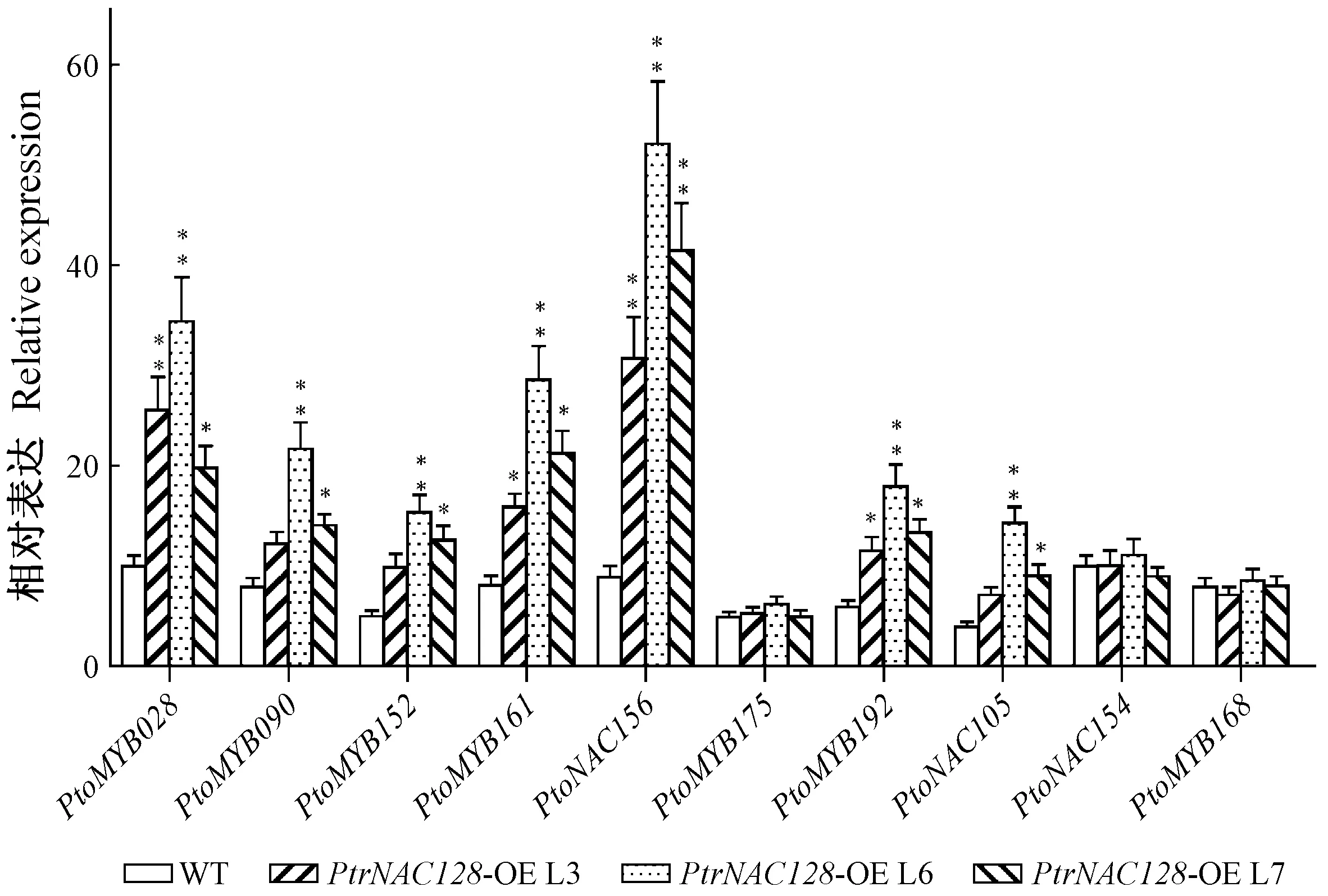
图6 次生壁组分合成相关转录因子的表达Fig.6 Gene expression analysis of secondary wall-associated transcription factors
3 讨论
木材形成是一个极其复杂的过程。高等植物在长期适应陆地生境中,进化出一套精细调控细胞次生壁组分的生物合成途径。次生壁各组分的生物合成关键酶基因已经分离并进行了功能鉴定,在转录调控层面也取得了一定进展。研究表明,在拟南芥中,NAC和MYB转录因子分别作为第1级和第2级主开关, 共同激活下游转录因子和次生壁物质合成基因的表达(Zhongetal., 2014; Nakanoetal., 2015)。SND1是激活次生壁物质合成途径的主要转录开关。SND1不仅直接激活MYB46,MYB83,MYB103,SND3和KNAT7, 而且还调控SND2,MYB85,MYB52,MYB54,MYB69,MYB42,MYB43和MYB20等转录因子的表达 (Zhongetal., 2009)。NST1和NST3也是调节次生壁加厚的重要转录因子。nst1和nst3双突变体植株中次生壁增厚和纤维细胞中木质素的沉积受到抑制, 植株呈现倒伏的表型(Mitsudaetal., 2007)。在木本植物中,也存在类似的NAC-MYB转录调控网络。毛果杨PtrVNS1-16均包含NAC保守结构域,其中PtrVNS1-12在木质部中表达,这些基因不仅在序列上与拟南芥SND1存在相似性,而且在功能上也高度同源。过量表达这些基因均能够导致次生壁增厚(Ohtanietal., 2011)。尽管在模式植物中,对于次生壁各组分的生物合成已经进行较为深入的研究,但其木质素和纤维素合成的精细调控框架中仍存在许多未知途径有待完善。Hu等(2010)通过对毛果杨不同组织的表达谱进行分析,发现PNAC085、PNAC128等13个NAC基因特异地在发育中的木质部中高表达。本研究发现,PtrNAC128在木质部发育较为活跃的茎中表达量较高,尤其是老茎中表达量最高,与Hu等(2010)的结果一致,暗示PtrNAC128可能在木质部发育过程中发挥重要作用。系统进化分析发现,PtrNAC128与拟南芥ANAC075、SND2聚在一支,含有典型的NAC结构域。在拟南芥中,Sakamoto等(2015)研究表明,ANAC075可回复nst1-1nst1-3双突变体的木质部发育缺陷。另外,Fujiwara等(2016)研究发现,ANAC075主要在韧皮部中表达,anac075突变体表现为早花表型。本研究发现,毛果杨PtrNAC128在根、茎、叶中均有表达,其中在老茎中表达丰度最高(图2), 揭示PtrNAC128可能参与木质部的次生发育。亚细胞定位结果显示,PtrNAC128定位在细胞核内(图3)。在杨树中,NST/SND同源基因均属于NAC 结构域蛋白,在调控木质纤维、韧皮纤维和木射线细胞的发育过程中发挥重要作用。Zhong等(2015)研究表明,nst1nst3双突变体不能形成完整的束间纤维,nst1nst2nst3/snd1三突变体完全丧失了形成次生壁的能力。Takata 等(2019)研究表明,vns09vns10vns11vns12四突变体细胞壁组分积累受到抑制导致植株茎不能自然直立,株高较野生型减小。本研究发现,过表达PtrNAC128株高没有明显差异。茎段横切面染色观察发现过量表达PtrNAC128较野生型植株的木质部细胞层数明显增加,次生木质部厚度显著增大(图4); 木质素、纤维素含量增加但半纤维素含量没有明显变化(表2),说明过表达PtrNAC128通过影响木质素和纤维素的含量,增加木材的含量。为了进一步分析木质部各组分(木质素、纤维素)含量增加的原因,利用qRT-PCR的方法,检测了木质素生物合成中11个关键酶基因的变化情况。结果表明,转基因植株中所有木质素合成关键酶基因的表达水平显著增加,其中CAD1、C3H3、C4H2、CCoAOMT1、COMT2、CSE1、HCT1和F5H2变化尤为明显(图5)。这些结果表明,木质素含量的增加可能通过调控木质素合成关键酶基因的表达水平从而调控木质素的合成来实现的。纤维素也是次生壁重要组分之一。前人的研究表明,杨树CesA4、CesA7-A、CesA7-B、CesA8-A和CesA8-B是次生壁中纤维素合成的关键酶基因(Songetal., 2010; Xietal., 2016)。本研究结果显示,过量表达PtrNAC128各株系中纤维素合成酶基因PtoCesA7-A、PtoCesA4显著上调,纤维素含量增加,半纤维素合成酶基因PtoGT8D、PtoGT43B和PtoGT43D没有明显变化,说明PtrNAC128对于木质素和纤维素关键合成酶基因具有调控作用,但对半纤维素的生物合成没有影响。
Zhong等(2011b)研究报道,毛果杨PtrMYB028、PtrMYB090、PtrMYB152、PtrMYB161、PtrMYB168、PtrMYB175、PtrMYB192、PtrNAC105和PtrNAC154/156等基因可被PtrWND2B/6B诱导表达,调控次生壁中木质素、纤维素的累积。本研究结果表明,PtrNAC128可显著诱导PtoMYB028、PtoMYB152、PtoMYB161、PtoMYB192、PtoNAC105、PtoNAC156的表达(图6),暗示PtrNAC128可通过调节这些次生壁组分合成的转录因子,进而影响木质素和纤维素的合成。
4 结论
在毛果杨中克隆到一个新的NAC基因PtrNAC128, 该基因转录本长度为2 379 bp,ORF长度为1 374 bp,编码蛋白457个氨基酸,且在 N端具典型NAC结构域; 进化树构建分析显示 PtrNAC128与拟南芥NAC075、SND2、SND3聚为一支,组织表达分析显示在老茎中优势表达。对PtrNAC128基因的功能分析显示,毛果杨PtrNAC128通过激活木质素和纤维素生物合成的关键酶基因及转录因子调控次生壁各组分的生物合成。过表达PtrNAC128转基因株系的木质素、纤维素的含量均显著增加,可进一步增加木材的利用率。本研究通过对杨树PtrNAC128功能的解析,对木本植物定向育种和多功能利用提供了基因储备。

