单核细胞/高密度脂蛋白胆固醇比值与2型糖尿病肾脏疾病的相关性分析
王永超,刘新宇
(1.锦州医科大学 研究生学院,辽宁 锦州 121001;2.锦州医科大学附属第一医院内分泌科,辽宁 锦州 121001)
糖尿病肾脏疾病(diabetic kidney disease, DKD)是糖尿病最常见的微血管并发症之一[1],同时也是最难治疗的并发症之一,目前的治疗可以延缓DKD 的进展,但不能阻止其进展到终末期肾病[2-3]。研究发现日本约11.8 万例患者因DKD 进行肾脏替代治疗,每年约新增1.5 万例患者因DKD 开始肾脏透析治疗[4]。DKD 已经成为发生终末期肾病的主要原因[5]。该病起病隐匿,尿微量白蛋白被公认是其早期标志物,但有相当多的患者发生肾脏损害时其尿蛋白为阴性[6]。许多因素涉及到DKD 的发生机制,包括血流动力学的改变、氧化应激、纤维化发生、肾素血管紧张素激活及炎症反应[7]。其中炎症反应及细胞因子介导的血管内皮损伤是DKD 发生、发展的一个关键途径[8]。单核细胞/高密度脂蛋白胆固醇(monocyte to highdensity lipoprotein cholesterol ratio, MHR)是一种新兴的炎症标志物[9],可作为诊断DKD 的生物标志物[10]。国内关于MHR 与DKD 关系研究较少,本研究拟对MHR 与DKD 的相关性进行探讨。
1 资料与方法
1.1 研究对象
选取2018年10月—2019年11月锦州医科大学附属第一医院确诊为2 型糖尿病患者216 例。纳入标准:2 型糖尿病诊断符合WHO 诊断标准,根据尿白蛋白/尿肌酐比值(uACR)对DKD 进行分期[1,10],uACR 30 ~300 mg/g 为微量白蛋白尿期,uACR>300 mg/g 为大量白蛋白尿期。排除标准:年龄>80 岁;1 型糖尿病或其他特殊类型糖尿病;心血管疾病;血液系统疾病(包括贫血);其他原因导致的肾脏疾病;炎症性疾病;恶性肿瘤;近3 个月内感染;有输血史;血压不稳定患者;孕期或哺乳期患者。
216 例患者分为单纯糖尿病组(SDM 组)70 例,DKD 组146 例。DKD 组按国际公认的DKD 分期标准(Mogensen 分期)分为两组:微量白蛋白尿期为早期糖尿病肾脏疾病组(EDKD 组)71 例,大量白蛋白尿期为临床糖尿病肾脏疾病组(CDKD 组)75 例。
1.2 研究方法
记录所有患者性别构成比、年龄、收缩压、舒张压、体重指数。均空腹采集静脉血,进行血脂、尿酸、血肌酐、全血细胞计数等检测。全自动血细胞分析仪购自美国贝克曼库尔特公司,全自动生化分析仪购自日本日立公司。患者入院后留取次日晨尿的清洁中段尿检测uACR,采用免疫比浊法和贝-本二式实验法,试剂盒购自上海西门子诊断产品有限公司,检测设备购自上海西门子DCA Vantage 公司。
1.3 统计学方法
数据分析采用SPSS 25.0 统计软件。计量资料以均数±标准差(x±s)或中位数和四分位数[M(P25,P75)]表示,比较用方差分析或H检验,进一步两两比较用LSD-t检验;计数资料以例(%)表示,比较用χ2检验;相关性分析用Pearson 法;绘制ROC 曲线;影响因素的分析采用Logistic 回归模型。P<0.05 为差异有统计学意义。
2 结果
2.1 3 组患者临床资料比较
3 组患者性别构成比、年龄、收缩压、舒张压、体重指数比较,差异无统计学意义(P>0.05)。见表1。
2.2 3 组患者实验室检查结果
3 组患者总胆固醇、低密度脂蛋白胆固醇、空腹血糖、糖化血红蛋白比较,差异无统计学意义(P>0.05)。3 组患者其余指标比较,差异有统计学意义(P<0.05),EDKD 组和CDKD 组患者的白细胞、单核细胞、甘油三酯、血尿酸、血肌酐、MHR、CRP 较SDM 组高;CDKD 组和EDKD 组患者高密度脂蛋白胆固醇水平较SDM 组低。见表2。
2.3 各指标与uACR 的相关性
uACR 与MHR、白细胞、单核细胞、血小板、甘油三酯、血肌酐、血尿酸、糖化血红蛋白、空腹血糖呈正相关(P<0.05);与高密度脂蛋白胆固醇及血红蛋白呈负相关(P<0.05)。见表3。
2.4 DKD 的影响因素
2.4.1 DKD 的单因素Logistic 回归分析为初步筛选DKD 的影响因素,以各指标为自变量,是否患有DKD为因变量(否=0,是=1),进行二元Logistic 回归模型分析。结果,体重指数[=1.192(95% CI:1.080,1.315),P=0.001]、收缩压[=1.083(95% CI:1.048,1.118),P=0.000]、空腹血糖[=1.092(95% CI:1.010,1.180),P=0.026]、糖化血红蛋白[=1.489(95% CI:1.237,1.793),P=0.000]、血尿酸[=1.005(95% CI:1.001,1.009),P=0.007]、血肌酐[=1.044(95% CI:1.021,1.067),P=0.000]、MHR[=1.679(95% CI:1.387,2.033),P=0.000]是DKD 的影响因素。见表4。

表1 3 组患者临床资料的比较

表2 3 组实验室检查结果比较
2.4.2 DKD 的多因素Logistic 回归分析为调整混杂因素的影响,将表4中差异有统计学意义的指标为自变量,是否患有DKD 为因变量(否=0,是=1),进行多因素Logistic 回归分析,结果显示体重指数[=1.160(95% CI:1.029,1.307),P=0.015]、收缩压[=1.068(95% CI:1.028,1.110),P=0.001]、血肌酐[=1.034(95% CI:1.007,1.061),P=0.012]、MHR[=1.545(95% CI:1.248,1.913),P=0.000]是DKD 的独立危险因素。见表5。

表3 各指标与UACR 的相关性

表4 DKD 的单因素logistic 回归分析参数
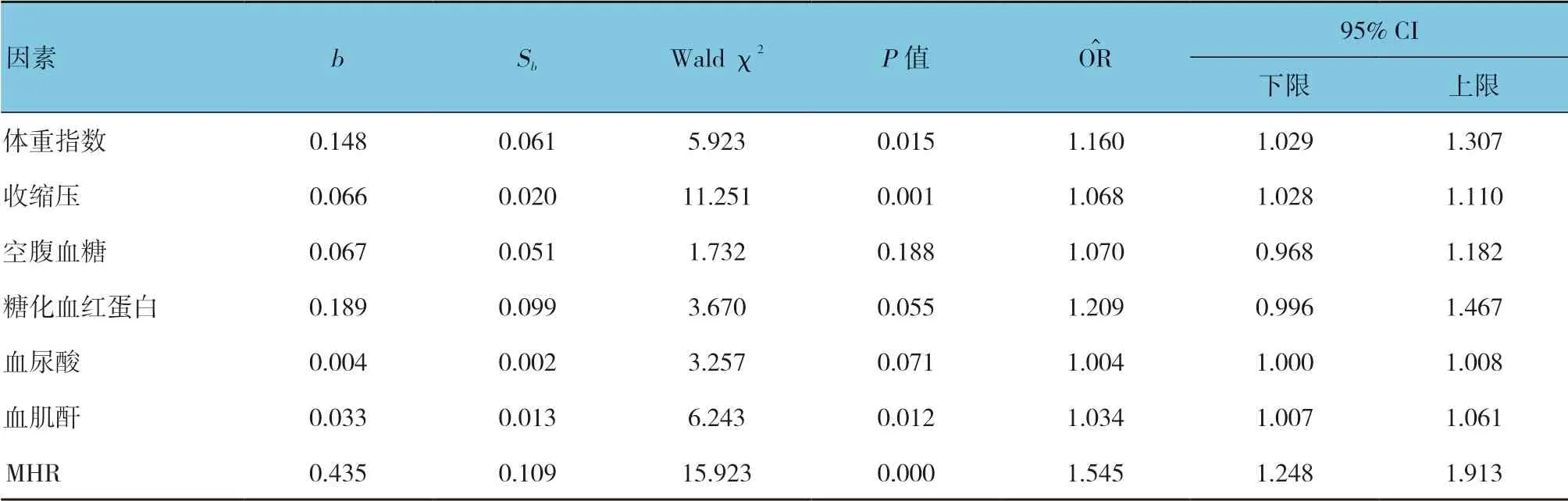
表5 DKD 的多因素Logistic 回归分析参数
2.5 MHR 对DKD 患者预测价值
绘制ROC 曲线分析MHR 对DKD 的预测价值,结果显示,对DKD 患者,MHR 最佳截断值为6.2,MHR 的曲线下面积为0.773(95% CI:0.711,0.834),预测的敏感性为71.9%(95% CI:0.646,0.791)、特异性为72.9%(95% CI:0.657,0.801)。见图1。

图1 MHR 预测DKD 的ROC 曲线
3 讨论
微量白蛋白尿期的肾脏病理改变多为可逆的,如能尽早发现并干预,可阻止其向不可逆的终末期肾脏病发展[11]。DKD 主要特点为白蛋白尿、肾小球滤过率下降和心血管疾病风险增多[12-13],但其机制不是十分清楚。
本研究结果显示,CDKD 组及EDKD 组单核细胞高于SDM 组,与GALKINA 等[14]研究一致。在DKD患者的肾组织中出现巨噬细胞的积聚[15],巨噬细胞和巨噬细胞衍生物在DKD 中共同发挥作用[16],进一步加重血管内皮功能损伤,内皮功能的损害进一步加速DKD 的进展。而巨噬细胞源自单核细胞,进一步说明单核细胞参与DKD 进展。
本研究结果显示,CDKD 组及EDKD 组的高密度脂蛋白胆固醇低于SDM 组,与MORTON[17]研究相一致。糖尿病患者体内高密度脂蛋白胆固醇水平较低时会出现新的微血管病变,并进一步加重已发生的微血管病变,是DKD 发展的危险因素[17]。高密度脂蛋白胆固醇通过阻止巨噬细胞的迁移及低密度脂蛋白的氧化起到抗炎和抗氧化作用[18],另外,高密度脂蛋白胆固醇也能抑制单核细胞的活化及单核细胞祖细胞增殖分化[19]。可直接保护内皮细胞,并有助于内皮细胞的修复[20]。
本研究发现CDKD 组及EDKD 组MHR 值均大于SDM组,且由SDM组到EDKD组和CDKD组逐渐升高。与ONALAN[10]研究发现MHR 可作为DKD 的生物标志物结果一致。单核细胞作为炎症因子参与DKD 的发病机制[14]。高密度脂蛋白胆固醇具有抗炎抗氧化作用[18],低水平高密度脂蛋白胆固醇是DKD 的危险因素[17],因此推测MHR 与DKD 的发展有一定关系。单核细胞来源于骨髓里的髓样组细胞,和分化的巨噬细胞共同参加细胞因子的释放及组织重构的过程,并参与血管炎症和DKD 的发病机制,引起肾上皮细胞损伤[21]。单核细胞作为炎症细胞,被吸引到肾小球中,在没有高密度脂蛋白胆固醇的抑制作用的情况下,单核细胞可通过摄入脂质进入巨噬细胞并转化为泡沫细胞[22],最后积累的泡沫细胞促进肾小球硬化和肾功能减退[23]。高密度脂蛋白胆固醇通过阻止巨噬细胞的迁移及低密度脂蛋白的氧化起到抗炎和抗氧化作用[24],被认为是一种有益蛋白。低水平的高密度脂蛋白胆固醇会导致胆固醇逆转运,从而导致在肾脏内聚集脂质[25],聚集的脂质经过过氧化反应形成氧化磷脂,然后水解转化为溶血磷脂酰胆碱[26]。溶血磷脂酰胆碱作用于肾小球内皮细胞和系膜细胞,促进黏附分子、炎症细胞因子和趋化因子的表达,共同参与DKD 的炎症反应,加重DKD 的进展[27]。uACR 作为DKD 病情分期指标,相关性分析显示MHR 与uACR 呈正相关。此外,多因素Logistic 回归分析,MHR 为DKD 的独立危险因素,且国外也有研究证明MHR 可作为DKD 病情进展判断的生物标志物[9]。ROC 曲线分析,对DKD的MHR 最佳截断值为6.2。MHR 可作为早期DKD 的预测因子。预测的敏感性和特异性分别为71.9%和72.9%,ROC 曲线下面积为0.773,对DKD 的预测具有一定的准确性。
目前国内MHR 与DKD 患者的相关性研究较少,本研究仍具有一些局限性:①本研究的MHR 比值为一次的测量值,不能排除糖尿病应激导致的一些异常值;②研究中并未对其他一些特异性更强的炎症因子如白细胞介素及肿瘤坏死因子等进行相关性分析;③不同的患者可能经过不同时期及药物治疗,这些因素对实验结果的影响并没有纳入考虑范围。
综上所述,MHR 是发生DKD 的独立危险因素,可作为DKD 的一个重要预测因子。糖尿病患者入院时应及时进行MHR 检测,有助于鉴别出糖尿病发生DKD 的高风险人群,并对其采取预防和治疗措施。

