长萼堇菜叶蛋白水解物的制备及其活性分析
习雪玲,杨茗婷,覃婷,廖斌,张军*
长萼堇菜叶蛋白水解物的制备及其活性分析
习雪玲1,2,杨茗婷1,2,覃婷1,2,廖斌3,张军1,2*
(1.广东药科大学生命科学与生物制药学院,广东 广州 510006;2.广东省生物技术候选药物重点实验室,广东 广州 510006;3.中山大学生命科学学院,广东 广州 510275)
以长萼堇菜(Blume)为材料,优选碱提酸沉法参数,提取其叶蛋白;采用酶法制备叶蛋白水解物;利用超滤法分离叶蛋白水解物组分,分析叶蛋白水解物的抗氧化活性,并对叶蛋白水解物组分进行固相萃取脱盐、HPLC分析及其对肿瘤细胞的抑制活性和对线虫寿命影响的测试。结果表明:采用料液比、碱提pH和酸沉pH分别为1∶9、10.0和4.5的参数组合可稳定提取长萼堇菜叶蛋白;优选的3种蛋白酶(木瓜蛋白酶、碱性蛋白酶和风味蛋白酶)均能有效将水解物主要酶解为相对分子质量小于3.3×103的组分,并通过超滤可有效分离出相对分子质量分别为<1×103(PH1)、1×103~<3×103(PH2)和≥3×103(PH3)的3个组分;长萼堇菜蛋白水解物中PH1组分的抗氧化活性和抑肿瘤细胞活性优于其他组分;PH1和PH2延长线虫寿命的效果相近,都优于PH3。可见,长萼堇菜叶蛋白水解物组分PH1更具应用开发价值。
长萼堇菜;叶蛋白;蛋白水解物;秀丽隐杆线虫;生物学活性
植物蛋白质及其水解物可应用于饲料、食品和健康产品等[1]。相较于蛋白质,蛋白水解物一般有更好的生物可吸收性[2]。已有玉米、绿豆、核桃等种子蛋白水解物的研究[2-4]和苜蓿、花椰菜、桑椹等叶蛋白水解物的研究[5-7]。相较于种子,植物叶的资源更丰富和更经济,但叶的蛋白含量明显低于种子的蛋白含量,且叶中含有较多的多糖、多酚和色素等成分,导致叶蛋白普遍较难提取[8]。碱提酸沉法可用于大量提取叶蛋白,但其最适的料液比和碱提、酸沉pH值等提取参数因植物不同而异,需进行有针对性的优化[9]。此外,在制备植物蛋白水解物的过程中,也需通过超滤等方法分离出水解物更具代表性的活性组分[10]。
植物源蛋白水解物有多种生物学活性,如从大豆、桑椹和当归中制备的蛋白水解肽分别具有典型的抗肿瘤、抗氧化和抗衰老的活性[7,11-12]。来源于不同植物(特别是远亲缘关系植物)中的蛋白水解物一般会呈现较大的序列差异性[13]。基于序列决定活性,为分离出活性更典型的蛋白水解物,有必要在更多科属来源的和更多地域特色的植物中开展蛋白水解物研究。
植物叶蛋白的提取方法主要有苯酚提取法、TCA/丙酮提取法、TCA/丙酮/苯酚提取法及碱提酸沉法[12,14]。前3种方法多用于蛋白质组等微量蛋白试验分析[12];碱提酸沉法适于规模化提取蛋白质及其后续的水解肽制备与活性评估。有研究[5,15-16]采用碱提酸沉法提取水稻胚乳蛋白、黑豆蛋白和苜蓿叶蛋白,经酶解制备水解肽后进一步分析其生物学活性。在制备蛋白质水解物过程中,常用的蛋白酶有胰酶、胃蛋白酶、碱性蛋白酶、风味蛋白酶、木瓜蛋白酶[4,9-10,17-18]。相对而言,后3种酶因易购、经济和产物多样性高等应用更普遍。
广东省现有堇菜属植物20余种。长萼堇菜(Blume)是其中资源最丰富的品种[19-20]。长萼堇菜的活性肽和代谢产物具有典型的抗炎、抗菌和抗氧化活性[19,21]。前期研究[19-20]解析了长萼堇菜的短序列cDNA谱和转录组,进而从该植物中鉴定了一系列活性肽。长萼堇菜转录组编码数以万计的蛋白序列,这些蛋白的人工酶解,有望释放出序列组成丰富多样的蛋白水解物。目前,关于堇菜科植物叶蛋白水解物的组分及活性鲜见报道。
本研究中,采用碱提酸沉法提取长萼堇菜叶蛋白,并优选最适料液比和碱提、酸沉pH值,采用木瓜蛋白酶、碱性蛋白酶和风味蛋白酶水解叶蛋白,采用超滤分离出不同分子量范围的组分,评估不同组分潜在的抗氧化活性、抑癌细胞活性与延长线虫寿命活性,旨在优化长萼堇菜叶蛋白水解物的制备方法,明确蛋白水解物的活性及其组分差异,以期促进长萼堇菜的人工栽培和开发利用。
1 材料与方法
1.1 材料
供试材料为广州大学城正常土壤生长的草本植物长萼堇菜。
1.2 方法
1.2.1长萼堇菜叶蛋白的提取和酶解
采用碱提酸沉法[5]提取长萼堇菜叶蛋白。利用Glycine-SDS-PAGE电泳检测分析不同料液比(1∶8、1∶9和1∶10)、碱提pH值(8.0、8.5、9.0、9.5、10.0和10.5)和酸沉pH值(4.5、5.0和5.5)对叶蛋白提取结果的影响。参照文献[22]的方法,用木瓜蛋白酶、风味蛋白酶和碱性蛋白酶(索莱宝)水解长萼堇菜叶蛋白;利用Tricine-SDS-PAGE电泳检测分析酶解效果。碱性蛋白酶、风味蛋白酶、木瓜蛋白酶水解的长萼堇菜叶蛋白水解物分别记为APHr、FPHr和PPHr。
1.2.2蛋白水解物的超滤分离与抗氧化分析
根据蛋白酶解结果,参照文献[23-24]的方法,采用膜超滤法分离APHr、FPHr和PPHr,其中相对分子质量小于1×103的分别记为APH1、FPH1和PPH1,相对分子质量为1×103~<3×103的分别记为APH2、FPH2和PPH2,相对分子质量大于等于3×103的分别记为APH3、FPH3、PPH3。将各组水解物冻干,备用。采用DPPH法[25-26]分析各组水解物的抗氧化活性,以还原性谷胱甘肽(GSH)为阳性对照。
1.2.3蛋白水解物的固相萃取与HPLC分析
基于增加水解物序列多样性的考虑,先将超滤分离的3种酶促水解物组分依据同一相对分子质量范围条件等比例预混成3个组分,相对分子质量由小到大,分别记为PH1、PH2、PH3,再用于固相萃取(SPE)脱盐、HPLC分析和活性分析。利用C18固相萃取柱脱盐纯化超滤分离组分,洗脱液用氮吹仪浓缩后冻干,备用。采用分析型HPLC(LC3000,创新通恒)色谱法[2]比较不同组分的水解物,评估超滤分离效果。HPLC条件:分析柱型号为依利特SinoChrom 300A(10 µm,4.6 mm×250 mm);流动相A相为5%乙腈/0.1% 三氟乙酸,B相为90%乙腈/0.1%三氟乙酸。
1.2.4细胞和线虫试验
采用CCK8法[27]分析不同终质量浓度(0.00、0.02、0.10 mg/mL)的PH1、PH2、PH3对肿瘤细胞(人骨肉瘤143B细胞)的抑制活性,其中,以顺铂(DDP)和5-氟尿嘧啶(5-Fu)为阳性对照。采用标准方法[28]培养野生型秀丽隐杆线虫()和同步化,选取L4期线虫分析蛋白水解物对线虫寿命的影响。
1.3 数据处理与统计分析
运用Microsoft Excel 2016、Graph Pad Prism 8和SPSS 19.0分析试验数据,采用单因素方差分析方法(ANOVA)进行组间差异分析。
2 结果与分析
2.1 料液比和碱提与酸沉pH值对长萼堇菜叶蛋白提取的影响
从图1的1~3泳道可以看出,3种料液比提取的叶蛋白浓度相近。考虑到蛋白提取的稳定性和经济性,在后续的比较试验中,料液比定为1∶9。从4~9泳道可以看出,碱提pH值为10.0时,叶蛋白浓度相对较高。从10~12泳道可以看出,酸沉pH值为4.5时,蛋白条带相对较清晰。从13~15泳道可以看出,以料液比1∶9、碱提pH值10.0和酸沉pH值4.5的参数组合,可稳定提取长萼堇菜叶蛋白。
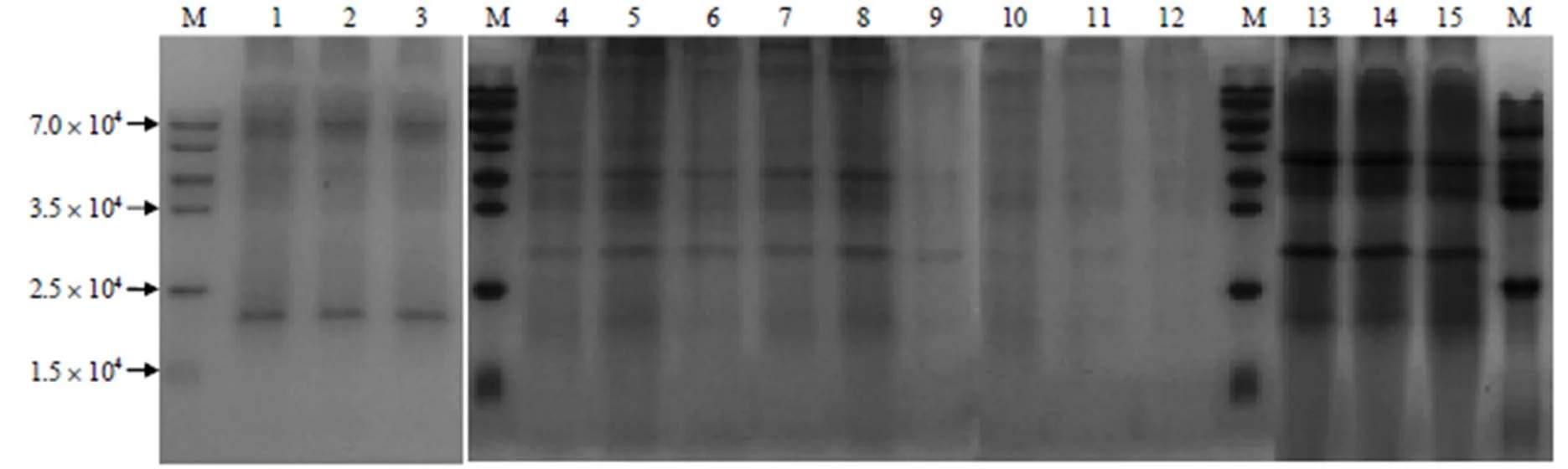
M 预染蛋白Marker;1~3 液料比分别为1∶8、1∶9、1∶10时提取的蛋白;4~9 碱提pH值分别为8.0、8.5、9.0、9.5、10.0、10.5时提取的蛋白;10~12 酸沉pH值分别为4.5、5.0、5.5时提取的蛋白;13~15 优选条件下提取的3组叶蛋白。
2.2 3种蛋白酶对长萼堇菜叶蛋白的水解效果
从图2可知,3种酶促水解产物均以相对分子质量小于3.3×103的含量较多。基于此,选择通过2种超滤膜进一步从原初水解物(APHr、FPHr、PPHr)中分离出不同相对分子质量范围的组分。
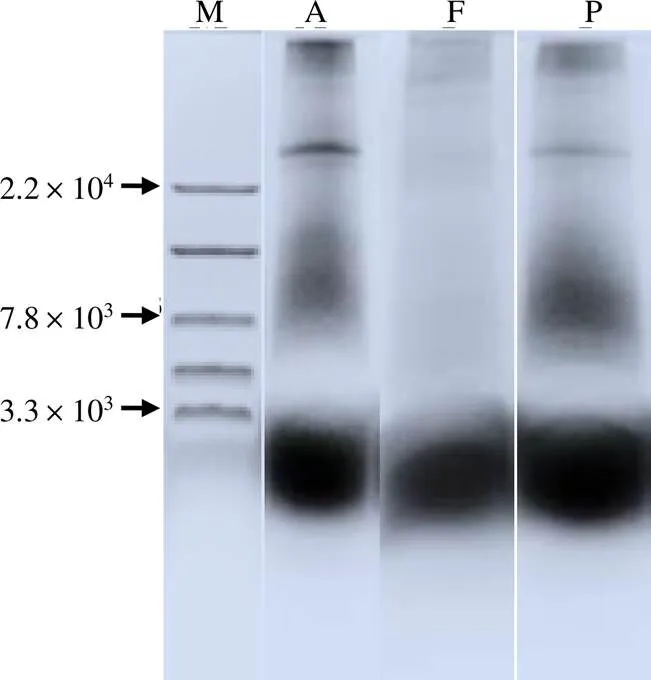
M 多肽Marker;A APHr;F FPHr;P PPHr。
2.3 长萼堇菜叶蛋白水解物的抗氧化活性
从图3可知,不同水解物组分的抗氧化活性与其使用剂量呈正相关,与其相对分子质量大小呈负相关。相对分子质量小于1×103的水解物组分的抗氧化活性最强;3种酶解产生的相对分子质量小于1×103的水解物组分的抗氧化活性间差异有统计学意义(<0.05)。使用剂量为0.04~0.16 mg/mL时,同等剂量的PPH1、APH1和FPH1对DPPH的清除率差异极显著(<0.01)。APH1对DPPH清除的IC50值(4.08×10-3mg/mL)极显著低于PPH1的(3.41×10-1mg/mL)和FPH1的(2.60×10-1mg/mL)。这一结果应归因于3种酶对叶蛋白的不同酶切位点能释放不同序列组成的蛋白水解物。
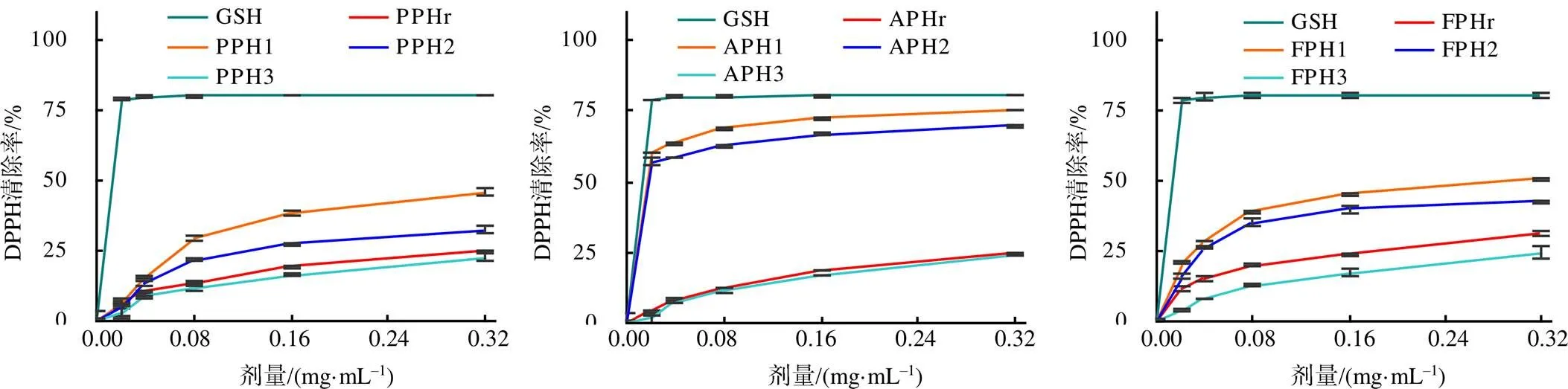
图3 长萼堇菜叶蛋白水解物对DPPH的清除率
2.4 长萼堇菜叶蛋白水解物的超滤分离效果
如图4所示,在前10 min,PH1只有1个主要的色谱峰,而PH2和PH3各有2个明显的色谱峰。这应归因于PH2和PH3的相对分子质量范围大于PH1的。可见,用反相HPLC色谱法检测PH1、PH2和PH3,可快速定性分析长萼堇菜叶蛋白水解物组分的超滤分离效果。

图4 不同相对分子质量范围的长萼堇菜叶蛋白水解物的HPLC分析结果
2.5 长萼堇菜叶蛋白水解物的抗肿瘤细胞活性
从图5可知,不同水解物组分对143B细胞活力的抑制作用低于化疗药物5-Fu和DDP的,但仍表现出一定的抑制活性;3组水解物的抗肿瘤细胞活性均与其使用剂量呈正相关,与其相对分子质量大小呈负相关,PH1的抗肿瘤细胞活性最强。
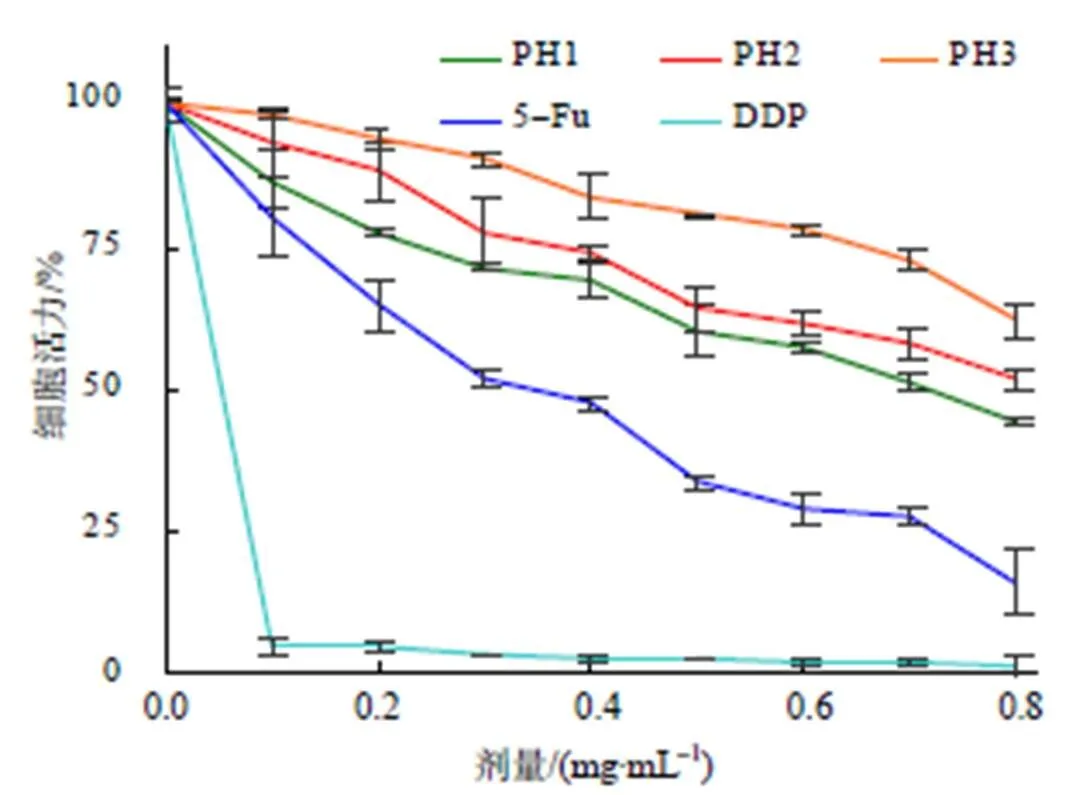
图5 长萼堇菜叶蛋白水解物对肿瘤细胞活性的抑制作用
2.6 长萼堇菜叶蛋白水解物的延长线虫寿命活性
如图6所示,未添加水解物的线虫组中,线虫存活时间低于25 d;添加PH1、PH2和PH3的线虫组中,水解物质量浓度为0.10 mg/mL组的延寿效应整体优于0.02 mg/mL组的,且最大存活时间分别是28、28、26 d,PH1和PH2对线虫寿命的延长作用优于PH3的。
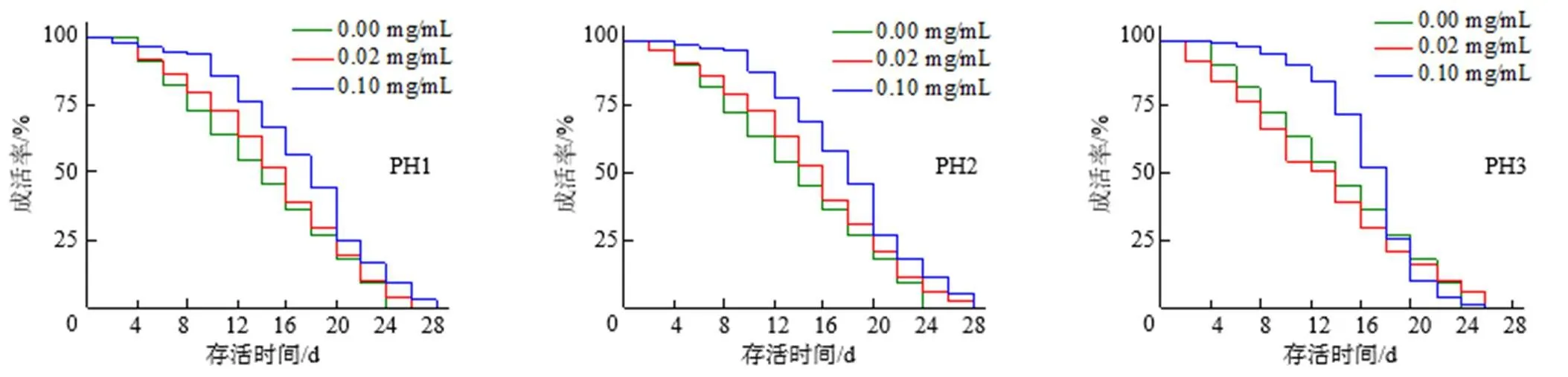
图 6 添加长萼堇菜叶蛋白水解物后的线虫寿命
3 结论与讨论
本研究中,采用碱提酸沉法成功制备了长萼堇菜叶蛋白。在使用该方法提取不同植物的蛋白时,依据起始材料性质的不同,最适的料液比、碱提pH值和酸沉pH值会有相应的差异。苜蓿干草为原料的最适料液比、碱提pH和酸沉pH分别为1∶35、10和4.2[29];甘薯鲜叶为原料的最适料液比、碱提pH和酸沉pH分别为1∶4、8.0和4.5[30];牡丹籽饼为原料的最适料液比、碱提pH和酸沉pH分别为1∶12、8.5和4.0[31]。本研究优选的提取长萼堇菜叶蛋白最适的料液比、碱提pH和酸沉pH分别为1∶9、10.0和4.5,均介于上述文献所用的参数数值范围内。
在来源于植物的蛋白质水解物中,现已发现的典型活性成分主要在相对分子质量小于等于3×103的组分中[5,15,23]。本研究中,长萼堇菜叶蛋白的3种酶促水解产物均以相对分子质量小于3.3×103的含量较多。在抗氧化方面,已从大米、小麦、核桃、板栗和紫苏等植物中鉴定出有较强抗氧化活性的蛋白水解肽,同时也发现相对分子质量小于1×103的肽段的抗氧化能力显著强于相对分子质量大于3×103的多肽和蛋白质组分的[2,15,23-24,26]。本研究中,长萼堇菜叶蛋白水解物中相对分子质量小于1×103的组分具有最优的抗氧化活性,与上述研究结果一致。
在抗肿瘤方面,部分植物的蛋白水解物已被发现有明显的抑瘤效应[11,32-33]。大豆蛋白水解物能显著抑制2种肿瘤细胞(HeLa和C-3)的活性,IC50值分别为2.15、2.27 mg/mL[11]。从嘉兰()根茎蛋白水解物中纯化的相对分子质量约为3×103的多肽对SW620细胞具有抑制活性[32]。本研究中,长萼堇菜叶蛋白水解物对肿瘤细胞表现出一定的抑制活性,以相对分子质量小于1×103的组分的抑制效果相对最优。
在抗衰老方面,从当归蛋白水解物中分离的多肽组分(约20 aa)[12]和从玉米中分离的二肽(TA)[34]均可延长线虫寿命。抗氧化剂被认为具有延寿效应[35],同时蛋白水解肽的抗氧化活性也被认为涉及对线虫的延寿机制[12]。本研究中,长萼堇菜叶蛋白水解物中的组分PH1和PH2对秀丽隐杆线虫寿命的延长作用和抗氧化活性均优于组分PH3的,表明蛋白水解物组分的抗衰老活性与抗氧化活性呈正相关。
综上可知,在长萼堇菜叶蛋白水解物组分中,相对分子质量小于1×103的组分具有更好的应用开发潜力。
[1] ZHANG C,SANDERS J P M,XIAO T T,et al. How does alkali aid protein extraction in green tea leaf residue:a basis for integrated biorefinery of leaves[J]. PLoS One,2015,10(7):e0133046.
[2] SHENG J,YANG X,CHEN J,et al.Antioxidative effects and mechanism study of bioactive peptides from defatted walnut(L.) meal hydrolysate[J]. Journal of Agricultural and Food Chemistry,2019,67(12):3305-3312.
[3] JIN D X,LIU X L,ZHENG X Q,et al. Preparation of antioxidative corn protein hydrolysates,purification and evaluation of three novel corn antioxidant peptides[J].Food Chemistry,2016,204:427-436.
[4] BUDSEEKOAD S,TAKAHASHI YUPANQUI C,ALASHI A M et al.Anti-allergic activity of mung bean ((L.) Wilczek) protein hydrolysates produced by enzymatic hydrolysis using non-gastrointestinal and gastrointestinal enzymes[J].Journal of Food Biochemistry,2019,43(1):e12674.
[5] XIE Z J,HUANG J R,XU X M,et al.Antioxidant activity of peptides isolated from alfalfa leaf protein hydrolysate[J]. Food Chemistry,2008,111(2):370-376.
[6] XU Y,LI Y T,BAO T,et al.A recyclable protein resource derived from cauliflower by-products:potential biological activities of protein hydrolysates[J]. Food Chemistry,2017,221:114-122.
[7] SUN C,TANG X,REN,Y,et al.Novel antioxidant peptides purified from mulberry(Roxb.) leaf protein hydrolysates with hemolysis inhibition ability and cellular antioxidant activity[J].Journal of Agricultural and Food Chemistry,2019,67(27):7650-7659.
[8] WANG N,WU X L,KU L X,et al.Evaluation of three protein-extraction methods for proteome analysis of maize leaf midrib,a compound tissue rich in sclerenchyma cells[J].Frontiers in Plant Science,2016,7:856.
[9] GÖRGÜÇ A,BIRCAN C,YıLMAZ F M.Sesame bran as an unexploited by-product:effect of enzyme and ultrasound-assisted extraction on the recovery of protein and antioxidant compounds[J].Food Chemistry,2019,283:637-645.
[10] LÓPEZ-BARRIOS L,ANTUNES-RICARDO M,GUTIÉRREZ-URIBE J A.Changes in antioxidant and antiinflammatory activity of black bean(L.) protein isolates due to germination and enzymatic digestion[J].Food Chemistry,2016,203:417-424.
[11] MORA-ESCOBEDO R,ROBLES-RAMÍREZ M D C,RAMÓN-GALLEGOS E,et al.Effect of protein hydrolysates from germinated soybean on cancerous cells of the human cervix:an in vitro study[J].Plant Foods for Human Nutrition,2009,64:271.
[12] WANG Q Q,HUANG Y X,QIN C X,et al.Bioactive peptides from Angelicaprotein hydrolyzate delay senescence inthrough antioxidant activities[J].Oxidative Medicine and Cellular Longevity,2016,2016:8956981.
[13] PARK S,YOO K O,MARCUSSEN T,et al. Cyclotide evolution:insights from the analyses of their precursor sequences,structures and distribution in violets ()[J].Frontiers in Plant Science,2017,8:2058.
[14] WANG W,SCALI M,VIGNANI R,et al.Protein extraction for two-dimensional electrophoresis from olive leaf,a plant tissue containing high levels of interfering compounds[J].Electrophoresis,2003,24(14):2369-2375.
[15] ZHANG J H,ZHANG H,WANG L,et al. Antioxidant activities of the rice endosperm protein hydrolysate:identification of the active peptide[J]. European Food Research and Technology,2009,229(4):709-719.
[16] EVANGELHO J A D,VANIER N L,PINTO V Z,et al. Black bean(L.) protein hydrolysates: physicochemical and functional properties[J].Food Chemistry,2017,214:460-467.
[17] 霍永久,刘正旭,金晓君,等.鸡蛋蛋清和蛋白多酶水解工艺的优化[J].湖南农业大学学报(自然科学版),2015,41(2):149-155. HUO Y J,LIU Z X,JIN X J,et al.Optimization for hydrolyzing process of egg white protein using multi-enzyme[J].Journal of Hunan Agricultural University (Natural Sciences),2015,41(2):149-155.
[18] AIELLO G,LAMMI C,BOSCHIN G,et al. Exploration of potentially bioactive peptides generated from the enzymatic hydrolysis of hempseed proteins[J]. Journal of Agricultural and Food Chemistry,2017,65(47):10174-10184.
[19] ZHANG J,LI J T,HUANG Z,et al.Transcriptomic screening for cyclotides and other cysteine-rich proteins in the metallophyte[J].Journal of Plant Physiology,2015,178:17-26.
[20] SHU H Y,ZHANG J,LIU F Y,et al.Comparative transcriptomic studies on a cadmium hyperaccumulatorand its non-tolerant counterpart.[J].International Journal of Molecular Sciences,2019,20(8):E1906.
[21] PARSLEY N C,SADECKI P W,HARTMANN C J,et al.Viola “” no more:an analysis of antibacterial cyclotides[J].Journal of Natural Products,2019,82(9):2537-2543.
[22] JIANG H P,TONG T Z,SUN J H,et al. Purification and characterization of antioxidative peptides from round scad() muscle protein hydrolysate[J]. Food Chemistry,2014,154:158-163.
[23] ZOU Z P,WANG M J,WANG Z G,et al. Antihypertensive and antioxidant activities of enzymatic wheat bran protein hydrolysates[J].Journal of Food Biochemistry,2020,44(1):e13090.
[24] FENG Y X,RUAN G R,JIN F,et al.Purification,identification,and synthesis of five novel antioxidant peptides from Chinese chestnut(Blume) protein hydrolysates[J].LWT-Food Science and Technology,2018,92:40-46.
[25] 袁野,朱仕豪,凌志辉,等.瓜蒌皮多酚纯化工艺及抗氧化活性[J].湖南农业大学学报(自然科学版),2019,45(4):420-424. YUAN Y,ZHU S H,LING Z H,et al.The purification process and antioxidant activity of polyphenols from the pericarpium trichosanthis[J]. Journal of Hunan Agricultural University (Natural Sciences),2019,45(4):420-424.
[26] KIM J M,LICEAGA A M,YOON K Y.Purification and identification of an antioxidant peptide from perilla seed() meal protein hydrolysate[J]. Food Science & Nutrition,2019,7(5):1645-1655.
[27] CAI L,QIN X J,XU Z H,et al.Comparison of cytotoxicity evaluation of anticancer drugs between real-time cell analysis and cck-8 method[J].ACS Omega,2019,4(7):12036-12042.
[28] ZHOU Y,XU Q G,ZHOU X H,et al.Stress resistance and lifespan extension ofenhanced by peptides from mussel() protein hydrolyzate[J].Food & Function,2018,9(6):3313-3320.
[29] 许英一,李红,杨伟光,等.碱提酸沉法提取紫花苜蓿干草叶蛋白初探[J].食品工业科技,2011,32(6):264-266. XU Y Y,LI H,YANG W G,et al.Study on preparation of leaf protein from alfalfa hay by alkali extraction and acid precipitation[J].Science and Technology of Food Industry,2011,32(6):264-266.
[30] 吕巧枝,木泰华,孙艳丽.甘薯叶可溶性蛋白提取工艺研究[J].食品研究与开发,2007,28(3):18-22. LV Q Z,MU T H,SUN Y L.Study on the extraction technology of soluble protein from sweet potato leaves[J].Food Research and Development,2007,28(3):18-22.
[31] 徐玥,张存劳,杨耿,等.碱提酸沉法提取牡丹籽饼中蛋白质的研究[J].中国油脂,2019,44(8):28-30. XU Y,ZHANG C L,YANG G,et al.Extraction of protein from peony seed cake by alkali extraction and acid precipitation method[J].China Oils and Fats,2019,44(8):28-30.
[32] JAHANBANI R,GHAFFARI S M,SALAMI M,et al. Antioxidant and anticancer activities of walnut(L.) protein hydrolysates using different proteases[J]. Plant Foods for Human Nutrition,2016,71(4):402-409.
[33] BUDCHART P,KHAMWUT A,SINTHUVANICH C,et al.Partially purifiedpeptides inhibit colon cancer cell viability by inducing apoptosis through p53 upregulation[J].The American Journal of the Medical Sciences,2017,354(4):423-429.
[34] ZHANG Z,ZHAO Y,WANG X,et al.The novel dipeptide Tyr-Ala(TA) significantly enhances the lifespan and healthspan of[J]. Food & Function,2016,7(4):1975-1984.
[35] DETIENNE G,DE HAES W,MERGAN L,et al. Beyond ROS clearance:peroxiredoxins in stress signaling and aging[J].Ageing Research Reviews,2018,44:33-48.
Preparation and activity analysis ofBlume leaf protein hydrolysates
XI Xueling1,2, YANG Mingting1,2, QIN Ting1,2, LIAO Bin3, ZHANG Jun1,2*
(1.School of Biosciences and Biopharmaceutics, Guangdong Pharmaceutical University, Guangzhou, Guangdong 510006, China; 2.Guangdong Province Key Laboratory for Biotechnology Drug Candidates, Guangzhou, Guangdong 510006, China; 3.School of Life Science, Sun Yat-sen University, Guangzhou, Guangdong 510275, China)
Blume was purified using the optimized alkali extraction and acid precipitation method. Leaf protein hydrolysates were prepared by enzymatic method. The components of leaf protein hydrolysates were separated by ultrafiltration, and their antioxidant activities were analyzed. The isolated hydrolysate components were desalted by solid phase extraction, evaluated by HPLC analysis, and assayed the inhibitory activities to tumor cells along with the effects on lifespan of nematodes.leaf proteins could be stably extracted with the optimized parameters(ratio of material to liquid 1∶9, pH value of alkali extraction 10.0, and pH value of acid precipitation 4.5). The three selected proteases(papain, basic protease and flavor enzyme) could make most of hydrolysates with relative molecular weight less than 3.3×103, and ultrafiltration could isolate the groups of hydrolysate components with molecular weight of <1×103(PH1), 1×103-<3×103(PH2) and ≥3×103(PH3), respectively. The antioxidant activity and anticancer activity of the component PH1 were better than those of other components. PH1 and PH2 had similar effects on lifespan of nematodes, but both were superior to PH3. Therefore, the component PH1 ofleaf protein hydrolysates had more application and development value.
Blume; leaf proteins; protein hydrolysates;; biological activity
TQ936.1;TQ464.7
A
1007-1032(2020)06-0716-07
习雪玲,杨茗婷,覃婷,廖斌,张军.长萼堇菜叶蛋白水解物的制备及其活性分析[J].湖南农业大学学报(自然科学版),2020,46(6):716-722.
XI X L, YANG M T, QIN T, LIAO B, ZHANG J. Preparation and activity analysis ofBlume leaf protein hydrolysates[J]. Journal of Hunan Agricultural University(Natural Sciences), 2020, 46(6): 716-722.
http://xb.hunau.edu.cn

2020-06-28
2020-07-24
国家自然科学基金项目(31570506);广东药科大学创新强校项目(2017KCXTD020)
习雪玲(1992—),女,湖北襄阳人,硕士研究生,主要从事植物活性肽研究,2296510646@qq.com;*通信作者,张军,博士,副教授,主要从事乡土植物资源研究,lsszhangj@gdpu.edu.cn
10.13331/j.cnki.jhau.2020.06.013
责任编辑:邹慧玲
英文编辑:柳正
——柔毛堇菜

