“改良一肾一夹”心肌肥厚模型及评价∗
纪荣静 赵永辉 武俊元 高万里 高传玉 张聚静 藏小彪 王现青 张静 刘策
心肌肥厚可分为生理性和病理性心肌肥厚,后者可导致心脏功能受损、心力衰竭以及高死亡率。建立心肌肥厚模型是各项实验研究的基石。根据制作方法的不同,心肌肥厚动物模型主要包括2类:原发性和继发性心肌肥厚。继发性又可分为压力超负荷[1-4]、药物性[5]、应激性、基因工程性等。目前高血压诱导心肌肥厚模型大多为主动脉缩窄、肾动脉缩窄(包括2肾2夹手术、2肾1夹手术),且多为小鼠、大鼠、兔等小型动物模型。基于以上研究,本研究采用“1肾1夹”手术制作犬肾性高血压心肌肥厚模型。
1 材料与方法
1.1 实验动物 健康9~12月龄比格犬24只,雄性,体重12~15 Kg,由南京亚东实验动物研究中心提供,编号:NO.201708679。随机分为正常组8只,氯沙坦(Losartan)组8只,左室肥厚(LVH)组8只。饲养环境12 h 昼夜循环,保持环境温度20℃~25℃、湿度50%~55%,定时喂水喂食,对流通气良好。所有犬经适应性饲养1周后实施手术。
1.2 一肾一夹模型建立 每只犬称重、测血压后,皮下注射“酚磺乙胺注射液0.1 ml/Kg(2 ml,1007237,湖北天药药业股份有限公司)、硫酸阿托品注射液0.1 ml/Kg”为手术做准备。经静脉给予丙泊酚0.5~1 ml/Kg麻醉诱导,经喉气管插管,连接动物呼吸麻醉机(曲阜市盛旺医疗器械有限公司-盛德,MJ-560B1),调整异氟烷(100 ml,C002161003,河北一品制药股份有限公司)浓度至2.5%,并在整个手术期间维持此浓度,保持犬心率90~120 次/分。术中密切监测犬心率、胸部呼吸活动,及时调整呼吸麻醉机参数。术中维持手术台恒温垫温度在38℃~39℃,维持犬体温37℃±0.5℃。
肾动脉结扎:右侧卧位,左侧腹部备皮、消毒,于左侧肋缘下、距脊柱约4~5 cm 处行纵向皮肤切口,约5~6 cm,钝性分离皮下组织及腹部三层肌肉。开腹后,右手食指与中指轻柔地将左肾掏出,钝性分离肾盂包膜及脂肪组织充分暴露肾血管及输尿管后,小心探查并游离肾动脉主干;4-0缝合线套于肾动脉主干,助手用游标卡尺测量肾动脉主干直径,选择直径为肾动脉直径30%~40%的自制科氏针与肾动脉并行放置,之后将两者牢固结扎;待结扎牢固后小心抽离克氏针后,左肾动脉主干狭窄60%~70%。术后将犬移至单笼饲养,观察2 h无特殊后送回动物房,饲养环境同术前;术后前3天皮下注射氨 苄 西 林 钠0.05 g· Kg-1·d-1(100 ml,C002161003,河北一品制药股份有限公司),术后进行伤口消毒,预防感染。
1周后,以同样的麻醉方法和气管插管方法对“1夹(1C)”术后的犬进行“右肾摘除术”,术后管理同前所述。
正常组,左肾动脉只套带不结扎,右肾只分离不摘除,其余同上述手术步骤。Losartan组在2次手术后每日按30 mg·Kg-1·d-1的剂量经口给予Losartan片(Losartan Potassium Tablets 50 mg×7片,J20180054,杭州默沙东制药有限公司),饲养12周;正常组和LVH 组犬经口给予同等剂量及剂型的狗粮。
1.3 无创血压测量 “改良1肾1夹”术后,对三组进行血压测量(1次/周)。将犬置于手术台上,安静10~20 min后,于静息状态下用呼吸麻醉机的心电监护仪测量其前肢肱动脉血压,并记录。每只犬均连续测量12周。
1.4 超声心动图检测 分别于术前及造模后12周对每只犬进行超声心动图检测。经犬腕前桡侧皮静脉给予丙泊酚0.5~1 ml/Kg镇静,各组动物胸部褪毛备皮,应用超声诊断仪检测心脏结构及功能。超声测定指标:收缩末期左室后壁厚度(LVPWs)、收缩末期室间隔厚度(IVSTs)、舒张末期左室后壁厚度(LVPWd)、舒张末期室间隔厚度(IVSTd)、左室收缩末期内径(LVEDs)、左室舒张末期内径(LVEDd)、左室短轴缩短分数(FS)。
1.5 左室心肌HE染色和Masson染色 造模手术后12周利用多功能超声仪(飞利浦IE33)检测完毕后,称量犬体重。经静脉给予肝素500 IU/Kg抗凝和2.5% 戊巴比妥钠1.2 ml/Kg麻醉。迅速打开胸腔,将心脏连同心包向上提起,迅速离断主动脉弓、肺动脉、上下腔静脉、肺静脉取出心脏。取出心脏后,迅速将心包及多余的脂肪组织去除,用PBS缓冲液冲洗残余的血液,并轻柔排除心腔内残余血液,剪取左室前降支与回旋支之间的心肌组织。心肌组织用10%的甲醛液固定,石蜡包埋、制片后用HE染色。
Masson染色:心肌组织经甲醛固定;依次自来水和蒸馏水洗后,用Regaud苏木精染液染核5~10 min;充分水洗和蒸馏水洗,用Masson 丽春红酸性复红液浸泡5~10 min,以2%冰醋酸水溶液浸洗片刻;1%磷钼酸水溶液分化3~5 min;不经水洗,直接用亮绿液染5 min;以0.2%冰醋酸水溶液浸洗片刻。最后,95%酒精、无水酒精、二甲苯透明、中性树胶封固。普通光镜下观察心肌组织的形态学变化和心肌胶原纤维增生情况。
1.6 统计学分析方法 应用SPSS24.0统计软件,实验结果以均数±标准差表示,多组比较采用单因素方差分析;两两比较采用t检验,检验水准为P<0.05。
2 结果
2.1 无创血压检测(mm Hg) 术后12周,三组犬血压值见图1所示。术后第4周开始,与正常组和Losartan组相比,LVH 组血压明显升高。术后第12周LVH 组较正常组和Losartan组明显升高[收缩 压:(170.0±12.8)mm Hg vs(119.5±16.9)mm-Hg、(125.7±22.5)mm Hg,P<0.01;舒张压:(119.5±16.9)mm Hg vs(77.0±15.5)mm Hg、(82.5±19.8)mm Hg,P<0.01];Losartan组较正常组有所升高,但无统计学意义(P>0.05)。
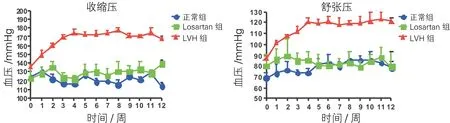
图1 三组12周血压比较
2.2 三组超声心动图检测指标比较 正常组、Losartan 组 术 前 和 术 后12 周:LVPWd、LVPWs、IVSTd、IVSTs、LVEDd、LVEDs无明显差异;Losartan组术后12周LVPWd、LVPWs、IVSTd、IVSTs各指标较术前有所增加,但无统计学意义(P 均>0.05);LVH 组术后12周LVPWd、LVPWs、IVSTd、IVSTs各指标较术前明显增加(P 均<0.05),FS较术前明显减 小(P <0.05)。LVH 组 术 后12 周LVPWd、IVSTd、IVSTs较Losartan 组明显增加(P 均<0.05),FS较Losartan组明显减小(P<0.05)。

表1 三组术前和术后12周超声心动图检测指标比较
2.3 三组心肌组织HE染色和Masson染色 心肌组织HE染色后,正常组心肌细胞成束紧密排列,排列整齐,心肌束间裂隙为切片相关的机械裂隙(图2A);Losartan组心肌细胞体积与正常组比较未见明显增大,心肌细胞排列相对整齐、紧密,裂隙为心肌间自然裂隙(图2B);LVH 组心肌细胞体积较正常组和Losartan组明显增大,核内移增多,心肌细胞水肿、断裂,排列紊乱呈漩涡状或波浪状或杂乱无章;心肌间质水肿,裂隙明显增宽且杂乱(图2C)。Masson染色:普通光镜下,LVH 组(图2c)心肌组织中,胶原纤维沉积较正常组(2a)和Losartan 组(2b)明显增加,而Losartan组与正常组比较胶原纤维增加不明显。
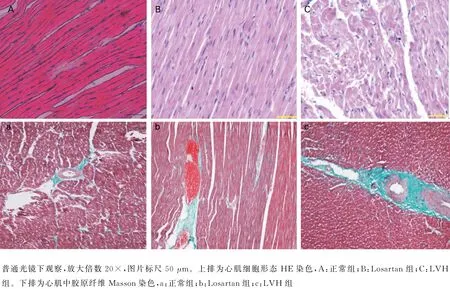
图2 三组心肌组织HE及Masson染色
3 讨论
建立心肌肥厚模型是利用动物实验研究其发生机制的必要手段。复制心肌肥厚的方法繁多,总体来说分为物理法、化学法和生物法,具体包括压力超负荷法、容量负荷法、转基因法、药物或运动诱导致心肌肥厚等。本实验与孙琪等[6]“一肾一夹”大鼠肾性高血压模型制作方法均切除一侧肾;孙琪等人利用内径为0.4 mm 的“Ω”型小夹使一侧肾动脉狭窄;而本实验利用直径为1/2至1/4犬肾动脉直径的科氏针与分离出的肾动脉平行结扎,然后抽出科氏针。操作简便易行、耗材经济,并且降低异物残存所致的感染风险。本实验“一肾一夹”相比于田作军等[7]“两肾两夹”(两侧肾动脉均狭窄50%)犬肾性高血压模型,一方面,使一侧肾动脉缩窄50%~70%,造成肾组织部分缺血,激活肾素-血管紧张素-醛固酮(RAS)系统,分泌的效应因子血管紧张素Ⅱ(AngⅡ)不仅调节血压,而且通过结构重塑调节心室压力[8-9],心脏耗氧量增加,心肌内交感神经末梢去甲肾上腺素释放增高;另一方面切除对侧肾脏,使循环系统前负荷增加的幅度和肾缺血的程度更大,保证了组织和循环RAS系统充分激活。以上神经-体液因素的参与,导致心肌代谢紊乱、左室电重构和结构重构,发生心肌肥厚、心肌纤维化和恶性室性心律失常[10-12]。
另一方面,Losartan组收缩压及舒张压与正常组相比无差异,说明可经过拮抗血管紧张素受体1(AT1R)有效治疗此类高血压,进一步证明了该肾性高血压模型激活RAS系统,为后续研究左室心肌肥厚与RAS系统各成分之间的相关性提供模型基础。
本实验,不同于以往小型啮齿类实验动物如:大鼠、兔、豚鼠等[6-7,12],而是利用大型哺乳类动物犬建立“肾性高血压心肌肥厚”模型。实验发现,犬基因与人类基因更相似,因此犬心肌肥厚模型,更能代表人类心肌肥厚病生理和电生理的发生发展过程。既往手术入路采用腹正中切口,使腹腔大部分器官暴露在外,对机体损伤较大,更容易造成腹腔感染;本实验采用脊柱旁肋弓下4~5 cm 切口,损伤小,仅需暴露肾脏,大大减少了感染风险,降低死亡率。与正常组和Losartan组相比,LVH 组血压从术后第4周开始明显升高。本实验从血压、超声、组织学反应证实造模成功,为后续实验提供研究材料。

