采用MiSeq测序技术分析3种飞虱中肠内容物的菌群结构
张珏锋,俞叶飞,李 芳,钟海英,陈建明,*
(1.浙江省农业科学院 植物保护与微生物研究所,浙江 杭州 310021; 2.浙江大盘山国家级自然保护区管理局,浙江 磐安 322300)
绝大多数昆虫体内都含有共生微生物,尤以半翅目昆虫更甚,因为该目昆虫大多以植物汁液为食,吸收的营养较为单一,其体内的共生微生物有助于寄主的营养、发育、繁殖,以及对寄主昆虫天敌的防御[1]。近年来的研究发现,共生微生物在昆虫抵御外界化学物质包括化学杀虫剂的降解方面起着重要作用[2]。半翅目的褐飞虱(NilaparvatalugensStål,BPH)、白背飞虱(SogatellafurciferaHorvath,WBPH)和灰飞虱(LaodelphaxstriatellaFallén,SBPH)是我国水稻产区的主要害虫,通过取食稻株韧皮部汁液为害;这3种飞虱的暴发往往具有连续性,且在取食过程中还会传播病毒。目前对这3种飞虱共生微生物的研究主要集中于其体内的共生类酵母在寄主飞虱营养补充上的作用[3]。然而,越来越多的研究表明,昆虫体内的细菌类共生微生物有助于宿主的抗药性发展[2]、营养补充[4]和生殖[5]等,该类功能的发现为害虫的田间防治提供了新的方向。进一步探明昆虫体内细菌类共生微生物的组成结构,可为害虫防治新策略的形成提供理论基础。
体外培养、变性梯度凝胶电泳(DGGE)和16S rDNA克隆文库建立等技术都曾运用于飞虱体内细菌类共生微生物的结构分析,然而以上技术还不能提供足够的测序深度覆盖飞虱体内复杂的微生物群落。本研究运用第二代测序技术,以16S rRNA基因作为标志物检测褐飞虱、白背飞虱、灰飞虱中肠内细菌群落的组成结构多样性,比较3种飞虱中肠内微生物群落结构的相似/差异性,以及各个种群的优势菌群。本研究可为发挥共生微生物在飞虱田间防控中的作用提供理论基础。
1 材料与方法
1.1 材料
水稻品种TN1(Taichung Native)分批分期种植于浙江省农业科学院温室内,至45日龄时移栽待用。本实验所用3种飞虱采自杭州郊区田间,已在浙江省农业科学院温室中饲养50余代,饲养条件:温度(28±1)℃,光照周期16 h∶8 h(L/D),初羽化24 h内成虫用于实验。
1.2 MiSeq测序实验流程
1.2.1 DNA提取
3种飞虱各取50头初羽化成虫,用75%乙醇体表清洗后无菌条件下解剖出中肠,无菌水冲洗后-20 ℃保存,用于DNA的提取。细菌DNA的提取采用细菌DNA提取试剂盒(OMEGA,USA),所得DNA溶于200 μL ddH2O中,用1%琼脂糖凝胶电泳和Nanodrop 1000分光光度计(Saveen Werner ApS,丹麦)检测DNA质量。
1.2.2 PCR扩增和测序
以纯化后的基因组DNA作为模板,以细菌16S rRNA V1~V3区特征性引物对338F、806R扩增(338F :5′-ACTCCTACGGGAGGCAGCA-3′;806R:5′-GGACTACHVGGGTWTCTAAT-3′),同时在上游引物5′端添加Barcode序列区分样品。反应体系为5×Fast Pfu缓冲液4.0 μL、2.5 mmol L-1dNTPs 2 μL、正反向引物(5 μmol L-1)各0.4 μL、Fast Pfu聚合酶0.4 μL、模板DNA 10 ng,dd H2O补至20 μL。PCR程序:95 ℃ 2 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,25个循环;72 ℃延伸5 min。每个样品3次重复,将同一样品的PCR产物混合后用2%琼脂糖凝胶电泳检测,切胶回收PCR产物,Tris-HCl洗脱,2%琼脂糖凝胶电泳检测。
1.2.3 荧光定量
参照电泳初步定量结果,将PCR产物用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合。
1.2.4 Miseq文库构建与测序
测序样本连接“Y”字形接头之后使用磁珠筛选,去除接头自连片段,利用PCR扩增进行文库模板的富集,NaOH变性产生单链DNA片段。将DNA片段的一端与引物碱基互补,固定在芯片上;另一端随机与附近的另外一个引物互补,形成“桥(bridge)”;PCR扩增,产生DNA簇;DNA扩增子线性化成为单链。加入改造过的DNA聚合酶和带有4种荧光标记的dNTP,每次循环只合成1个碱基;用激光扫描反应板表面,读取每条模板序列第一轮反应所聚合上去的核苷酸种类;将“荧光基团”和“终止基团”化学切割,恢复3′端黏性,继续聚合第2个核苷酸。统计每轮收集到的荧光信号结果,获取模板DNA片段的序列。
1.2.5 测序数据处理
生物信息分析方法使用mothur软件完成。有效序列数据分析:通过Barcode区分各样品的测序数据,生成不含Barcode的各样品测序序列。
优化数据分析:Miseq测序得到的是双端序列数据,首先根据PE reads之间的overlap关系,将成对的reads拼接成一条序列,同时对reads的质量和拼接效果进行质控过滤,过滤read尾部质量值<20的碱基,设置50 bp的窗口,如窗口内的平均质量值低于20,从窗口开始截去后端碱基,过滤质控50 bp以下的read;根据PE reads之间的overlap关系,将成对reads拼接成1条序列,最小overlap长度为10 bp;拼接序列的overlap区允许的最大错配比率为0.2,筛选不符合序列,根据序列首尾两端的barcode和引物序列区分样品得到有效序列,并校正序列方向。
操作分类单元(operational taxonomic unit,OTU)聚类分析:使用Vsearch(版本2.4.2)软件对优质序列按照序列97%相似度进行OTU分类,选取每个OTU中丰度最大的序列作为该OTU的代表序列,采用贝叶斯分类算法对代表序列与Silva、Greengenes、Rdp数据库进行比对注释,得到OTU的注释信息,根据每个OTU在各个样本中包含的序列数,构建OTU在各个样本中的丰度矩阵文件,根据序列比对采用Pynast (v0.1)软件对OTUs代表序列进行系统进化关系的构建。
稀释性曲线:使用97%序列相似度的OTU,利用mothur做rarefaction分析,利用R语言工具制作曲线图。
群落结构组分图:利用R语言工具作图,并在作图时将丰度低于1%的部分合并为other在图中显示。
热图:利用R语言vegan包、vegdist和hclust进行距离计算和聚类分析。距离算法采用Bray-Curtis,聚类方法选用complete。
2 结果与分析
2.1 数据优化与统计
本次测序中,3种飞虱9个样本共获得2.62×108bp的原始数据,经过以上处理后3种飞虱(9个样本)共得到3.44×105条序列,平均长度为447.78 bp,其中401~500 bp的片段占总片段的99.99%。从表1可知,灰飞虱(SBPH)获得的有效序列和碱基数明显多于褐飞虱(BPH)和白背飞虱(WBPH),但3种飞虱序列的平均长度并无显著差异。
2.2 三种飞虱细菌群落结构多样性
统计学分析指数通常用于估计环境群落微生物的丰度和多样性。Chao指数是用算法估计样本中所含OTU数目的指数,Ace指数也是用来估计群落中OTU数目的指数,与Chao指数的算法不同。Shannon与Simpson指数是用来估算样本中微生物多样性的指数,Shannon值越大,说明群落多样性越高,Simpson指数值越大,说明群落多样性越低。Coverage指数是指各样本文库的覆盖率,其数值越高,则样本中序列被测出的概率越高,而没有被测出的概率越低。本实验在3%和6%水平比较各个样品的指数,结果(表2)表明:白背飞虱(WBPH)的OTU数量最多;灰飞虱最少,其在3%和6%水平分别为白背飞虱的59.22%和61.76%。表2中Shannon多样性指数显示,白背飞虱在3种飞虱中具有最高的细菌群落多样性。图1的稀释性曲线也表明,3%水平的褐飞虱和灰飞虱的细菌群落多样性显著低于白背飞虱。同时,图1显示本次测序的3个样本在测序深度为112 189时趋于平稳,表明该测序深度足以覆盖3个稻飞虱种群的整个细菌多样性。
2.3 OTUs统计与分类学分析
采用RDPclassifier贝叶斯算法对OUT代表序列进行比对分析,3种飞虱中肠细菌类微生物共聚类于11个门20个纲35个目54个科81个属。运用BLAST和MEGAN软件对3个飞虱样本有效序列进行比对,结果(图2)显示,灰飞虱中肠细菌群落结构与其他2个飞虱样本存在明显差异,近90%的序列比对后归于F-proteobacteria-unclassified;而在其他2个飞虱种群内,Arsenophonus为褐飞虱(BPH)中肠细菌群落优势菌属,约占70%;白背飞虱(WBPH)中Halomonas、Candidatus_Cardinium和Arsenophonus为优势菌,分别约占35%、20%和15%。本研究中,褐飞虱、白背飞虱和灰飞虱中肠样本中鉴定出的细菌分别有57、76和48个属,说明灰飞虱和褐飞虱中肠细菌群落多样性在属水平明显低于白背飞虱。
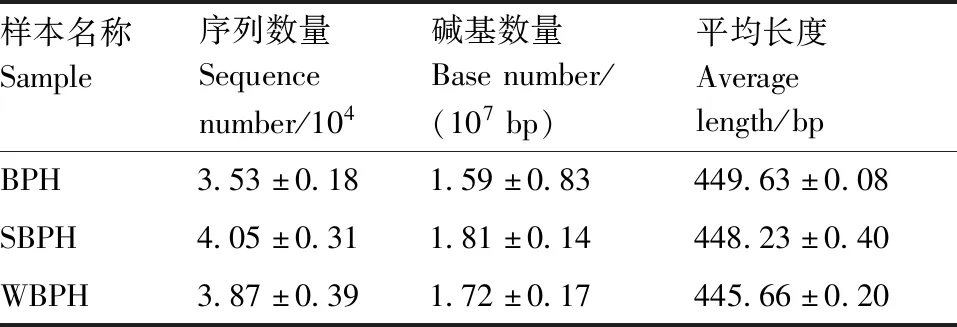
表1 三种飞虱基因序列参数比较
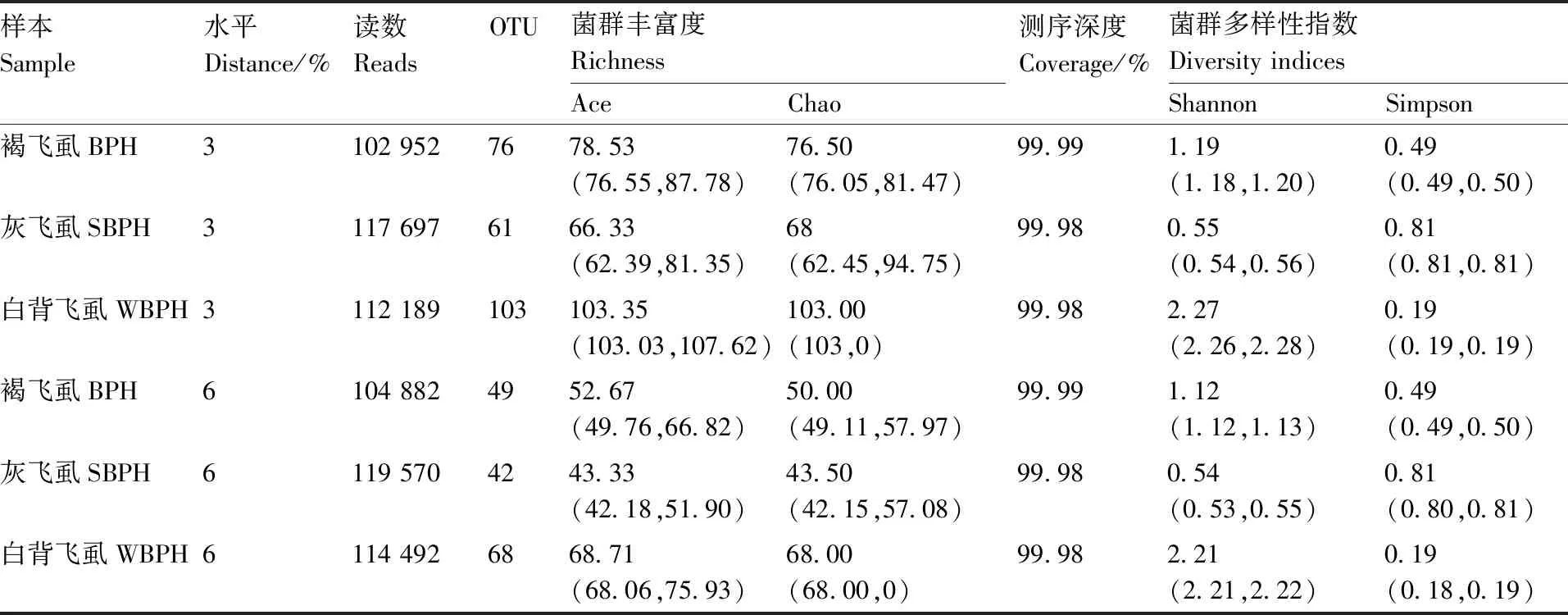
表2 三种飞虱种群中肠细菌群落丰富度和多样性指数比较
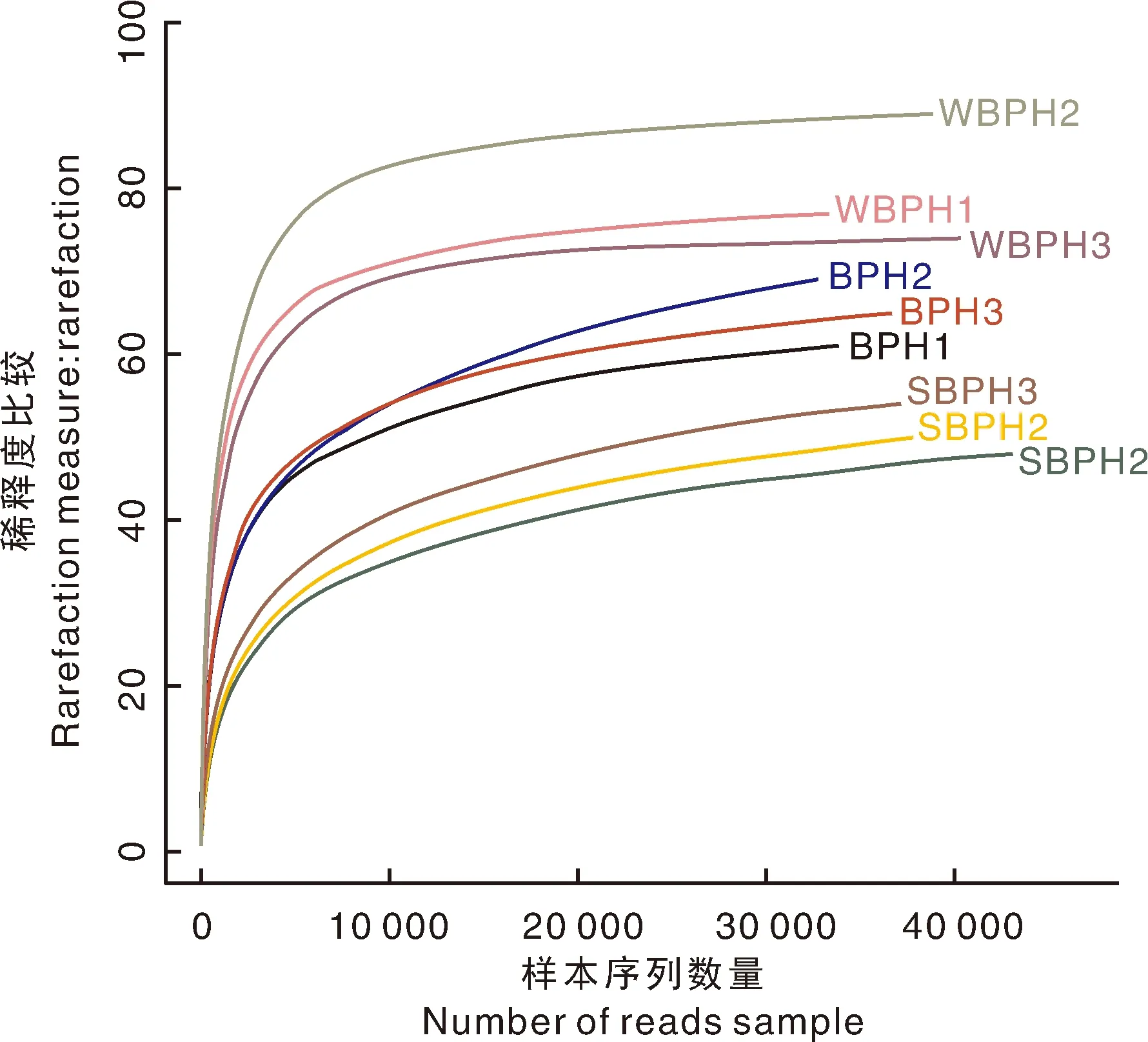
图中1,2,3表示每种飞虱的生物学重复数。The number 1, 2 and 3 represent biological duplications of each planthopper species.图1 三种飞虱在3%水平的稀释性曲线Fig.1 Rarefaction curves of three samples at cutoff levels of 3 %
由图3可知:3种飞虱中肠内相对丰度最高的10种细菌类微生物中,Halomonas是唯一一种在褐飞虱、灰飞虱和白背飞虱体内均检测到的属,且Halomonas在白背飞虱体内具有最高相对丰度;同时,灰飞虱和白背飞虱中肠都检测到Wolbachia;褐飞虱和白背飞虱中肠均检测到Pantoea。该结果也说明3种飞虱中肠优势细菌较少存在相互交叉的种类。
从图3还可以看出,3种飞虱体内各优势菌的相对丰度存在差异,如灰飞虱中肠内,虽然Wolbachia为第2大优势菌,但其相对含量与γ-proteobacteria-unclassified相差甚远。相同的现象在褐飞虱体内也存在,优势菌Arsenophonus与Acinetobacter在含量百分比上相距甚远。与前两者不同的是,白背飞虱(WBPH)中肠内前3种优势菌Halomonas、CandidatusCardinium与Acinetobacter的相对含量百分比较为接近。推测,虽然3种飞虱中肠细菌群落结构复杂,多样性高,但从优势细菌相对丰度而言,体内占主导地位的微生物不易受外界因子的影响。
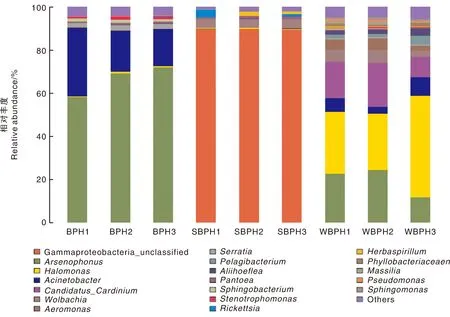
Gammaproteobacteria-unclassified,γ-变形菌纲(未确定);Arsenophonus,杀雄菌属;Halomonas,盐单胞菌属;Acinetobacter,不动杆菌属;Candidatus_Cardinium,Caidinium属;Wolbachia,沃巴克氏体;Aeromonas,气单胞属;Serratia,沙雷氏菌;Pelagibacterium,海洋杆菌属;Aliihoeflea,化能自养砷氧化菌;Pantoea,泛菌属;Sphingobacterium,鞘氨醇杆菌属;Stenotrophomonas,寡养单胞菌;Rickettsia,立克次氏体;Herbaspirillum,草螺菌属;Phyllobacteriaceaen,叶瘤杆菌科;Massilia,马赛菌属;Pseudomonas,假单胞菌菌;Sphingobacterium,鞘氨醇杆菌属;Others,其他。图2 不同飞虱中肠细菌群落结构Fig.2 Bacterial community structure of midgut in three different planthoppers
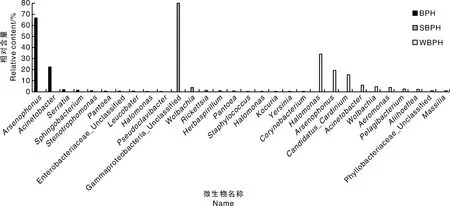
Arsenophonus,杀雄菌属;Acinetobacter,不动杆菌属;Serratia,沙雷氏菌;Sphingobacterium,鞘氨醇杆菌属;Stenotrophomonas,寡养单胞菌;Pantoea,泛菌属;Enterobacteriaceae_Unclassified,肠杆菌科(未确定);Leucobacter,白色杆菌属;Halomonas,盐单胞菌属;Pseudoclavibacter,假棒状杆菌属;Gammaproteobacteria-unclassified,γ-变形菌纲(未确定);Wolbachia,沃巴克氏体;Rickettsia,立克次氏体;Herbaspirillum,草螺菌属;Staphylococcus,葡萄球菌属;Kocuria,考克氏菌属;Yersinia,耶尔森菌属;Corynebacterium,棒杆菌属;Candidatus_Cardinium,Caidinium属;Acinetobacter,不动杆菌属;Aeromonas,气单胞菌属;Pelagibacterium,海洋杆菌属;Aliihoeflea,化能自养砷氧化菌;Phyllobacteriaceae_Unclassified,叶杆菌科(未确定);Massilia,马赛菌属。图3 三种飞虱中肠内主要细菌种类的相对含量Fig.3 Comparison of relative contents of main bacterias in three planthopper species
2.4 三种飞虱中肠细菌群落结构分析
PCA是基于欧式距离分析不同飞虱种群中肠微生物的OTU组成,反映不同种类飞虱体内微生物菌群结构变化差异和距离。挑选不同种群的优势细菌种类进行作图,结果如图4所示,主成分PC1、PC2累积贡献率为98.01%,基本可反映样本间种群结构差异的影响因素。各个样本基于不同距离在PC1和PC2方向上可以较好地分开,3种飞虱的各个重复之间距离较近,但3种不同飞虱之间相互距离较远;其中,褐飞虱与白背飞虱中肠细菌类微生物组成的相似性要高于灰飞虱。
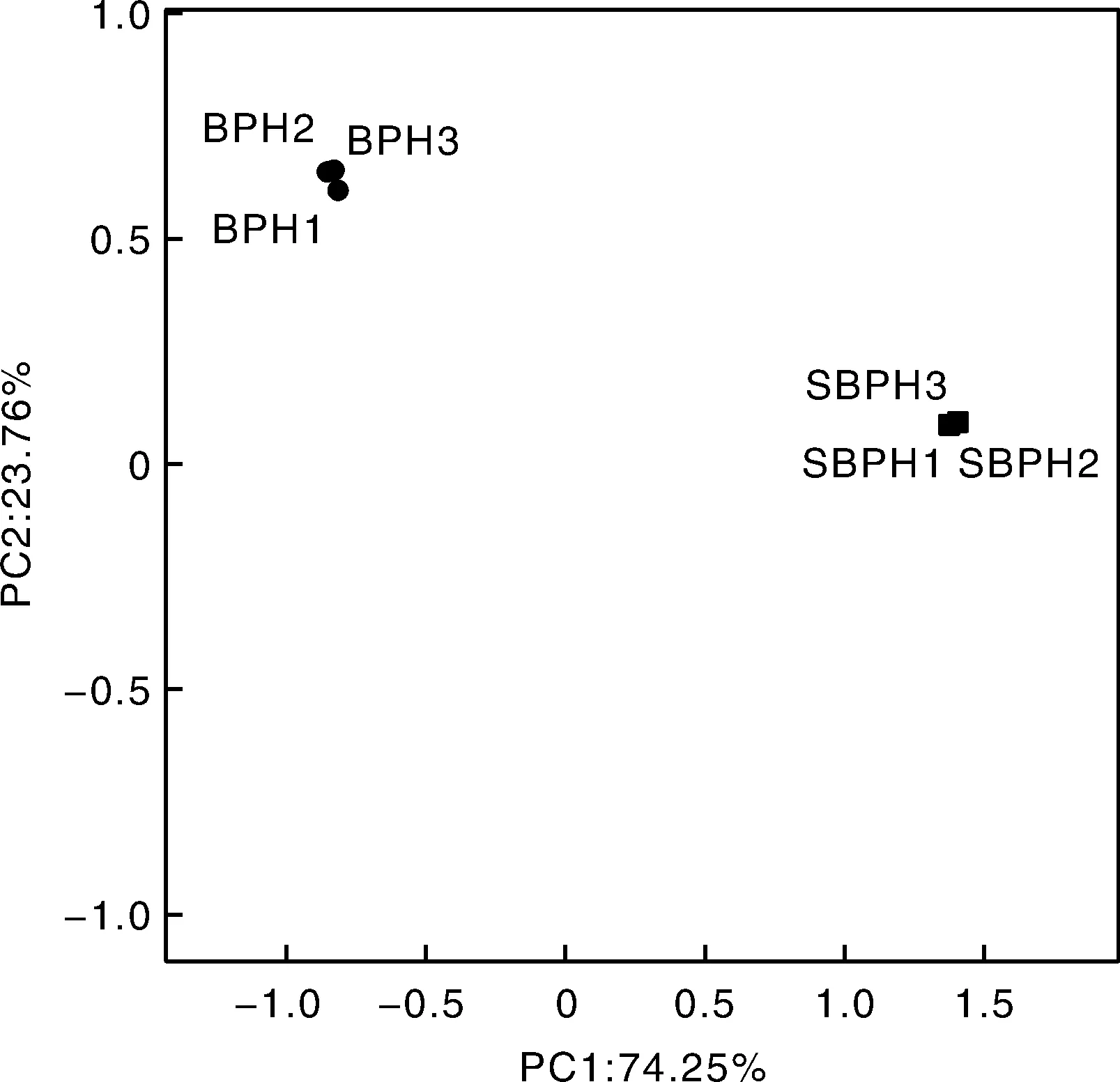
图4 三种飞虱体内细菌类微生物群落结构主成分分析Fig.4 Principal component analysis of microbial community structure in three planthoppers
3 讨论
3种飞虱中肠细菌类微生物群落结构、群落丰富度和优势微生物功能侧重等都存在差异。丰富度曲线显示白背飞虱体内中肠细菌的丰富度高于褐飞虱和灰飞虱。3个飞虱种群体内的优势细菌类微生物主要属于7个大纲(γ-proteobacteria、α-proteobacteria、β-proteobacteria、Bacillus、Actinobacteria、Cytophagia、Sphingobacteriia)21个属。就10种优势细菌而言,3个飞虱种群体内的肠道细菌类微生物类群差异较大,在3个种群中都存在的细菌属仅有Halomonas,并且除该菌之外,每2个飞虱种群之间也仅有1种共有优势细菌。此次在3种飞虱中检测到的21种共生肠道细菌类微生物,包括Wolbachia、Arsenophonus等12个属此前已在飞虱中有过报道[6-8],Kocuria、Yersinia等9个属此前在飞虱微生物中未见报道。虽然3种飞虱起源于同一祖先,但在各自进化过程中,生活习性、寄主选择等存在差异,造成为害时间、为害部位,以及迁飞、越冬方式等都存在差异[9]。如褐飞虱仅能在水稻和普通野生稻上取食和繁殖后代,灰飞虱和白背飞虱的寄主除水稻外还包括禾本科其他作物,如小麦、玉米等。相辉等[10]的研究发现,食料的变化会影响家蚕体内肠球菌的组成,因而推测3种飞虱的取食差异有可能与中肠细菌类微生物群落结构组成差异有关。而共生细菌在寄主对植物的适合度、寄主昆虫的竞争能力和对寄主植物的利用能力等方面具有重要作用[11-12]。3种飞虱中灰飞虱耐低温能力较强,即使在冬季低温亦能安全越冬,而褐飞虱与白背飞虱属长距离迁飞性害虫,无法在寒冷地区越冬,初次虫源由南方热带稻区随气流逐代逐区迁入。已有研究表明,被冰核活性细菌Erwinia(Pantoea)ananas定植于肠道的桑螟幼虫(Mulberrypyralid)抗寒性大大降低,说明中肠细菌类微生物与寄主的耐寒、耐热性等有关[13]。同时,褐飞虱在抗性水稻品种的诱导下易发生致害性变异。徐红星等[14]的研究发现,取食感虫水稻品种的褐飞虱种群体内细菌群落结构明显与取食抗虫品种的褐飞虱种群体内细菌群落结构存在差异。而灰飞虱、白背飞虱种群中并不存在致害性变异的现象,推测该现象的存在与3种飞虱中肠细菌类微生物群落结构差异有关。
除结构与丰富度的差异之外,3种飞虱体内的优势细菌在功能上各有侧重。Wolbachia、Arsenophonu与CandidatusCardinium与昆虫的生殖抑制现象有关,此次测序结果显示仅白背飞虱体内这3种菌都检测到,该结果与张开军[15]的研究结果一致。灰飞虱体内仅检测到Wolbachia,褐飞虱体内仅检测到Arsenophonus。研究表明,灰飞虱和白背飞虱体内的Wolbachia能引起寄主的胞质不亲和(CI)现象[16],褐飞虱体内的Wolbachia与前两者属不同类,并不能引起寄主的CI现象,也没有研究发现褐飞虱存在CI现象。此次检测未在褐飞虱体内检测到Wolbachia,这可能与本次检测用的褐飞虱种群为杭州种群有关。屈吕宇等[17]对采自褐飞虱主要分布区的不同地理种群Wolbachia感染情况进行qPCR检测,也未在杭州种群体内检测出Wolbachia。Nakamura等[18]的研究表明,CandidatusCardinium与Wolbachia同时存在时可提高后者的CI效率;Skinner[19]与Gherna等[20]研究表明,丽蝇金小蜂体内的Arsenophonus可以引起雄性胚胎致死,致使宿主后代性别趋向雌性,虽然该功能未在其他昆虫体内得到验证,但繁殖力较弱的B型烟粉虱种群ZHJ21体内能检测出Wolbachia与Arsenophonus,而繁殖力强的B型烟粉虱则不携带[21],可推测Wolbachia与Arsenophonus的同时存在能影响寄主的繁殖。综上,可推测白背飞虱体内存在的可能对寄主生殖产生影响的细菌类微生物种类较多,灰飞虱次之,而褐飞虱体内仅检测到Arsenophonus,何种原因造成该类微生物在3种飞虱体内的分布差异,以及该类细菌如何对寄主生殖进行调控还需进一步研究。
昆虫体内的肠道微生物通常具有降解外源有毒化学物质的功能。此次在3种飞虱中检测到了Halomonas、Acinetobacter、Aliihoeflea、Stenotrophomonas和Sphingobacterium。其中,Halomonas属的微生物具有很强的生存适应能力,在低于1 100 mg·L-1苯酚中能正常生长[22]。Acinetobacter在白背飞虱与褐飞虱体内都检测到,Wang等[6]发现,该菌与寄主褐飞虱致害性转变存在关联,但对该菌的进一步分离培养实验发现,Acinetobacter为氟虫睛的降解菌,能够在以该杀虫剂为唯一碳源的培养基上正常生长。存在于白背飞虱体内的Aliihoeflea是一种对亚砷酸盐有降解作用的微生物,有研究在Aliihoeflea中检测到亚砷酸盐氧化酶基因[23]。Stenotrophomonas与Sphingobacterium仅在褐飞虱体内有检测到,此前研究发现该属中的一株从土壤中筛选分离并进行培养的微生物具有将烟碱吡虫啉高效羟基化合成5-羟基烟碱吡虫啉的功能[24-25]。而同样从土壤中分离的Sphingobacteriumsp. P1-3具有降解等规聚丙烯(IPP)的功能,在30 ℃、pH 7.0和10 mg·L-1IPP条件下,Sphingobacteriumsp. P1-3在20、30 d内对IPP的降解度可达57.75%和62.47%。褐飞虱与白背飞虱体内存在多种可能与化学杀虫剂降解有关的肠道微生物,特别是褐飞虱体内存在可能与降解氟虫睛、新碱类杀虫剂杀虫剂(吡虫啉、哌虫啶)有关的微生物,这可能与我国自20世纪90年代开始大面积使用新烟碱类杀虫剂,如吡虫啉、噻虫嗪、烯啶虫胺、呋虫胺等[26],而田间白背飞虱和褐飞虱发生时间重叠,通常采用相似的防控手段有关。推测外界化学物质的使用影响昆虫肠道菌的菌群结构变化,而肠道微生物的变化又可能诱导寄主对化学杀虫剂产生抗性。
除了与生殖和外源化学物质降解有关的微生物之外,3种飞虱体内还存在多种目前无法确定其功能的优势菌。Herbaspirillum[27]、Pelagibacterium[28]、Leucobacter[29]、Pseudoclavibacter、Staphylococcus[30]通常存在于周围环境中,包括土壤、水、皮肤,本研究首次在飞虱体内检测到,该类微生物是在虫体在进化过程中定殖于寄主体内,还是在实验操作过程中不慎带入还需进一步研究。Pantoea是一种对植物有益的微生物,在杨树、水稻中都有发现[31]。以上结果说明,在昆虫的进化过程中,环境中的微生物极其容易被昆虫摄入并在其体内定殖。Rickettsia和Yersinia都为病原菌,前者可以显著提高烟粉虱(Bemisiatabaci)后代性比,还能提高雌虫产卵量、后代羽化率和成虫寿命等[32];后者会引起男性肠炎,本研究首次在飞虱中检测到。但是该属中的Yersiniaenterocolitica在近期研究中被证明对昆虫有毒害作用,因该菌可编码杀虫毒素和其他毒力因子[33]。但Rickettsia和Yersinia在飞虱中的功能还无法确定。Corynebacterium是以昆虫为媒介传播的病原菌,该属中的Corynebacteriumpseudotuberculosis可通过蝇类传播给马,但未见在其他昆虫中报道[34]。Aeromonas、Massilia和Serratia都已在褐飞虱体内检测到[6-8],其中,Massilia在二化螟幼虫的肠道中也能检测到[35],目前仅可推测这2种菌均为肠道菌,而Serratia可能与褐飞虱的致害性转变存在关联[6]。Kocuria是首次在飞虱体内检测到的微生物,该属具有很好的腐殖质还原特性,对生物染料包括孔雀石绿、棉兰、甲基橙等具有脱色作用[36],但无法推测在飞虱体内的功能。
半翅目昆虫体内共生微生物的研究主要集中于对寄主营养补充方面,而本次测序结果显示,3种飞虱体内的优势菌株中存在多种与寄主生殖控制、杀虫剂降解功能有关的微生物。以本研究提供的信息为基础,结合飞虱体内微生物群落结构特点可为褐飞虱的田间防控提供新的思路。

