经血源性间充质干细胞的分离培养与鉴定
余柯达 毛佳婷 师帅 邹立波 刘鸿 江文娇
间充质干细胞(MSCs)来源于胚胎发育的中胚层,具有自我更新和多向分化潜能等特点,在再生医学和组织工程研究方面具有广阔的应用前景[1]。MSCs几乎存在于所有的器官和组织中。自1957年Mcculloch等[2]首次从骨髓中发现MSCs,研究者们先后又从脂肪、脐带、牙髓等组织中发现MSCs。目前MSCs已经应用于神经系统损伤[3]、糖尿病[4]、心脏疾病[5]和衰老虚弱[6]等多种疾病的治疗研究。经血中含有出血时脱落的子宫内膜碎片,子宫内膜在女性身体中每月更新,表明其中具有高度增殖能力的干细胞。Meng等[7]首次从女性经血中分离得到子宫内膜来源的MSCs,即经血源性间充质干细胞(MenSCs)。其具有来源广,取材易,无创获得的优点,且来源于人体废弃物,避免伦理问题。作者对MenSCs形态、增殖、鉴定和体外分化进行研究,从而解决再生医学和组织工程的理论和临床应用中的种子细胞来源问题。
1 材料和方法
1.1 材料 (1)经血来源:选择20~30岁健康女性志愿者,其月经规律,月经量正常,临床检查无生殖器畸形和内分泌疾病。志愿者于月经第2天用月经杯收集经血5ml。(2)主要试剂:1.073g/L Ficoll分离液购自美国SIGMA公司;DMEM/12培养基、胰酶、胎牛血清、青霉素-链霉素混合液购自美国GIBCO公司;抗人CD73 PE、CD90 PITC、CD105 PE、CD19 APC、CD45 PITC、CD34 PE、CD14 APC抗体购自美国BD公司。实验时间2019年11月至2020年4月。
1.2 方法 (1)细胞分离培养:将收集的经血与等体积PBS(含1%青霉素-链霉素)混合,4℃保存,在24h内送至实验室。用Ficoll密度梯度离心法分离MenSCs,将经血样本吹打混匀,置于等体积Ficoll分离液上层,1800r/min离心25min,取离心后的中间细胞层,用PBS洗涤2次,再用含10% FBS的DMEM/F-12培养基重悬细胞,接种于6孔培养板中,置于37℃、5% CO2浓度、饱和湿度下常规培养,待细胞贴壁集落形成记为P0,细胞密度达90%,消化传代。(2)绘制生长曲线:取生长良好的MenSCs,消化离心后将细胞重悬成密度为2×107个/L单细胞悬液,96孔板中每孔接种100μl,置于37℃、5% CO2浓度、饱和湿度下培养。在1、3、5、7、9d的固定时间向各孔中加入10μl CCK-8溶液孵育4h后,测定450nm波长的吸光度。(3)细胞表面标志物检测:取生长良好的MenSCs用0.25%胰酶消化,PBS漂洗2遍,再用PBS制成1×106个/L单细胞悬液,在待测样本中各加入CD73 PE、CD90 PITC、CD105 PE、CD19 APC、CD45 PITC、CD34 PE和CD14 APC抗体1μl,同时以PBS作为空白对照。避光室温孵育30min,PBS洗2遍,1300r/min离心5min,用PBS重悬细胞,流式细胞仪检测。(4)成脂诱导分化:根据试剂盒说明书的方法进行。收集生长良好的第三代MenSCs进行体外成脂诱导分化,接种MenSCs(4×104个/孔)于12孔板中培养6h后,更换培养液为成脂诱导分化培养液,换液1次/3~4d,连续培养14d,用4%多聚甲醛固定,再加入油红O染色。
2 结果
2.1 MenSCs的形态特征 原代分离的细胞24h后可观察到少量不规则形、多边形或多角形贴壁细胞,72h后全量换液,弃去杂质细胞。12~14d后原代细胞(P0)贴壁成单层,传代后为P1代细胞(见图1)。随着传代次数的增多,细胞种群逐渐同类化,多数细胞呈纺锤状,排列呈漩涡状且成簇,表现出典型的MSCs特征。
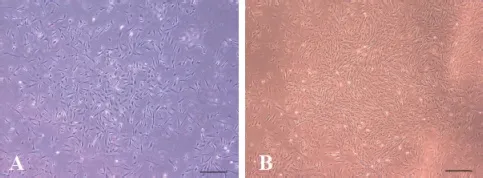
图1 MenSCs(A:P0,B:P1)的形态特征(比例尺:100μm)
2.2 MenSCs的生长曲线 经血来源的干细胞增殖能力(见图2),第1~3天细胞缓慢增长,为生长期的潜伏期,第3 天开始细胞增殖进入对数生长期,快速增长,第5 天后对数增殖期结束进入缓慢增长期。
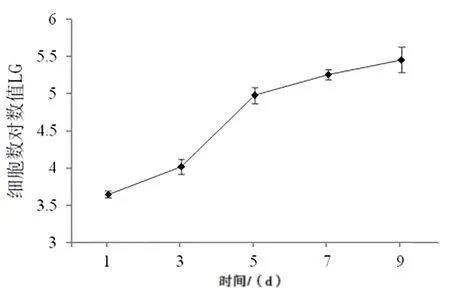
图2 MenSCs的生长曲线
2.3 细胞表面分子标志物检测 经血来源的干细胞表面分子标志物表达情况,流式细胞术鉴定表明细胞高表 达CD73、CD90和CD105,低 表 达CD14、CD34、CD45及CD19,符合MSCs表面分子标志物表达标准。见图3。
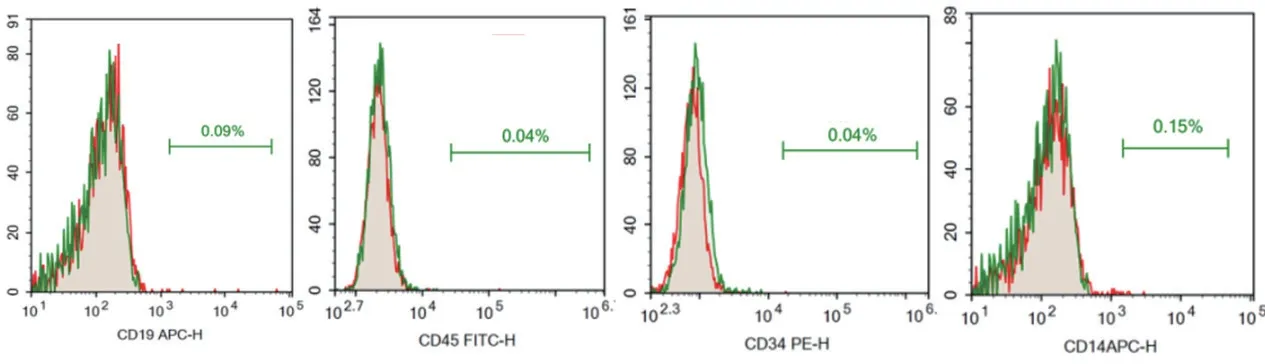
图3 MenSCs表面分子标志物鉴定
2.4 MenSCs成脂诱导分化 经血来源干细胞的成脂诱导分化情况(见图4),利用MSCs诱导培养基定向诱导经血来源的干细胞,结果可见,成脂诱导后,镜下可见透明圆形脂滴亮点,油红O染色为阳性。
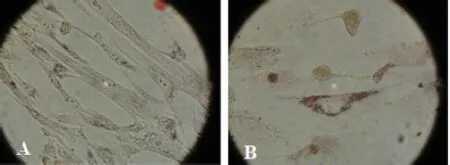
图4 MenSCs成脂分化实验
3 讨论
人类的子宫内膜在女性一生中至少要经历400个增殖、分化和脱落周期,是一种活力强盛不断更新的组织[8]。子宫内膜组织的厚度可在4~10d内从0.5mm增长至5~7mm,其生长水平与表皮、肠上皮及造血系统等高度再生组织中的细胞更替速度相当,甚至更快。在高度再生组织中,成体干细胞通过分化补充损失的细胞,以维持组织的稳态[9]。以上结果表明在子宫内膜中可能存在具有高度增殖分化能力的成体干细胞。2007年Meng等[7]从女性经血中分离得到子宫内膜来源的MSCs,即MenSCs。目前国外研究发现MenSCs具有非常强的自我更新和多向分化能力,在生殖、免疫、心血管、消化和神经等系统和代谢疾病方面具有初步的研究进展[10]。MenSCs来源于经血,可以有规律的不断从同一女性志愿者中获取具有相同遗传背景的MSCs,为MSCs的理论研究和临床应用提供了便利。本研究结果表明,经血经Ficoll密度梯度离心法可以分离得到大量的贴壁生长的纺锤状细胞。生长曲线显示,在经历3d短暂的潜伏期后,其可以迅速进入对数生长期,表明细胞活力强。对分离得到的细胞表面标志物检测结果表明,CD73、CD90和CD105为阳性表面标志物,CD14、CD34、CD45和CD19为阴性表面标记物,CD34、CD45表达阴性表明其为非造血性细胞,与Meng等[7]对MenSCs表面分子标志物检测结果一致,符合MSCs表面分子标志物表达标准。多向分化潜能也是判断MSCs的条件之一,体外诱导分化实验表明本研究分离得到的细胞可向脂肪细胞分化。以上结果符合国际细胞治疗学会提出的MSCs鉴定标准[11],可以判定本研究分离得到的贴壁生长的纺锤状细胞是MenSCs。
综上所述,MenSCs可以从健康女性经血中分离得到,其具有MSCs常规的细胞表面标志物和相应的生物学特性,表明本研究初步成功地建立一种简单可行的MenSCs分离培养方法。MenSCs具有来源广泛、取材方便、无创取材、无伦理道德问题等优点,且增殖迅速,具有多向分化潜能,证明其是开展再生医学和组织工程研究更理想的种子细胞。本研究为下一步利用MenSCs进行人类组织工程学研究奠定了实验基础。

