埃克替尼治疗EGFR突变型晚期NSCLC的疗效
陈海峰
由于空气污染、人口结构日趋老龄化及生存环境恶化,肺癌的发病率呈现逐年上升的趋势,且病死率较高。美国癌症学会发表的2018年全球癌症统计数据[1]结果显示,肺癌新发病例占所有癌症患者的11.6%,占癌症死亡总人数的18.4%。肺癌分为小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC),其中NSCLC约占80%~85%[2]。随着个体化治疗理念的提出与完善,精准治疗正逐步替代传统放化疗,成为基因突变型患者治疗的首选[3]。表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKIs)是其中探索最深入、应用最广泛的小分子靶向药物,疗效显著。本文回顾性分析92例接受埃克替尼治疗的EGFR突变型晚期NSCLC的临床资料,评估其疗效及对营养状况、免疫功能的影响。
1 资料与方法
1.1 临床资料 回顾性分析2015年2月至2017年7月本院收治晚期NSCLC患者92例。男38例,女54例;年龄49~95岁,平均年龄(69.1±9.3)岁。(1)纳入标准:经肺穿刺活检或手术病理检测确诊为NSCLC;经EGFR基因检测,明确为EGFR突变类型;ECOG评分为0~3分;按照美国癌症联合委员会肺癌分期第7版标准,分期为ⅢB或Ⅳ期。(2)排除标准:同时合并其他恶性肿瘤;合并严重胃肠道、心、肺、脑部、肾、血液等系统疾病;具有严重精神性疾病,智力障碍,无正常民事行为能力的患者;正处于哺乳期、妊娠期妇女;依从性差,无法坚持的患者。
1.2 治疗方法 所有患者均口服盐酸埃克替尼片(贝达药业股份有限公司)治疗,125mg/次,3次/d,空腹或与食物同服,服药期间定期监测患者血常规、肝肾功能、尿常规、心电图、血压。一直服用至患者疾病明显进展、或不能耐受不良反应为止。
1.3 观察指标及疗效评价 按照实体肿瘤疗效评价标准(RECIST1.1)评价疗效,分为完全缓解(CR):肿瘤完全消失;部分缓解(PR):肿瘤缩小>30%;疾病稳定(SD):肿瘤缩小<30%,增大<20%;疾病进展(PD):肿瘤增大>20%。客观缓解率(ORR)=(CR+PR)/(CR+PR+SD+PD)×100%。疾病控制率(DCR)=(CR+PR+SD)/(CR+ PR+SD+PD)×100%。
1.4 营养状况检测 治疗4周后,分析并比较两组患者的体重指数(BMI)、白蛋白(ALB)、血红蛋白(Hb)、前白蛋白(PA)4项营养指标。血常规采用迈瑞BC-6800全自动血液细胞分析仪检测。白蛋白、前白蛋白采用贝克曼全自动生化分析仪进行检测。
1.5 免疫功能检测 抽取5ml静脉血置于肝素抗凝管中,4h内检测CD4+、CD8+、CD4+/ CD8+水平。采用BD流式细胞仪进行检测。
1.6 药物不良事件 每1~2个月行血常规、粪、尿常规和生化检查,随访记录毒性反应。根据美国国立癌症研究院通用毒性标准第4版评价不良反应。
1.7 统计学方法 采用SPSS 21.0统计学软件。计量资料以(±s)表示,行t检验;计数资料以%表示,采用χ2检验;采用Kaplan-Meier法计算中位PFS,组间比较采用Log-Rank法。P<0.05为差异有统计学意义。
2 结果
2.1 近期疗效影响因素分析 结果显示总体人群PR占31.5%(29/92),SD占65.2%(60/92),PD占3.3%(3/92)。ORR为31.5%,DCR为96.7%。19外显子缺失突变的患者ORR显著优于21外显子L858错义突变及非经典突变(P<0.05),不吸烟的患者DCR明显优于吸烟患者(P<0.05)。见表1。
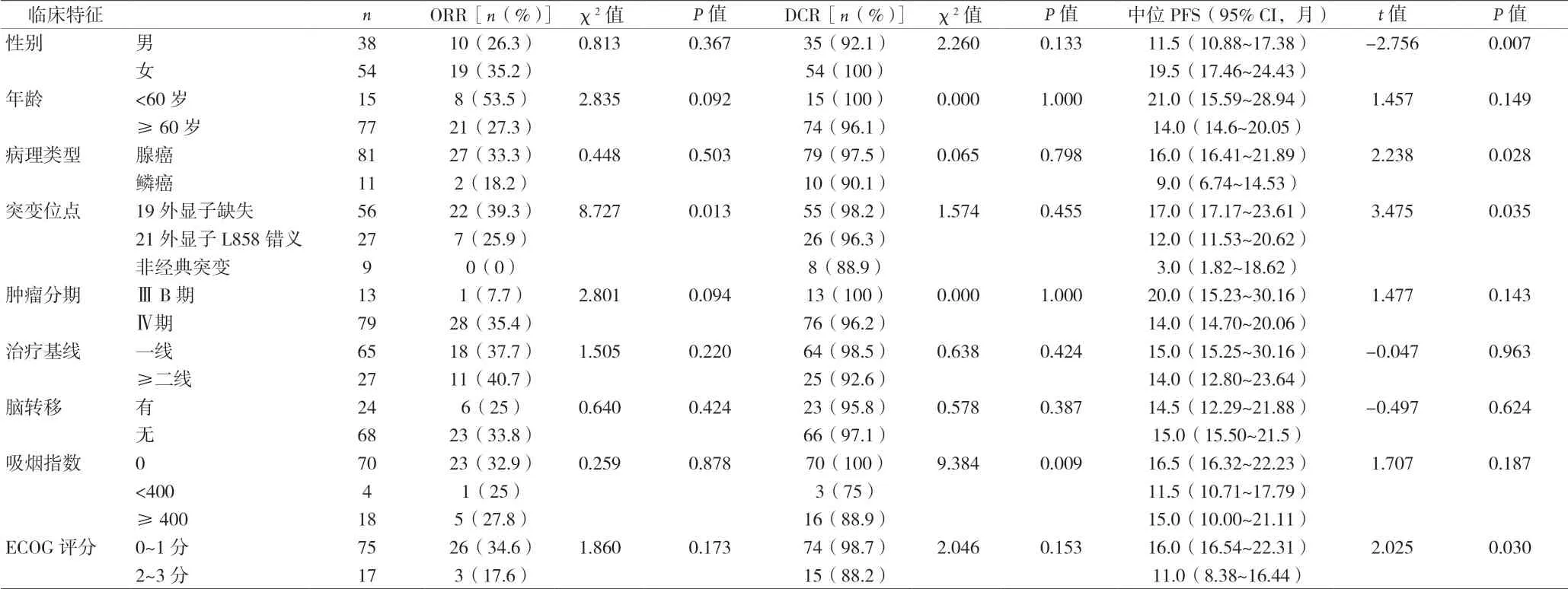
表1 不同临床特征患者治疗效果比较
2.2 远期疗效影响因素分析 91例患者中位无进展生存期(PFS)为14.0个月,女性、腺癌、ECOG评分低的患者中位PFS高于男性、鳞癌、ECOG评分高的患者(P<0.05)。总体人群PFS生存曲线见图1。
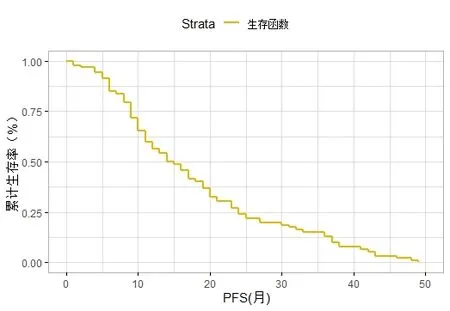
图1 91例埃克替尼治疗EGFR突变型晚期NSCLC患者的PFS生存曲线
2.3 不良反应 入组患者常见不良反应有皮疹、腹泻、肝功能损伤、口腔溃疡、白细胞减少、恶心呕吐、食欲减退、间质性肺炎等,主要为1~2级,对症处理后好转,见表2。
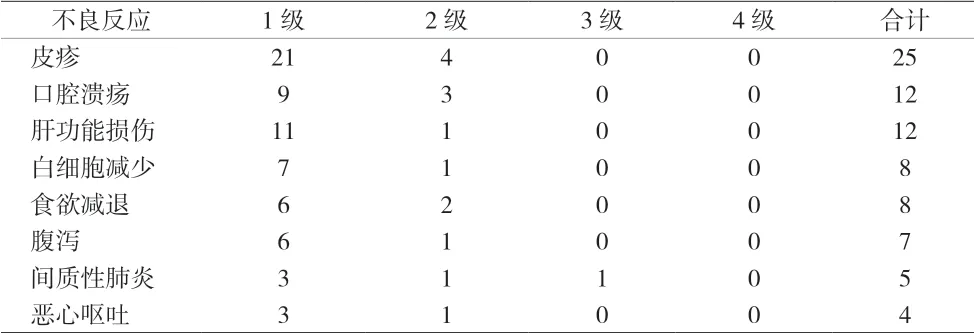
表2 患者治疗期间不良反应(n)
2.4 营养状况 治疗4周后,PR组4项指标均明显升高,与治疗前比差异有统计学意义(P<0.05);SD组患者治疗后4项指标均无变化(P>0.05);PD组患者治疗后4项指标均明显下降,与治疗前比差异有统计学意义(P<0.05)。见表3。
表3 治疗4周后营养指标比较(±s)
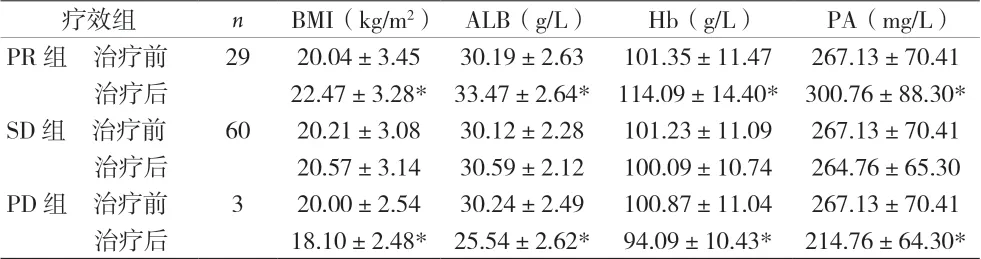
表3 治疗4周后营养指标比较(±s)
注:与治疗前相,*P<0.05
疗效组 n BMI(kg/m2) ALB(g/L) Hb(g/L) PA(mg/L)PR组 治疗前 29 20.04±3.45 30.19±2.63 101.35±11.47 267.13±70.41 治疗后 22.47±3.28* 33.47±2.64* 114.09±14.40* 300.76±88.30*SD组 治疗前 60 20.21±3.08 30.12±2.28 101.23±11.09 267.13±70.41 治疗后 20.57±3.14 30.59±2.12 100.09±10.74 264.76±65.30 PD组 治疗前 3 20.00±2.54 30.24±2.49 100.87±11.04 267.13±70.41 治疗后 18.10±2.48* 25.54±2.62* 94.09±10.43* 214.76±64.30*
2.5 免疫功能 治疗4周后,PR组患者CD4+、CD4+/CD8+水平明显升高,CD8+水平明显降低,与治疗前相比差异有统计学意义(P<0.05);SD组患者治疗后3项指标均无显著变化(P>0.05);PD组患者治疗后CD4+、CD4+/ CD8+水平明显降低,CD8+水平明显升高,与治疗前相比差异有统计学意义(P<0.05)。见表4。
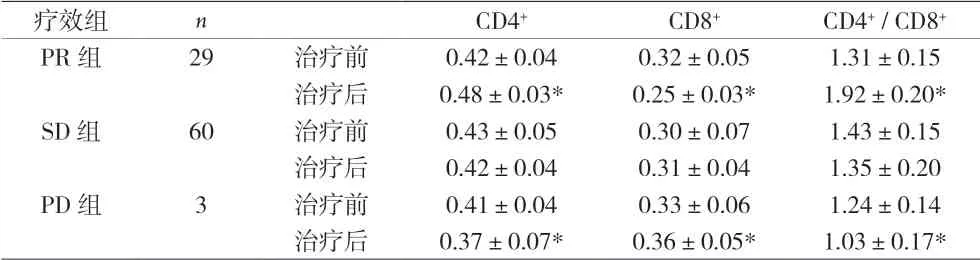
表4 治疗4周后免疫功能比较
3 讨论
肺癌是临床上最为常见且病死率最高的恶性肿瘤。多数患者为NSCLC,约75%患者发现时已为中晚期[4],失去行根治性手术的机会。传统的治疗理念是接受含铂双药细胞毒药物治疗[5],联合或者不联合局部放疗。然而放化疗在杀伤肿瘤组织的同时也会对正常组织和细胞造成损伤,机体T淋巴细胞亚群CD3+、CD4+等水平受到影响,导致机体免疫功能及营养状况下降,不利于放化疗疗效及治疗的延续[6]。
EGFR-TKIs是靶向治疗的代表药物之一。EGFRTKIs对细胞内EGFR酪氨酸激酶区产生作用,有效结合受体K区的ATP位点,使酪氨酸激酶磷酸化及下游传导信号等受到抑制,肿瘤细胞增殖浸润等受到阻断,促进细胞凋亡,最终达到抵抗肿瘤的目的[7]。埃克替尼是我国第一个自主研发的可逆型小分子表皮生长因子受体酪氨酸激酶抑制剂,对于EGFR基因突变阳性患者ORR及PFS均显著优于标准化疗,且不良反应发生率明显低于化疗[8]。本资料结果显示,埃克替尼治疗晚期NSCLC患者具有较好的近期疗效及生存获益,且不良反应少,大部分为轻度不良反应,通过对症处理可改善。
埃克替尼除可直接作用于肿瘤细胞外,还可以通过激活机体自然杀伤(NK)细胞活性,促进巨噬细胞吞噬功能及影响T细胞分类,发挥细胞免疫功能;还能促进白细胞介素2等细胞因子的分泌,有利于发挥体液免疫的作用,使患者获得生存获益[9]。肿瘤的发生和发展与机体免疫功能低下密切相关,而抗肿瘤免疫的机制主要是由T淋巴细胞介导的细胞免疫,通过不同亚群的T细胞调节免疫功能。CD3+CD4+T细胞能够分泌多种细胞因子并启动免疫应答、发挥抗肿瘤作用;而CD3+CD8+T细胞能够抑制细胞免疫功能。当CD4+/CD8+比例降低时,细胞免疫功能受到抑制,从而造成肿瘤细胞发生免疫逃逸[10]。本资料结果显示,PR组患者CD4+、CD4+/CD8+较治疗前明显升高,而CD8+较治疗前明显下降,而PD组则结果相反,SD组结果与治疗前无明显差异,表明埃克替尼能显著改善EGFR突变型晚期NSCLC的免疫功能,同时免疫功能的改善也能促进埃克替尼的抗肿瘤疗效,与既往研究结论一致。本资料结果显示,PR组患者BMI、ALB、Hb、PA 4项指标较治疗前明显升高,而PD组则较治疗前明显下降,SD组结果与治疗前无明显差异。上述结果表明埃克替尼在直接杀伤肿瘤细胞的同时,也能够提高患者的营养状况,间接提高靶向药物的抗肿瘤活性及可耐受性。由于观察时间较短,尚无OS的数据分析,同时也缺乏埃克替尼耐药后免疫功能及营养状况改变的数据,待长期随访后再进行深入探讨。

