十二烷基硫酸钠对三水碳酸镁晶体制备的影响
谭瑞林,王余莲,2,郭 俊,李 闯,2,宛天成,史先飞,王 许
(1.沈阳理工大学 材料科学与工程学院,沈阳 110159; 2.矿物加工科学与技术国家重点实验室,北京 100160;3.东北大学 资源与土木工程学院,沈阳,110819)
三水碳酸镁(MgCO3·3H2O)晶体是一种极具发展前景和应用价值的功能化镁盐材料,因三水碳酸镁热分解温度低、分解时会释放出二氧化碳、水蒸气和氧化镁等难燃性气体和氧化物,故可以作为优良的阻燃材料[1]。此外,由于MgCO3·3H2O晶体缺陷少、强度接近理想晶体,具有极佳的物理化学性能,常作为高聚物的增强和改性材料[2]。
目前,国内外研究者大部分以化学试剂通过共沉淀法制备MgCO3·3H2O,由于化学试剂纯度较高,制备所得产物往往具有纯度高,分散性良好等优点。G.Jauffret等[3]在MgO2-CO2-H2O多相系统中合成了针状MgCO3·3H2O晶体。闫平科等[4]以无水氯化镁和无水碳酸钠为原料制备了束状MgCO3·3H2O晶体,发现表面活性剂L-天门冬氨酸为束状MgCO3·3H2O提供了结晶位点,对束状MgCO3·3H2O的成长具有促进作用。高玉娟等[5-6]以六水氯化镁和碳酸氢铵为原料,采用低温液相法在磷酸二氢钾的辅助下合成出长度达649μm、直径为17.5μm的棒状MgCO3·3H2O;并对MgCO3·3H2O向四水碳酸镁的演变过程进行研究,从晶体结构、晶体稳定性及能量角度阐释演变过程的本质。赵斌等[7]以硫酸镁和碳酸钠为原料合成了MgCO3·3H2O晶体,研究了硫酸镁浓度、硫酸镁和碳酸钠摩尔加料比例、反应时间以及反应温度对产物的影响。王丽等[8]以氨水、氯化镁溶液和二氧化碳为反应体系,利用超重力机合成了平均长度达36μm,直径为1.16μm的MgCO3·3H2O晶体。赵畅等[9]以氯化镁和碳酸钠为原料,在弯曲微通道反应器内成功合成了平均粒径为150μm的MgCO3·3H2O晶体。薛国梁[10]以六水氯化镁和碳酸氢铵为原料,在微波辅助下制备了长度为172μm、长径比达16.86的棒状MgCO3·3H2O。郑亚君等[11]以硝酸镁和碳酸钾为原料,采用共沉淀法合成了不同尺寸大小的MgCO3·3H2O晶体,研究了反应初始溶液搅拌时间对晶体形貌的影响,发现搅拌时间为1~8min时,所得产物由不规则柱状结构逐渐转变为针状结构,平均粒径呈先减小后增大的趋势。
为实现大规模工业化生产,研究者们尝试以天然矿物为原料制备MgCO3·3H2O。王余莲等[12-14]以菱镁矿为原料制备了分散性良好的棒状MgCO3·3H2O,并深入研究了氯化钙、十二烷基硫酸钠及柠檬酸对MgCO3·3H2O晶体制备的影响。Wenjin Ding等[15]通过理论和实验方法评估了由天然滑石合成MgCO3·3H2O的可行性;在氨气作用下,制备出直径约为0.96μm、长度约为19.31μm的MgCO3·3H2O晶体。
综上所述,国内外大多以化学试剂通过共沉淀法合成MgCO3·3H2O。但这种工艺以化学试剂为原料,制备成本较高,且加入沉淀剂后会产生含盐废水,易引发环境污染。而以菱镁矿等天然矿物为镁源制备MgCO3·3H2O晶体则不会引发上述问题。
本研究以菱镁矿为初始原料,运用水化碳酸化法制备MgCO3·3H2O晶须。主要考察重镁水溶液热分解温度,添加剂种类及用量对MgCO3·3H2O晶体制备的影响。研究成果有助于获取更高的产品附加值,对菱镁矿行业的可持续发展具有促进作用。
1 实验
1.1 实验原料
实验原料为高纯度菱镁矿,其XRD图谱如图1所示。
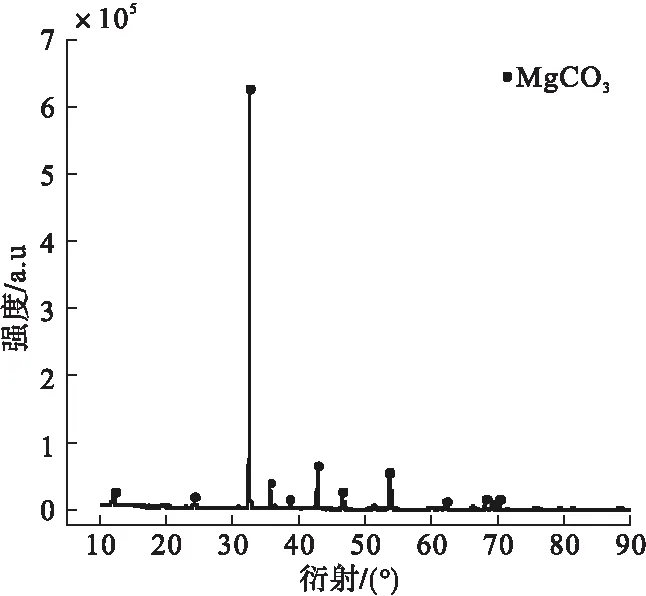
图1 菱镁矿XRD图谱
由图1可知,菱镁矿的XRD图谱基底平滑,衍射峰强度高,半峰宽较小,说明原矿纯度高,符合实验要求。添加剂为分析纯十二烷基硫酸钠(Sodium dalecye sulfact,SDS),CO2气体为工业纯,去离子水自制。
1.2 前驱溶液Mg(HCO3)2制备
将菱镁矿置于750℃的马弗炉中煅烧3.0h,获得轻烧氧化镁后,研磨,经74μm标准筛筛分,称取一定量筛下轻烧氧化镁,使轻烧氧化镁和热水按照1∶40的质量比进行混合。将混合溶液放置在60℃水浴锅中搅拌3.0 h,充分冷却,筛分除杂后得水化溶液。将上述水化溶液置于0℃水浴锅中搅拌,搅拌过程中通入CO2气体,以加速CO2在水化溶液中溶解,利用pH计测定溶液pH值,当pH计读数小于7.5时即为碳化完全,抽滤后滤液即为前驱溶液。
1.3 MgCO3·3H2O晶须制备
使前驱溶液置于温度为40~ 70℃的水浴中,将不同种类的添加剂(氯化镁、十二烷基苯磺酸钠、十二烷基硫酸钠、羧甲基纤维素钠)加入到前驱溶液中,搅拌热解1.0h后过滤,将滤饼洗涤后置于电热鼓风干燥箱中干燥(干燥温度60℃,干燥时间6.0h),即可得到产物。
1.4 表征与测试
利用日本Rigaku Ultima Ⅳ型X-射线衍射仪检测产物的物相,具体参数:CuKα辐射,λ=0.1541nm,固体探测器,管电压40KV,管电流40mA,扫描速度15°/min,扫描角度为5~90°。采用图像分析仪对晶体微观形貌进行表征。
2 结果与讨论
2.1 热解温度对晶体制备的影响
以74μm MgO为初始原料,固定热解时间为60min,热解pH值为7.5,研究热解温度(40~70℃)对MgCO3·3H2O晶体制备的影响。图2和图3分别为热解后所得产物的XRD图谱和显微图像。
由图2可知,40~70℃所得产物的特征峰均与MgCO3·3H2O(标准卡片:JCPDS No.20-0669)所对应的标准峰吻合且无其他杂峰,说明所得产物纯度较高。XRD图谱基底平滑,衍射峰强度高,半峰宽较小,说明40~70℃温度下合成所得产物均为结晶良好的MgCO3·3H2O。这与已有报道[16]不符,可能是由于MgCO3·3H2O向碱式碳酸镁发生晶型转变需要一定时间,而反应时间小于转变时间,从而导致40~70℃所得产物均为MgCO3·3H2O。
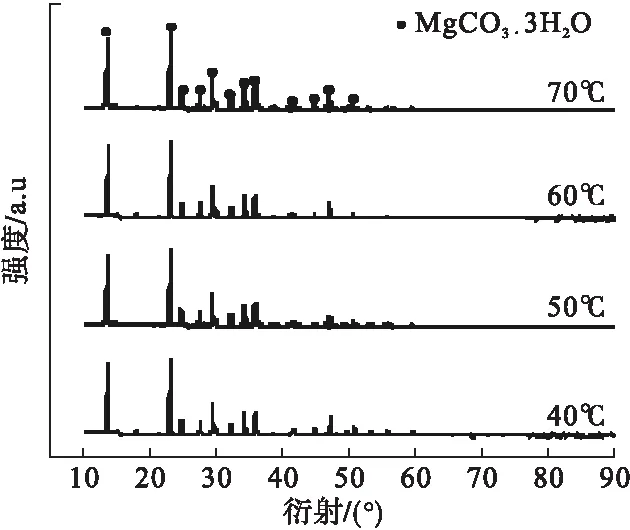
图2 不同热解温度所得产物的XRD图谱

图3 不同热解温度所得产物的显微图像(×100)
由图3可知,热解温度为40℃时,产物中晶体发育不完全,含有少量短晶须,并伴随有团聚现象。当热解温度为50℃时,可获得晶体发育完整且表面光滑的MgCO3·3H2O,同时结合衍射图谱可以看出结晶度良好,其平均粒径为2.6μm,长径比达20~25。热解温度达到60℃时,晶体表面开始溶解,且晶体长径比明显降低。当热解温度为70℃时,晶体数量明显减少且不规则形状晶体增多,这是由于晶体表面溶解速率不同造成的。由上述可知,当Mg(HCO3)2溶液热解温度为40~70℃时,MgCO3·3H2O的晶须长径比在热解温度为50℃时达到最大值25。故本研究将Mg(HCO3)2溶液的热解温度定为50℃。
2.2 添加剂种类对晶体制备的影响
选择氯化镁(MgCl2)、十二烷基苯磺酸钠(SDBS)、十二烷基硫酸钠(SDS)、羧甲基纤维素钠(CMC-Na)作为添加剂,分别加入到前驱溶液中。图4为不同添加剂作用下所得产物的显微图像。

图4 不同添加剂所得产物的显微图像(×400)
图4a为添加MgCl2时获得的MgCO3·3H2O晶须,其形貌不规则,长径比较小。图4b为加入SDBS时获得的棒状MgCO3·3H2O,其平均粒径为3.1μm,长径比达10~20。图4c为添加SDS时获得的MgCO3·3H2O晶须,所得产物分散性良好且粒径均匀,其平均粒径为2.2μm,长径比高达32。图4d为添加CMC-Na时所得产物,大多为粒径较大、长径比较小的棒状晶体,且大多无规则形状。综上所述,当添加SDS时,所得产物分散性良好,且长径比明显高于其他添加剂,这是由于SDS吸附在特定晶面上起粘接作用,有利于MgCO3·3H2O晶须的一维生长.故本研究将SDS定为有效添加剂。
2.3 SDS用量对晶体制备的影响
选取SDS为添加剂,保持其他条件不变,研究SDS的添加量对MgCO3·3H2O晶体制备的影响,利用图像分析仪观察所得产物,如图5所示。
由图5可知,当SDS用量为3.0g/L时,可获得分散性良好,粒径均匀的棒状晶须,其平均粒径为3.0μm,长径比高达37;当用量为5.0g/L时,由于棒状晶须粒径增大导致长径比减小。综上所述,添加SDS制备得到的产物均为高长径比的棒状MgCO3·3H2O,并且在添加量为3.0g/L时长径比达到最大值,故本实验将SDS的最佳添加量定为3.0g/L。

图5 不同SDS用量所得产物的显微图像(×400)
3 结论
(1)当Mg(HCO3)2溶液热分解温度为50℃、添加剂为SDS且添加量为3.0g/L时,可获得平均粒径为3.0μm、长径比高达37、分散性良好的棒状MgCO3·3H2O
(2)添加剂MgCl2和CMC-Na对晶体的形貌有影响;SDS有利于MgCO3·3H2O晶须的一维生长。
(3)当SDS用量为0~5.0g/L时,制备得到的产物均为高长径比的棒状MgCO3·3H2O,且在添加量为3.0g/L时长径比达到最大值。

