合并假性Bartter综合征的儿童囊性纤维化2例
李海燕,朱婷婷,陈敏广,杨宇真,张海邻,胡晓光
(温州医科大学附属第二医院育英儿童医院,浙江 温州 325027,1.儿童呼吸科;2.儿童肾内科)
囊性纤维化(cystic fibrosis,CF)是一种常染色体隐性遗传病,其致病基因是位于第7号染色体长臂上的囊性纤维化跨膜传导调节因子(cystic fibrosis transmembrane conductance regulator,CFTR)。CF患儿婴儿期多表现为生长发育迟缓、脂肪泻及反复呼吸道感染,其中12%~18.8%的患儿可以低钾、低钠、低氯和代谢性碱中毒为首发或主要表现[1-2],但无肾小管病变,故被称为假性Bartter综合征(pseudo-Bartter syndrome,PBS)。PBS可引起惊厥、低血容量和心律失常等,严重者可致死亡,因此需高度重视。现就本院收治的2例早期存在PBS表现的CF患儿病例报告如下,以期提高儿科医师对早期存在PBS但尚未诊断CF患儿的认识。
1 病例资料
病例1:患儿,女,4月龄,因“咳嗽20 d,加重1周”于2017年8月29日收住院。患儿20 d前出现咳 嗽,不剧,无发绀、发热,当地医院抗感染等治疗,咳嗽无缓解。1周前咳嗽加重,至我院呼吸科住院。既往史:无殊。入院体格检查:体温36.7 ℃,心率126次/min,呼吸43次/min,血压80/48 mmHg,体质量5.5 kg。神志清,无鼻翼扇动,无点头呼吸,三凹征(-),咽充血。两肺呼吸音粗,对称,未及干湿性啰音。心腹检查正常。血常规+CRP:CRP 4.00 mg/L,WBC 9.7×109/L,Neu 0.559,Lym 0.356,Hb 123 g/L,PLT 430×109/L。静脉血气分析:pH 7.526,PCO256.3 mmHg,PO233.7 mmHg,HCO3-45.6 mmol/L, BE 19.8 mmol/L。痰培养2次均为铜绿假单胞菌。生化检查:谷丙转氨酶18 U/L,谷草转氨酶25 U/L,总蛋白66.2 g/L,白蛋白44.4 g/L,肌酐21.3 μmol/L, 尿素氮2.11 mmol/L,钠129.8 mmol/L,钾 3.27 mmol/L,氯78.1 mmol/L。抽血同时送检随机尿电解质:尿钠7.4 mmol/L,尿钾 15.86 mmol/L,尿氯1.8 mmol/L。胸部CT示两肺少许斑片状密度增高影(见图1)。入院后诊治过程:两次检测静脉血气及电解质示代谢性碱中毒,并血钠钾氯偏低,予转儿童肾内科。送检基因检测,结果显示存在CFTR基因杂合突变(见图2A):c.1657C>T(母源);c.1766+5G>T(父源),故诊断“CF”。之后患儿门诊随访,现2岁10个月,无反复呼吸道感染表现,生长发育可。
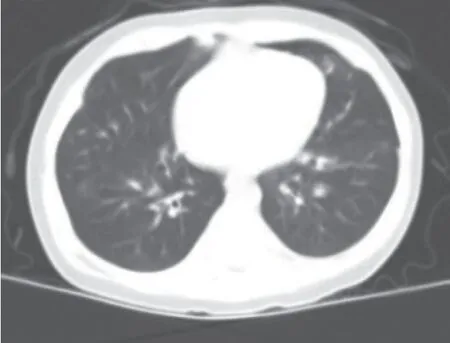
图1 病例1胸部CT示两肺少许斑片状密度增高影
病例2:患儿,男,13岁,因“反复咳嗽、咳痰10年余,加重1周”于2012年8月31日收住院。患者10年余前出现咳嗽,伴咳脓痰,偶有发热,无咯血,曾多次至当地医院就诊,予抗感染治疗好转,但病情反复。2年前曾出现咯血,查肺部CT示两肺支气管扩张伴感染。1周前患儿受凉后出现咳嗽,咳黄脓痰,无咯血,来我院就诊,拟“支气管扩张伴感染”收住。既往史:患儿3岁开始出现反复乏力,不想走路,喜坐、躺。曾住院治疗,发现“低钾血症、低钠血症、低氯血症及代谢性碱中毒”。曾诊断为“周期性麻痹、PBS”。追问病史,曾有血液检查(2007年7月):血钠132.5 mmol/L,血钾3.43 mmol/L,血氯102.4 mmol/L;同时送检尿液示尿钠11.2 mmol/L, 尿钾2.44 mmol/L,尿氯10.7 mmol/L;血气分析:pH 7.56,HCO3-31.9 mmol/L,BE 9.6 mmol/L,Na+134 mmol/L,K+2.31 mmol/L,Cl-91 mmol/L。近5年四肢无力、低钾血症等未发作。
入院体格检查:体温37.2 ℃,心率108次/min,呼吸24次/min,血压106/74 mmHg,体质量36 kg,身高164 cm,BMI:13.4 kg/cm2,营养差,呼吸平稳,无口周发绀,三凹征(-)。两肺可及少许痰鸣音及中小湿啰音。心腹查体未见异常,轻度杵状指。血常规+CRP:CRP 30.4 mg/L,WBC 19.4×109/L,Neu 0.762,Lym 0.163,Hb 143 g/L,PLT 329×109/L。生化检查:谷丙转氨酶14 U/L,谷草转氨酶16 U/L,总蛋白86.3 g/L,白蛋白33.0 g/L,尿素1.93 mmol/L,肌酐53.8 μmol/L,钠136.9 mmol/L,钾3.14 mmol/L,氯100.7 mmol/L。痰及肺泡灌洗液培养均为铜绿假单胞菌。肺部CT:提示两肺支气管扩张伴感染(见图3A-C)。鼻窦CT:上颌窦及筛窦炎(见图3D、E)。入院后诊治过程:入院后予抗感染及对症治疗。基因检测显示CFTR杂合突变(见图2B):c.1657C>T(母源)和c.1408G>A(父源),故诊断为“CF,支气管扩张伴感染”。随访:患儿出院后随访,之后多次因“支气管扩张伴感染”住院。2015年患儿16岁,因“咳嗽、咳痰13余年,加重伴呼吸费力1个月余”住院,床边胸片示:两肺弥漫支气管扩张伴感染(见图3F),诊断“重症肺炎(铜绿假单胞菌感染)、呼吸衰竭”。入科后予气管插管、机械通气及抗感染治疗,病情危重,血气分析示PCO2多次大于115 mmHg,氧饱和度维持欠佳,家属要求放弃治疗,予签字出院后死亡。

图2 CFTR基因突变位点的峰值图
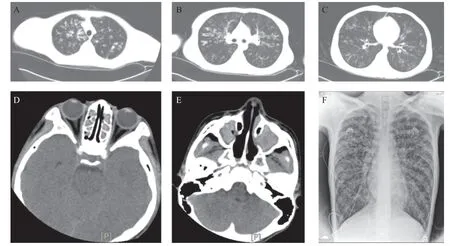
图3 病例2影像图片
2 讨论
迄今为止,中国尚缺乏大样本的CF流行病学资料。由于缺乏对该病的认识,CF常被漏诊或误诊[3]。SHEN等[4]对21例中国CF儿童的分析显示,从发病到最终诊断平均延迟5年,最长竟隔10年余。而CF合并PBS更易被误诊,原因可能有:①缺少CF新生儿期筛查;②CF患儿发生PBS时,常缺少其他CF相关临床表现,或呼吸道、消化道症状轻微而难以早期诊断。事实上,CF合并PBS并不少见,PBS可以是CF的首发或主要表现,也可在疾病发展过程中反复出现[5-6]。YALCIN等[1]报道241例CF患儿中29例存在PBS,对该系列患儿近10年随访,结果显示PBS首次发作中位年龄为4月龄,其中12例反复发作,最后一次PBS发生年龄最大为48月龄。本研究的2例患儿,病例1首次发作在4月龄,和报道一致;病例2首次发现低钾血症、低钠血症在3岁,但亦可能存在3岁前发作未被发现的情况。CF合并PBS患儿CFTR突变位点具有多样性,本研究2例患儿的基因突变,病例1为c.1657C>T/c.1766+5G>T,病例2为c.1657C>T/c.1408G>A,均为含有c.1657C>T的复合杂合突变。国内儿童CF以及CF合并PBS患儿的基因突变类型特点需要更多的病例资料。
关于CF合并PBS的危险因素,FUSTIK等[7]研究指出小婴儿、母乳喂养、CF诊断延迟、中暑以及严重类型的基因突变与CF患者发生低电解质血症、代谢性碱中毒有关。17例发生低钠、低钾、低氯及碱中毒的CF患儿均为母乳喂养,考虑可能和母乳中含盐成分较少,不能弥补患儿在高温环境下大量出汗造成的电解质丢失。此外,KINTU等[8]研究亦认为,CF患者PBS发生的危险因素包括炎热的天气,各种原因引起的体温升高、严重的呼吸道、胰腺疾病或胃肠道疾病(例如呕吐、腹泻)等。本研究病例1患儿为4月龄小婴儿,虽非母乳喂养,但是在7月炎热天气以及呼吸道感染的情况下发现电解质紊乱及酸碱平衡失调;病例2患儿低钾血症、低钠血症亦常在夏天发生。
综上,任何年龄的患者尤其是婴幼儿,若出现生长发育迟缓、低钠、低氯、低钾血症、代谢性碱中毒反复发作,而无法用其他原因如周期性呕吐、先天性失氯性腹泻等疾病解释时,应考虑CF所致的PBS可能,需注意是否存在慢性呼吸道症状或反复呼吸道感染。汗液氯化钠浓度>60 mmol/L及CFTR基因突变是确诊的依据。

