新型丝素蛋白水凝胶携载西咪替丁预防酒精引起的小鼠急性胃溃疡
陈翩翩,黄维洁,沈淑蓉
(温州市中西医结合医院,浙江 温州 325000,1.中药房;2.肿瘤科)
消化性溃疡是一种全球性的常见疾病,而胃溃疡是消化性溃疡中最为常见的类型[1]。胃溃疡的病因复杂,而且为多发病,易反复发作。胃黏膜的急性损伤是胃溃疡发生的重要原因,而针对胃溃疡的治疗主要以口服药物为主。西咪替丁(cimetidine,CMD)为H2受体拮抗剂,能抑制基础和夜间胃酸分泌,也能抑制由组胺、分肽胃泌素、胰岛素和食物等刺激引起的胃酸分泌,并使其酸度降低,对因化学刺激引起的腐蚀性胃炎有预防和保护作用,对应激性胃溃疡和上消化道出血也有明显疗效[2]。但是,胃黏膜黏液的更新、黏膜层的物理保护屏障、酶降解作用等,使得具有治疗潜力的药物不能到达胃黏膜损伤部位,从而降低治疗的有效性,增加全身不良反应。同时,胃排空效应[3]易将治疗药物排空,难以达到有效的原位给药预防治疗效果,极大降低了药物治疗效率,增加了治疗时间。
丝素蛋白(silk fibroin,SF)为一种可降解材料,且生物安全性好,提取于蚕茧[4-5],通过脱胶提取等步骤可得到SF水凝胶。以SF水凝胶为基础的生物黏附型水凝胶携载CMD,将最大限度地发挥高亲和性水凝胶的优势。
针对胃内特殊生理结构特点和黏液屏障,本项目利用安全性高的生物新材料或材料新组合,制备携载CMD的生物黏附水凝胶,构建新型胃溃疡长效预防治疗系统,充分发挥药物与生物材料联合应用对于胃黏膜损伤的高效预防作用。
1 材料和方法
1.1 材料 BMJ-III型病理组织包埋机(常州中威电子仪器有限公司);旋转型石蜡切片机(珊顿,英国);酶标仪(BioTek,美国);ECLIPSE NI正置荧光显微镜(尼康,日本);Ti-E&A1 plus激光共聚焦显微镜(尼康,日本);扫描电子显微镜(日立,日本);超声细胞破碎仪(Branson,美国)。CMD(上海阿拉丁生化科技股份有限公司,纯度99%);SOD和MDA试剂盒(南京建成生物科技有限公司);阿利新蓝-过碘酸-雪夫染色试剂盒(北京索莱宝生物科技有限公司)。
1.2 方法
1.2.1 CMD-SF水凝胶的制备:SF水溶液制备方法参考PIKULA等[6]的制备步骤。首先,剪开蚕茧,使其成碎片状,称取10 g蚕茧碎片,加入1 L 0.02 mol/L Na2CO3溶液,在100℃下煮沸1.5 h,期间更换Na2CO3溶液1次,后用蒸馏水反复冲洗,以去除丝胶蛋白,再放入烘箱干燥。烘干后,将脱胶的蚕丝纤维放入9.3 mol/L LiBr溶液中3 h,期间保持60℃恒温水浴。最后,通过离心和过滤之后,将溶液放入透析袋中,透析3 d,以去除残留的盐溶液。提取的SF溶液的最后浓度约等于1.5 wt%,放于4 ℃备用。取5 mL SF溶液,混入1 g CMD,混合均匀之后,进行超声处理,诱导CMD-SF溶液相变为CMD-SF水凝胶[7](20%的振幅,共作用30 s,10 s作用,10 s间隙)。
1.2.2 CMD-SF水凝胶形态学表征:取适量CMD-SF溶液和CMD-SF水凝胶样品,用液氮迅速冷冻至固态,放到冷冻干燥机中冻干48 h,呈白色粉状,将其固定于导电片上,喷金后用扫描电镜观察样品的结构与形态。同时进行FT-IR分析检测判别CMD-SF的成胶状态,光谱通过Excalibur Series收集,64次扫描,分辨率为4 cm-1[8]。
1.2.3 CMD-SF水凝胶的体外缓释:通过动态透析方法检测CMD-SF水凝胶体系对CMD的缓释效果。首先,将CMD溶液、CMD-SF溶液以及CMD-SF水凝胶样品分别放入透析袋中(MW,100 kDa),将透析袋放入装有50 mL pH为7.4的PBS溶液的离心管中,接着将离心管放入37℃恒温水浴摇床上,每个时间点取0.5 mL外界溶液,再保存在-80℃超低温冰箱,在收集完最后一个时间点后,用紫外分光光度仪于波长218 nm波长处测定吸收度,根据标准曲线方程计算释放液中的CMD浓度。累计释放率=(上清液的CMD含量/原始CMD含量)×100%。
1.2.4 急性胃溃疡模型的构建与动物分组:C57BL/6雄性小鼠32只,8周龄,由上海斯莱克实验动物中心提供,在温州医科大学动物实验中心分笼饲养,饲养室的室温维持在(23±2)℃,湿度35%~60%,自然光照,自由饮食。适应性饲养1周后随机分为4组,即对照组、CMD组、CMD-SF溶液组、CMDSF水凝胶组。于造模前3 d给予各组药物进行预防治疗,CMD组、CMD-SF溶液组以及CMD-SF水凝胶组灌服剂量为每天4 mL/kg,连续灌胃3 d,对照组灌服同等容积的0.9%氯化钠溶液。于最后一次灌胃后禁食24 h,各组小鼠按15 mL/kg剂量灌胃无水酒精[9],灌胃1 h后,致急性酒精性胃溃疡模型。
1.2.5 原位灌胃CMD-SF水凝胶对急性胃溃疡模型动物的预防效果:标本采集:无水酒精灌胃1 h后,处死动物,摘取全胃,沿胃大弯对半剪开,用0.9%氯化钠溶液洗净,将胃组织摊平,摆上标尺,在同样的高度、视野、倍数下快速拍照记录。然后,将一半组织平摊在锡箔纸上,浸泡于10%甲醛溶液中固定,用于组织学评价,另一半组织移入-80℃冰箱中保存,待匀浆。胃组织中SOD、MDA检测:按照MDA、SOD试剂盒的检测步骤对采集得到的各组小鼠胃组织中SOD、MDA的含量进行检测。组织学评价:固定好的胃组织进行脱水,石蜡包埋,制备成5 μm切片,分别进行HE染色观察胃组织形态学、PAS染色观察胃黏膜的损伤情况和caspase3免疫组化染色观察胃的细胞凋亡情况。用光学显微镜观察,根据前期实验[1]的组织学损伤评分标准对间质水肿(评分0~3)、出血损伤(评分0~3)和炎症细胞的存在(评分0~3)进行评分。
1.3 统计学处理方法 采用GraphPad Prism5软件进行统计学分析。计量数据以±s表示,多组比较采用单因素方差分析,采用Dunnett’st检验进行多重比较。P<0.05为差异有统计学意义。
2 结果
2.1 CMD-SF水凝胶的特征 为了验证CMD-SF水凝胶的成胶状态,将制备得到的CMD-SF溶液和CMDSF水凝胶分别进行了扫描电镜成像观察显微结构,CMD-SF溶液(见图1a)呈细长水滴状杂乱排列,而CMD-SF水凝胶则呈扁片状(见图1b),扫描电镜成像结果与文献报道[10-11]相同,说明CMD-SF水凝胶制备成功。通过FT-IR检测CMD-SF水凝胶成胶状况。SF在溶液状和凝胶状下,有着不同的二级结构,主要体现在SF溶液中有1 660、1 540和1 235 cm-1的特征峰,该特征峰为α-螺旋结构的特征峰,而SF凝胶中有1 630和1 530 cm-1的特征峰,该特征峰为 β-折叠结构的特征峰[12]。从图1c可知,经过超声处理后CMD-SF的特征峰为1 630和1 526 cm-1,具有 β-折叠的特征,而未经超声处理的CMD-SF的特征峰为1 650和1 545 cm-1,具有α-螺旋的特征。此结果进一步确认,本实验的超声处理能够诱导CMD-SF溶液向CMD-SF水凝胶转变。
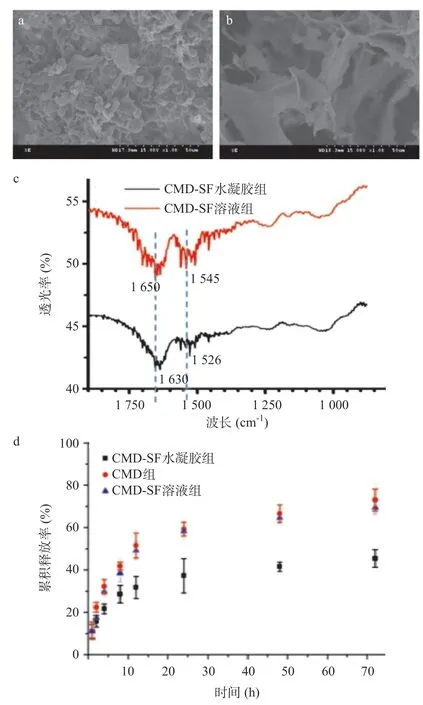
图1 CMD-SF水凝胶的特征
2.2 CMD-SF水凝胶的缓释 由图1d可见,在12 h时,CMD溶液的累计释放量约为51.6%,CMD-SF溶液的累计释放量约为49.2%,与CMD溶液几乎没有差别;而CMD-SF水凝胶的累计释放量约为31.7%,72 h时,CMD溶液的累计释放量约为73.0%,CMD-SF溶液的累计释放量与单纯CMD的累积释放量几乎没有差别,而CMD-SF水凝胶的累计释放量约为45.4%,以上结果说明单纯的SF溶液并不能有效稳定CMD,而成胶后的SF能有效稳定CMD的释放,达到缓释的效果,从而延长CMD的作用。
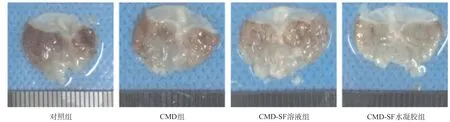
图2 4组胃组织宏观评价
2.3 CMD-SF水凝胶能有效预防酒精引起的急性胃溃疡通过各组组织样本可以看出,给予CMD-SF水凝胶预防治疗,能有效减少胃出血、溃疡的发生,并且预防效果高于CMD组和CMD-SF溶液组(见图2)。对照组(见图3a)的小鼠胃组织的黏膜层破损,腺体排列紊乱且形态变异,黏膜下层存在较多炎症细胞浸润。CMD-SF水凝胶组(见图3d)黏膜层较为完整,腺体排列较为规整,黏膜下层几乎未见炎症细胞浸润,优于CMD组(见图3b)和CMD-SF溶液组(见图3c)的预防效果。CMD-SF水凝胶(见图3h)预防治疗后胃组织周边黏膜PAS染色阳性的中性黏液面积相较于对照组(见图3e)明显增加,说明CMD-SF水凝胶能有效缓解由酒精引起的黏膜糖蛋白的损失,能有效预防胃溃疡的发生,而未成胶的SF溶液并不能提高CMD的治疗效果。胃组织损伤评分见图4,与对照组相比,治疗组组织学损伤评分有所下降,尤其是CMD-SF水凝胶组(P<0.01),能有效降低出血、减少炎症细胞浸润以及减轻间隙水肿,而CMD组 (P<0.01)和CMD-SF溶液组(P<0.01)的组织学损伤评分改善没有CMD-SF水凝胶组显著。各组胃组织样本的PAS染色中的中性黏液水平结果示,与对照组比,CMD-SF水凝胶组的中性黏液水平显著提高(P<0.01),而CMD组和CMD-SF溶液组差异无统计学意义(P>0.05),同时CMD组和CMD-SF溶液组之间几乎没有差别,说明SF溶液并不能提高CMD的治疗效果。
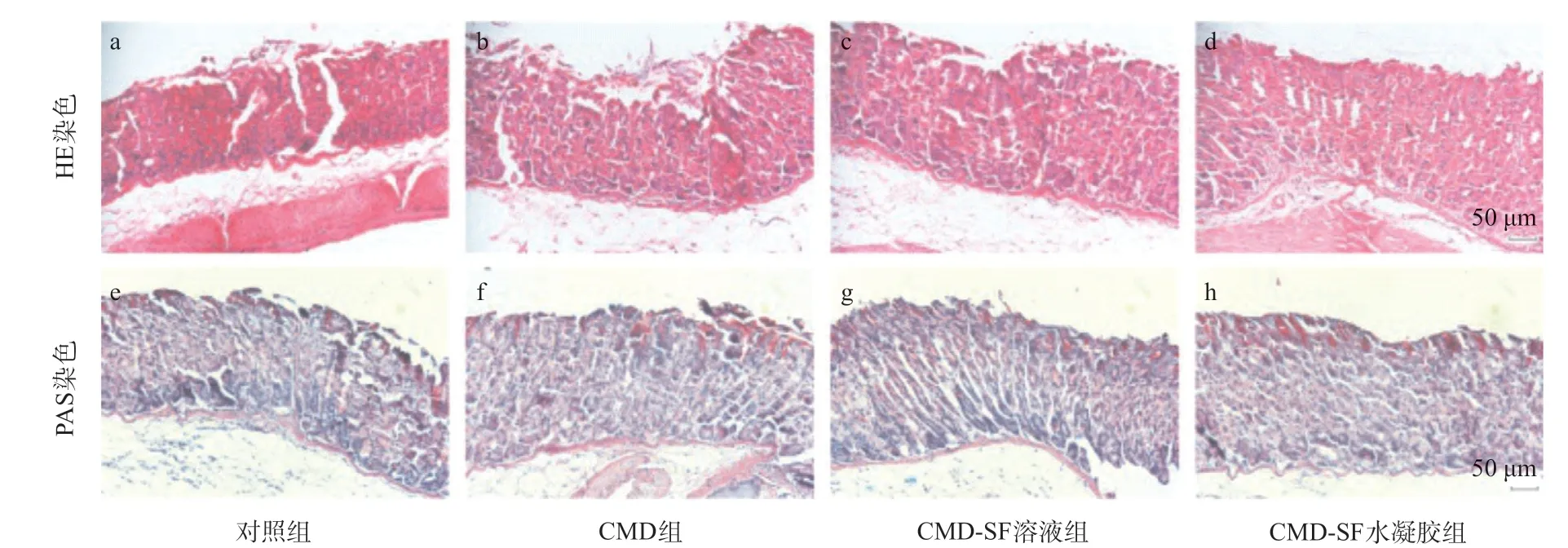
图3 4组胃组织病理染色
2.4 CMD-SF水凝胶有效预防细胞凋亡减少胃黏膜损伤 大量摄入酒精会严重损伤胃黏膜,导致细胞凋亡[13],从图5的caspase3免疫组化染色结果可以看出,相较于对照组,给予CMD-SF水凝胶,能有效降低caspase3的表达量,而给予CMD-SF溶液和CMD溶液,caspase3的表达量较对照组下降。值得注意的是,与CMD-SF水凝胶组相比,CMD-SF溶液与单纯CMD溶液的预防效果差异有统计学意义,说明未成凝胶的SF溶液并不能提高CMD的预防效果。免疫印迹实验结果表明,对照组的caspase3表达水平最高,而给予CMD-SF水凝胶治疗后caspase3水平显著下降(P<0.01),CMD组和CMD-SF溶液组差异无统计学意义。相较于CMD-SF水凝胶,CMD组和CMD-SF溶液组的caspase3表达水平差异有统计学意义(P<0.01)。
2.5 CMD-SF水凝胶通过抑制氧化应激反应来防止胃溃疡发生 酒精会导致胃组织中的MDA水平提高,SOD水平下降[14],而通过给予CMD-SF水凝胶预防治疗后,相对于对照组,CMD-SF水凝胶能有效提高胃组织中SOD水平(P<0.01),而CMD组和CMD-SF溶液组与对照组比差异无统计学意义(P>0.05)。相对于对照组,CMD-SF水凝胶能有效降低胃组织中MDA水平(P<0.05),而CMD组和CMD-SF溶液组与对照组差异无统计学意义(P>0.05)。可以得出CMD-SF溶液的预防效果等同于单纯的CMD溶液,说明未成凝胶状的SF并不能协助CMD有效停留于胃黏膜处发挥长效的预防作用。
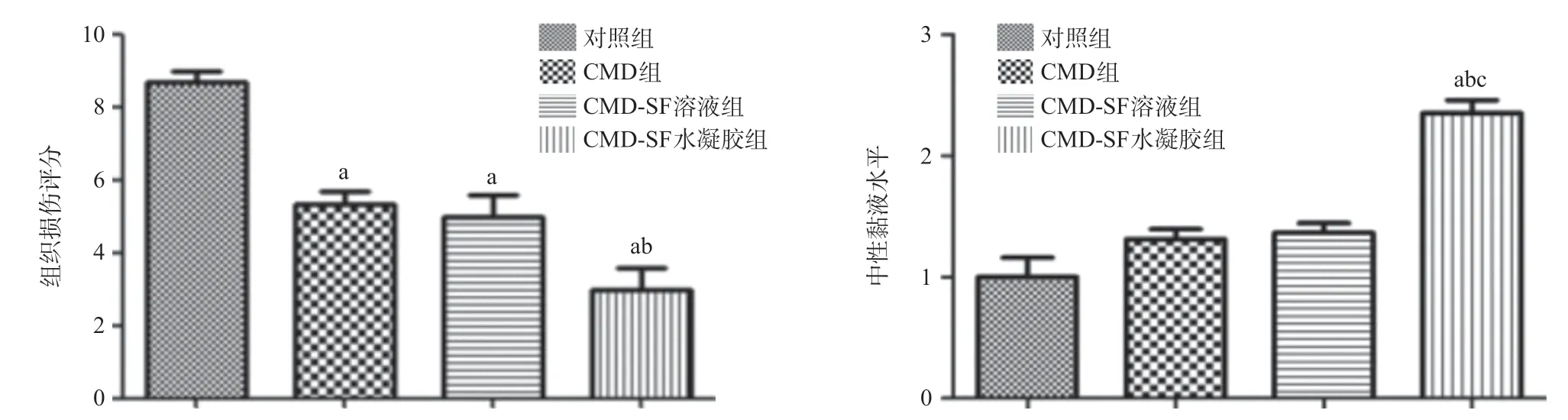
图4 4组胃组织损伤评分和中性黏液水平
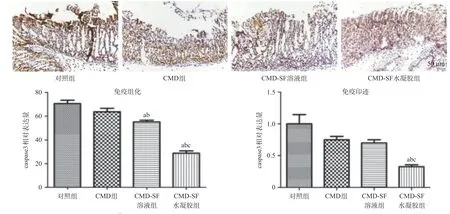
图5 4组胃组织caspase3蛋白表达
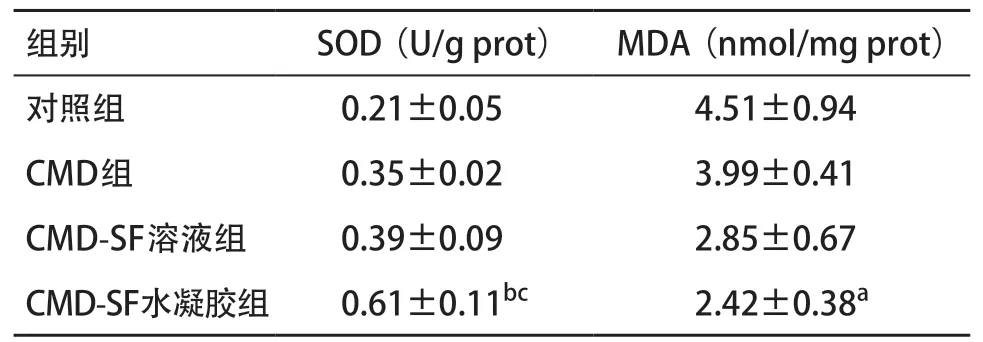
表1 CMD-SF水凝胶对小鼠胃组织中SOD和MDA含量的影响(n=8)
3 讨论
由酒精引起的急性胃溃疡的发病率越来越高,且重症患者多伴有出血、穿孔等并发症,若不及时治疗会导致严重后果[15]。应激性胃溃疡发病机制主要为胃酸过多、幽门螺杆菌感染、胃黏膜保护机制遭到破坏,胃黏膜血流供应不足,胃酸侵蚀性增加,从而引起急性胃溃疡[16]。CMD是临床治疗胃溃疡的常用药,但是单纯的CMD药物不能有效停留在胃黏膜表面发挥长效的预防治疗作用。生物材料作为一种新兴的手段,可以作为药物载体,发挥其携载、缓释、靶向等不同作用。在众多生物材料中,SF作为天然蛋白,有着高生物相容性,有利于细胞黏附和伸展,同时易提取且价格低等优点在生物医学领域备受青睐[17]。
本研究采用碱提取法获得SF溶液,再通过超声处理获得SF水凝胶[8,11]。通过扫描电镜观察制备得到的SF水凝胶的显微结构,同时通过FT-IR检测进一步确认SF溶液向水凝胶转变成功。我们还利用C57BL/6小鼠构建胃溃疡模型,应用CMD-SF水凝胶进行预防给药,观察对急性胃溃疡的预防作用。结果表明,给予CMD-SF水凝胶预防能有效减少胃组织出血和溃疡的发生。HE染色结果也说明,CMD-SF水凝胶的预防作用明显好于CMD-SF溶液组和CMD溶液组,能有效保持黏膜层完整,腺体排列也较为规整,炎症细胞浸润减少。PAS染色也表明CMD-SF水凝胶能有效缓解黏膜糖蛋白的减少。Caspase3免疫组化染色结果证明,CMD-SF水凝胶能有效减少急性损伤的胃组织的细胞凋亡,有着良好的预防损伤作用。
现已证实,胃肠黏膜在化学物质、缺血或细胞能量不足等情况下会产生大量的氧自由基。氧自由基在整体水平和细胞水平都可以引起胃黏膜或黏膜细胞的脂质过氧化,导致胃黏膜血流障碍,引发胃黏膜损伤[18]。MDA是脂质过氧化物,可引起蛋白质变性和交联,损害细胞及细胞膜,反映了体内脂质过氧化的程度,并间接反映机体细胞受自由基攻击的严重性,进而反映细胞损伤的程度[9]。SOD是存在于生物体内的一种抗氧化酶,能降低酒精引起的胃黏膜损伤,对酒精性胃溃疡起到了一定的保护作用[19-20]。CMD-SF水凝胶能有效降低血中和胃组织中MDA水平和提高SOD水平,从而缓解了氧化应激反应,防止胃溃疡的发生。
综上,CMD-SF水凝胶能有效预防酒精引起的急性胃溃疡的发生,可作为一种理想的预防胃溃疡的载药体系,主要是它能有效地黏附在胃黏膜表面,延长CMD的作用时间,从而增强其预防治疗胃溃疡的作用。

