基于氧化还原反应界面可视化定量检测辣根过氧化物酶
孔 昊,张 强,张 薇,刘伟文,曹成喜*,樊柳荫
(1.上海交通大学学生创新中心,上海 200240;2.上海交通大学生命科学技术学院,上海 200240;3.上海交通大学电子信息与电气工程学院,上海 200240)
辣根过氧化物酶(HRP)是一种重要的工具酶,被广泛用于开发基于酶联免疫吸附实验[1]、酶联适配体检测实验[2]以及其他基于酶催化反应[3]的生化检测方法。同时,纳米酶[4]、核酸过氧化物模拟酶[5]等具有HRP催化活性的物质亦被广泛地用于开发生化分析方法。因此,开发检测HRP的方法具有非常重要的意义。目前,HRP检测方法主要基于光学检测[1-5]以及电化学检测[6-8]等方法进行检测。这些方法依赖于昂贵、精密的仪器实现定量检测,对于实验环境、检测成本有着较高要求,难以用于即时检测,不易在条件受限地区推广应用。
电泳滴定(electrophoresis titration,ET)是一种基于移动反应界面原理的可视化检测方法,最初被用来对食品中蛋白质总量进行特异性检测[9,10]。近年来,随着检测模型以及芯片技术的开发,电泳滴定摆脱了传统电泳装置,实现了芯片化,并已成功用于乳制品中三聚氰胺及尿液中疾病标志物的现场检测[11,12]。本文在上述研究基础上,对隐色结晶紫(LCV)显色体系与3,3′,5,5′-四甲基联苯胺(TMB)显色体系在HRP催化显色过程中的显色效率进行了比较,以TMB显色体系建立了基于氧化还原反应界面移动距离的可视化定量测定HRP的方法。该方法直观、简单、操作成本低,不需要光学检测设备即可实现HRP的裸眼检测,对于具有HRP活性的物质进行酶活测定或基于酶反应的生物标志物的检测具有潜在的应用价值。
1 实验部分
1.1 仪器、试剂与材料
1.1.1仪器
PE&ENSPIRE 2300酶标仪(珀金埃尔默,美国)。
电泳滴定检测芯片由聚甲基丙烯酸甲酯材料加工,结构如图1所示,由阳极池(φ6 mm×5 mm)、桥接通道(5 mm×0.5 mm×0.5 mm)、样品池(φ6 mm×5 mm)、滴定通道(10 mm×0.5 mm×0.5 mm)、阴极池(φ6 mm×5 mm)组成。将显色液加入样品池中进行电泳滴定检测。电源由36 V锂电池组提供。
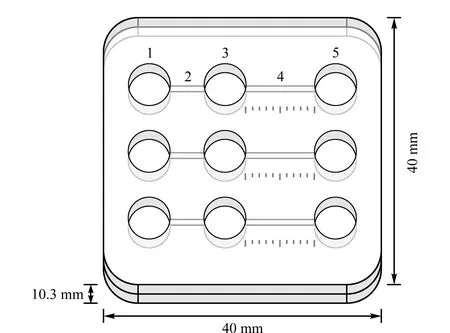
图1 电泳滴定芯片结构Fig.1 Structure of electrophoresis titration (ET)chip 1.anode well;2.bridge channel;3.sample well;4.titration channel;5.cathode well.
1.1.2实验试剂
HRP(RZ(Reinheit Zahl)>3.0,>300 units/mg,麦克林,中国);EL-TMB显色试剂盒(生工生物工程,中国);西班牙琼脂糖(agarose G-10,Biowest,法国);氯化钾(KCl,纯度99.5%)、过氧化氢溶液(H2O2,质量分数30%)、甲醇(CH3OH,纯度≥99.5%)、LCV(纯度98%)、氢氧化钠(NaOH,纯度96%)、3,3′,5,5′-四甲基联苯胺盐酸盐(TMB·2HCl,纯度98%)(麦克林,中国);盐酸(HCl,质量分数36.0%~38.0%);L-抗坏血酸(L-ascorbic acid,AA,纯度≥99.7%)(国药,中国)。
1.1.3溶液配制
LCV溶液:称量0.018 7 g LCV固体,用甲醇溶解并定容至50 mL,得到浓度为1 mmol/L的LCV溶液。
TMB·2HCl溶液:称量0.094 0 g TMB·2HCl固体,用超纯水溶解并定容至10 mL,得到浓度为30 mmol/L的TMB·2HCl溶液。
LCV显色液:组分为1.67 mmol/L KCl、0.167 mmol/L H2O2和0.25 mmol/L LCV。
TMB显色液:组分为1.67 mmol/L KCl、0.167 mmol/L H2O2和0.25 mmol/L TMB·2HCl。
EL-TMB显色液:按照EL-TMB试剂盒说明书配制。
1.2 实验原理
1.2.1LCV显色体系电泳滴定检测原理
基于LCV的HRP催化显色体系常被用来对过氧化氢进行检测。HRP能够催化H2O2分解并进一步氧化无色LCV,生成蓝紫色带正电荷的结晶紫离子(CV+):
(1)
体系中HRP浓度越高,一定时间内反应生成CV+的速度越快。在滴定通道中,CV+与凝胶中的OH-发生反应,生成无色、不带电荷的CV-OH伯醇分子(见图2a):

(2)
通道中OH-浓度一定时,界面迁移速度由CV+浓度决定,故可通过对界面迁移距离进行测定,实现HRP定量检测。
1.2.2TMB显色体系电泳滴定检测原理
基于TMB的HRP催化显色体系被广泛应用于基于HRP的生化检测之中[1,2,4]。HRP能够催化H2O2分解并进一步氧化无色TMB,生成蓝色带正电荷的TMB阳离子(TMB·+):
(3)
体系中HRP浓度越高,一定时间内反应生成TMB·+的速度越快。由于TMB·+在酸性或碱性条件下会生成颜色以及电荷性质不同的衍生产物、对检测以及结果判断带来干扰,用OH-对其进行滴定时难以判断界面位置,故采用氧化还原反应对其进行电泳滴定。在滴定通道中,TMB·+与凝胶中的AA发生氧化还原反应,被还原为无色的TMB[13](见图2b):

(4)
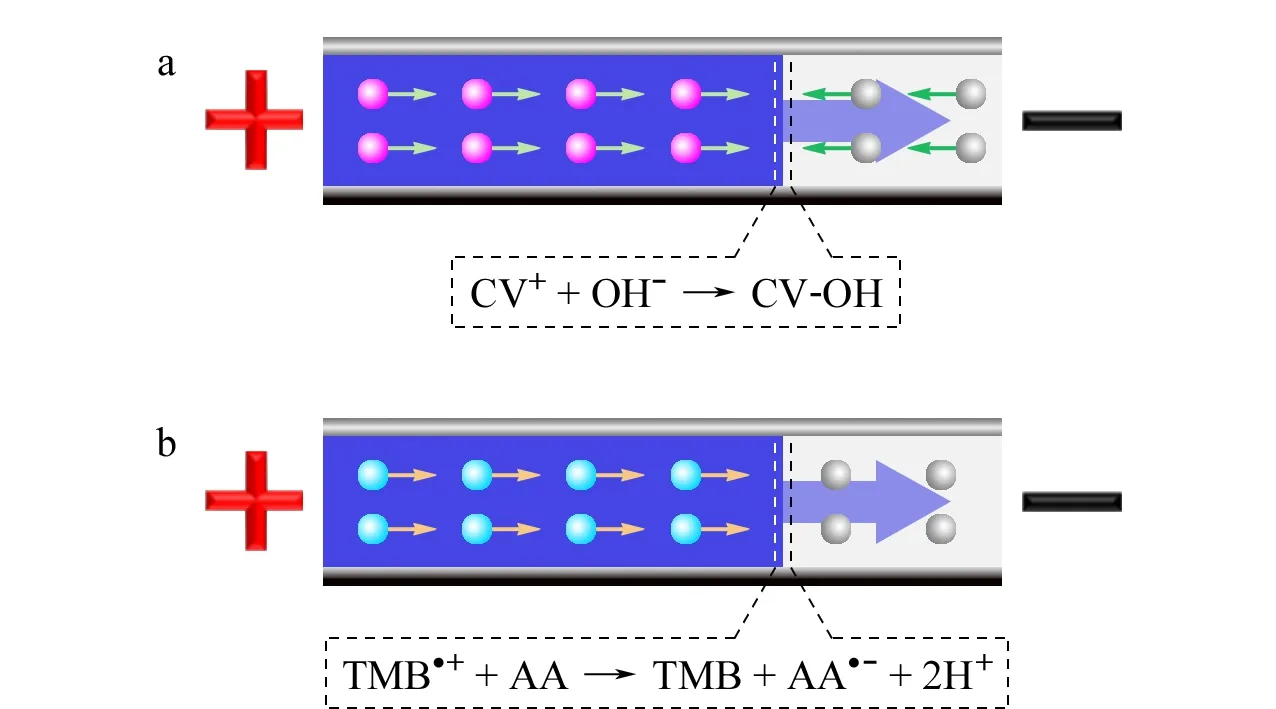
图2 基于(a)LCV显色体系和(b)TMB显色体系的电泳滴定模型Fig.2 ET models based on (a)leucocrystal violet (LCV)chromogenic system and (b)3,3′,5,5′-tetramethyl-benzidine (TMB)chromogenic system CV+:crystal violet cation;CV-OH:crystal violet carbinol;TMB·+:3,3′,5,5′-tetramethyl benzidine radical cation;TMB:3,3′,5,5′-tetramethyl benzidine;AA:L-ascorbic acid;AA·-:L-ascorbic acid radical anion.The symbols “+” and “-” indicate anode and cathode,respectively.
产物AA·-不与TMB或TMB·+发生反应。通道中AA浓度一定时,界面迁移速度由TMB·+浓度决定,故可通过对界面迁移距离进行测定,实现HRP定量检测。
1.3 实验条件
1.3.1显色体系显色效率比较步骤
分别在100 μL LCV显色液、TMB显色液和EL-TMB显色液中加入10 μL不同浓度的HRP溶液,常温避光反应4 min,用酶标仪读取590 nm(LCV显色液)与652 nm(TMB显色液与EL-TMB显色液)的吸光度数值。
1.3.2TMB显色体系电泳滴定检测HRP实验条件和步骤
在100 μL EL-TMB显色液中加入不同浓度HRP,25 ℃下催化显色5 min,并对显色液进行4 min电泳滴定检测。滴定通道凝胶:40 mmol/L KCl、0.1 mmol/L AA和1%(1 g/100 mL,下同)琼脂糖凝胶。桥接通道凝胶:40 mmol/L KCl和1%琼脂糖凝胶。阳极液:40 mmol/L NaOH。阴极液:40 mmol/L HCl和0.1 mmol/L AA。滴定电压:36 V。每隔30 s记录界面迁移距离,计算界面迁移速度。
2 结果与讨论
2.1 LCV与TMB显色体系显色效率的对比
首先,比较了LCV显色液、TMB显色液与EL-TMB显色液在HRP催化条件下的显色效率差异。LCV显色液的显色产物为CV+(λmax≈590 nm),而TMB与EL-TMB显色液的显色产物为TMB·+(λmax≈652 nm)。结果如图3所示,在相同的反应条件下,TMB显色液在显色效率上相较于LCV显色液约有两个数量级的优势。同时,相较于TMB显色液,反应条件经过优化的EL-TMB显色液有着更高的显色效率。两种显色体系在显色效率上的差异主要可归结于以下原因:首先,针对不同的显色反应底物,HRP有着不同的催化显色效率,作为常用的HRP显色底物之一,TMB相较于LCV有着更高的催化显色效率;其次,LCV难溶于水而在甲醇中溶解度较高,甲醇等溶剂将影响HRP催化效率[14],从而影响检测灵敏度;同时,用LCV溶液配制显色液时,可观察到LCV从溶液中析出(见图3中LCV显色体系较高的吸光度背景信号),这导致HRP催化LCV显色液时,溶液中LCV的实际浓度低于理论浓度。上述因素共同作用导致了两种显色体系在显色效率上的差异。基于其在显色效率的优势,本试验选择EL-TMB显色液构建后续电泳滴定检测方法。
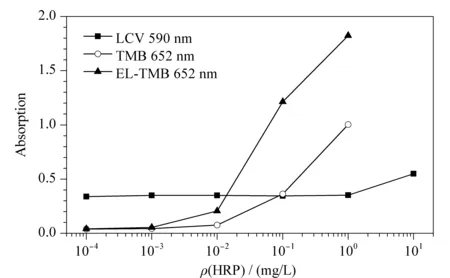
图3 LCV、TMB、EL-TMB显色液在HRP催化反应中显色效率比较Fig.3 Comparison of the chromogenic efficiencies between LCV,TMB,and EL-TMB chromogenic solutions under horseradish peroxidase (HRP)catalysis Experimental conditions:chromogenic reaction for 4 min at 25 ℃.
2.2 电泳滴定检测HRP方法验证
以EL-TMB试剂盒构建TMB显色体系建立电泳滴定检测体系对HRP进行检测,试验现象如图4所示。当滴定通道两侧未通电时(t0),样品池中TMB·+不会扩散进入滴定通道。当向滴定通道施加电压时,样品池中的TMB·+受电场作用进入滴定通道中分别与凝胶中的AA发生反应,产生肉眼可见的反应界面(t1)。随着电泳滴定的进行,界面继续向阴极方向迁移(t2)。试验现象符合1.2.2节以及图1中对电泳滴定检测原理的描述。
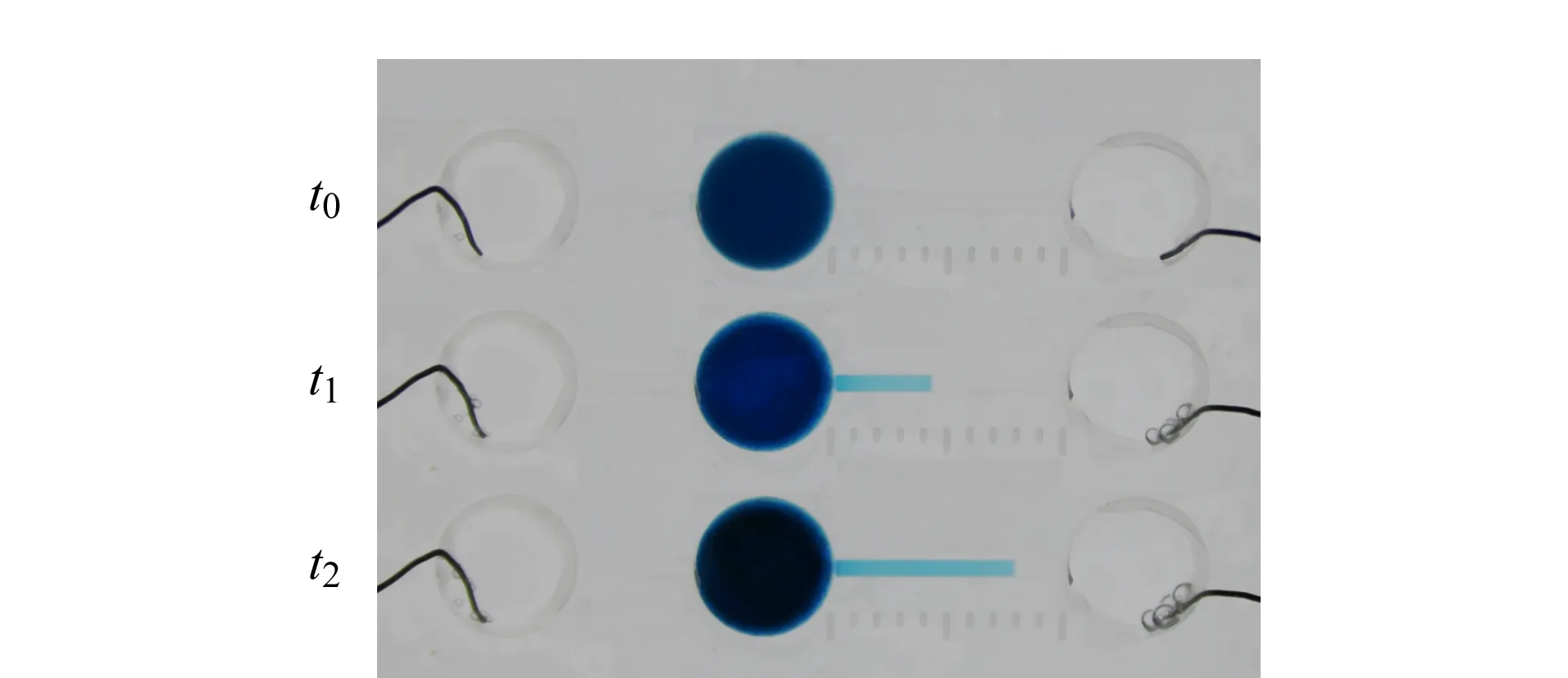
图4 基于TMB显色体系的电泳滴定界面迁移照片Fig.4 Images of boundary motion during ET based on TMB chromogenic system Experimental conditions:0.1 mmol/L AA and 40 mmol/L KCl in 1% (1 g/100 mL)agarose gel-filled titration channel;40 mmol/L KCl in 1% (1 g/100 mL)agarose gel-filled bridge channel;40 mmol/L NaOH as anolyte;0.1 mmol/L AA and 40 mmol/L HCl as catholyte;0.073 mg/L HRP in chromogenic solution;operating voltage as 36 V;ET running for 4 min.Photos were acquired before ET running (t0),and after ET running for 2 min (t1)and 4 min (t2).
2.3 滴定通道凝胶中离子强度对检测的影响
电泳通道中的离子强度会对电泳滴定的检测效果带来显著的影响。通过改变滴定通道凝胶中KCl浓度来调节电泳通道中的离子强度,并观察电泳滴定过程中界面的稳定性。试验现象见图5a。当凝胶中的KCl浓度较低(10 mmol/L)时,界面迁移速度较慢,需要较长电泳滴定时间以完成检测。当凝胶中的离子强度较高(60 mmol/L)时,可观察到滴定通道中有深蓝色沉淀产生。这可能是因为凝胶中过高的离子浓度导致TMB·+溶解度的变化,使得TMB·+在浓度较高时发生沉淀,并进一步破坏凝胶结构的稳定,对滴定结果产生干扰。当通道中的离子强度适中(40 mmol/L)时,界面迁移速度较快,界面形态与颜色稳定,检测稳定性也较好。因此,将滴定通道凝胶中KCl浓度设置为40 mmol/L。
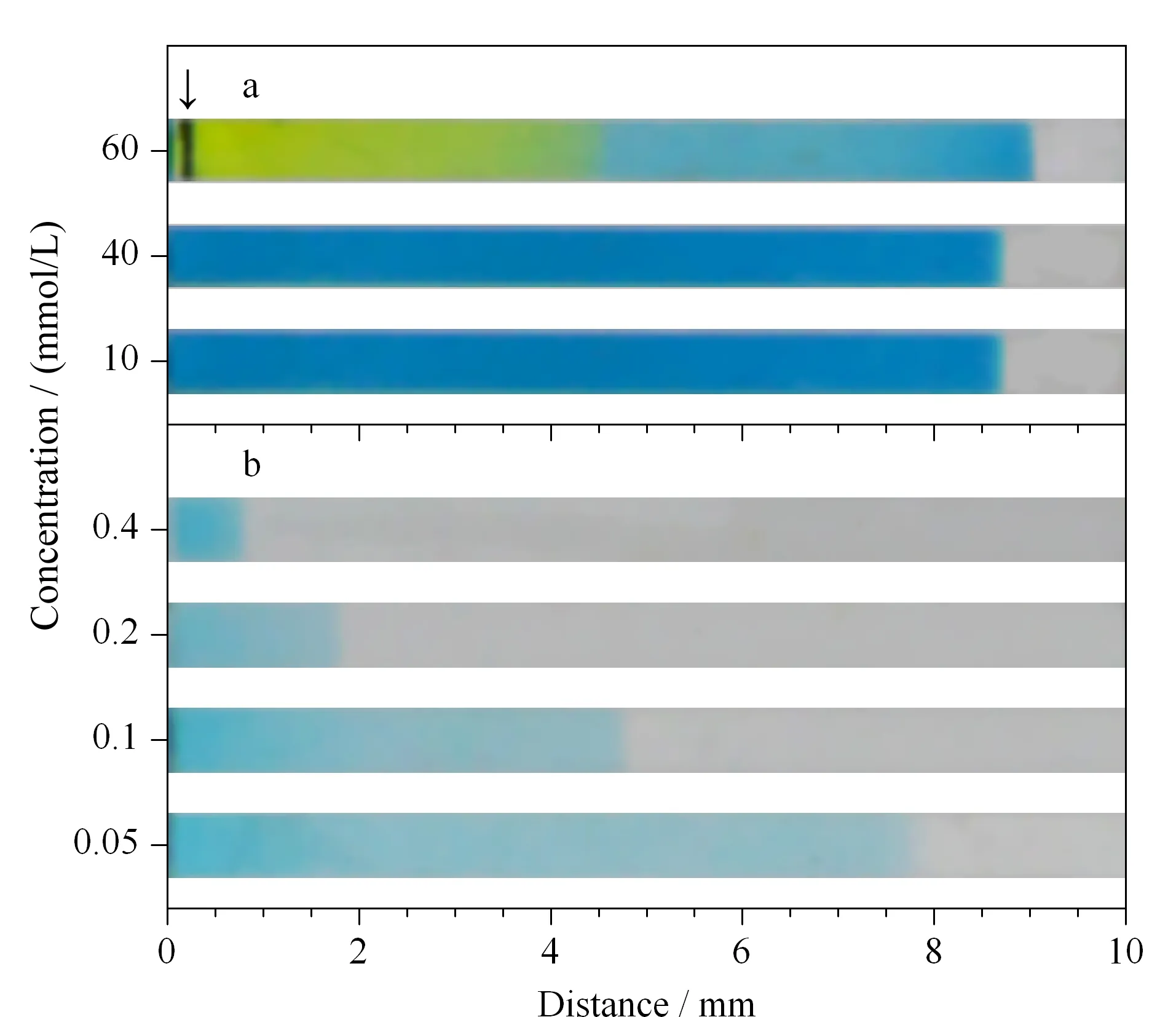
图5 滴定凝胶中(a)电解质浓度与(b)AA浓度对界面迁移的影响Fig.5 Influence of (a)electrolyte concentration and (b)AA concentration in gel on the boundary motion Experimental conditions:a.10,40,and 60 mmol/L KCl in titration and bridge channel,0.073 mg/L HRP in chromogenic solution;b.0.4,0.2,0.1,and 0.05 mmol/L AA in titration channel,0.009 mg/L HRP in chromogenic solution.Concentrations of NaOH in anolyte and HCl in catholyte were the same as KCl concentration in titration channel.Other conditions were the same as those in Fig.4.The arrow indicates the formation of precipitation.
2.4 滴定通道凝胶中AA浓度对检测的影响
电泳通道凝胶中的AA与通道迁移的TMB·+发生反应,因此AA的浓度将直接影响界面迁移的速度。改变滴定通道凝胶中AA的浓度,观察电泳滴定过程中界面迁移速度的变化。试验现象见图5b。当凝胶中的AA浓度较高(≥0.2 mmol/L)时,界面迁移速度较慢,需要较长电泳滴定时间以完成检测。随着凝胶中的AA浓度降低,界面迁移速度随之加快。然而,当凝胶中的AA浓度进一步降低(≤0.05 mmol/L)时,在试验中观察到界面迁移速度渐趋于恒定,不利于检测的进行。综合考虑上述因素,选择0.1 mmol/L作为滴定凝胶中AA浓度。
2.5 电泳滴定检测HRP标准曲线
在试验条件优化之后,考察了电泳滴定检测HRP浓度与界面迁移速度的标准曲线。试验结果如图6所示,随着HRP质量浓度的上升,界面迁移速度随之上升。进一步考察界面迁移速度与HRP浓度的关系,标准曲线为V=1.106 lgρ+3.554,对数线性拟合范围为0.002至0.073 mg/L。式中,V代表氧化还原反应界面在滴定通道中迁移的速率(mm/min),ρ代表HRP在反应体系中的质量浓度(mg/L)。当HRP浓度进一步下降时,检测信号会偏离标准曲线,并且界面颜色淡化,给目视读数带来困难。试验结果表明,本方法能够在较短的检测时间(显色加电泳滴定仅需9 min)内实现对HRP可视化的定量检测。
同时,将开发的电泳滴定检测HRP方法与多种已报道的HRP检测方法进行了对比(见表1)。相较于其他检测方法,电泳滴定检测HRP能够达到较好的检测灵敏度,且通过延长显色反应时间,检测灵敏度能够得到进一步的提升。同时,电泳滴定检测方法不依赖于传统检测器以及分析仪器设备,在检测成本以及便携性上具有独特的优势。

表1 氧化还原反应界面-电泳滴定检测方法与数种已报道的HRP检测方法的比较Table 1 Comparison of ET-redox reaction boundary (RB)method with several reported detection methods for HRP assay
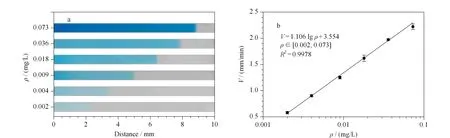
图6 电泳滴定检测HRP的(a)界面迁移距离和(b)标准曲线(n=3)Fig.6 (a)Boundary motion distance and (b)calibration curve of HRP detection with developed ET method (n=3) Experimental conditions:0.002,0.004,0.009,0.018,0.036,and 0.073 mg/L HRP in chromogenic solution;photos were acquired after ET running for 4 min.Other conditions were the same as those in Fig.4.V:moving velocity of the RB in titration channel (mm/min);ρ:mass concentration of horseradish peroxidase detected in reaction system (mg/L);R2:correlation coefficient.
3 结论
本文构建了基于氧化还原反应界面的电泳滴定即时检测HRP方法。结果表明,该检测方法具有较高的检测灵敏度、优异的检测速度、温和的检测条件、较低的检测成本(不依赖检测仪器、泵等设备)。可通过运用抗体、核酸适配体技术将待测物质信号转化为HRP酶信号,该方法有望实现对于多种重要目标物质的高灵敏、即时、低成本的检测。相关的研究正在进行中。