基于Mekk2-/-小鼠研究贞术调脂胶囊调控β-catenin泛素化的成骨机制
孙平 李风英 杨国柱 韩晓蕊 陈镇秋 何伟 洪郭驹,7* 郭姣
1.广东药科大学附属第一医院内分泌科,广东 广州 510080 2.青岛市即墨区人民医院内分泌科,山东 青岛 266200 3.广东药科大学生命科学与生物制药学院,广东 广州 510006 4.华南理工大学医学院,广东 广州 510006 5.广州中医药大学第一附属医院关节骨科,广东 广州 510405 6.广州中医药大学岭南医学中心国家重点学科中医骨伤科学实验室,广东 广州 510405 7.加拿大阿尔伯塔大学医学院骨外科部,加拿大 埃德蒙顿 T6G 2R3 8.广东药科大学,广东 广州 510006
糖皮质激素性骨质疏松(glucocorticoid-induced osteoporosis,GIOP)是由于长期使用糖皮质激素(glucocorticoid,GC)所导致的骨代谢紊乱,主要表现为血清游离脂肪酸含量增高、骨量减少、骨微结构破坏、骨脆性增加和易于骨折[1-2]。在10个国家进行的全球骨质疏松症妇女纵向研究[3-4]中,有4.6%的绝经后骨质疏松症患者正在服用GC。在GIOP的研究当中,GC介导β-catenin是调控骨代谢、促进骨形成的关键节点。而在近期的研究[5]中发现,除了经典的Wnt信号通路外,还存在促分裂原活化蛋白激酶激酶激酶2(mitogen-activated protein kinase kinase kinase 2, MEKK2)的调控通路,有效地抑制β-catenin泛素化,维持β-catenin的稳定。
在前期研究中,笔者团队发现以贞术调脂胶囊(FTZ)为代表的“补肾祛湿”法对治疗GIOP有着优良的治疗效果,对于抑制骨丢失、保存在体骨量有明显的效果[6-8]。更重要的是,笔者团队初步发现了FTZ对GIOP中的MEKK2-Wnt偶联存在调控作用,从而拮抗GC副作用,改善骨微环境的骨脂代谢功能,促进成骨分化和抑制骨丢失[9]。鉴于此,本研究进一步通过CRISPR/Cas9技术建立Mekk2敲除C57BL/6 J小鼠,并提取小鼠原代成骨细胞,添加FTZ含药血清进行干预,经与野生型小鼠成骨细胞比较,更深层次地挖掘FTZ拮抗GC抗GIOP的内在分子机制。
1 材料和方法
1.1 材料
1.1.1Mekk2小鼠敲除方法与鉴定:采用CRISPR/Cas9技术,利用非同源重组修复引入突变的方式,造成Mekk2基因蛋白读码框移码,功能缺失,敲除设计策略见图1。具体操作如下:通过体外转录的方式,获得Cas9 mRNA和gRNA。将Cas9 mRNA和gRNA(Cas9和gRNA体外转录信息见表1)显微注射到C57BL/6 J小鼠的受精卵中,获得F0代小鼠。在获得F0代小鼠后,经PCR产物测序确认,共获得8只目的基因蛋白读码框移码的F0代小鼠;选取阳性的F0代小鼠分别与野生型C57BL/6 J小鼠交配,获得的F1代小鼠。鉴定方法同F0代小鼠鉴定。选取F1代刚出生乳鼠用于原代成骨细胞提取,选取F1代的6-8周敲除小鼠用于MicroCT检测。
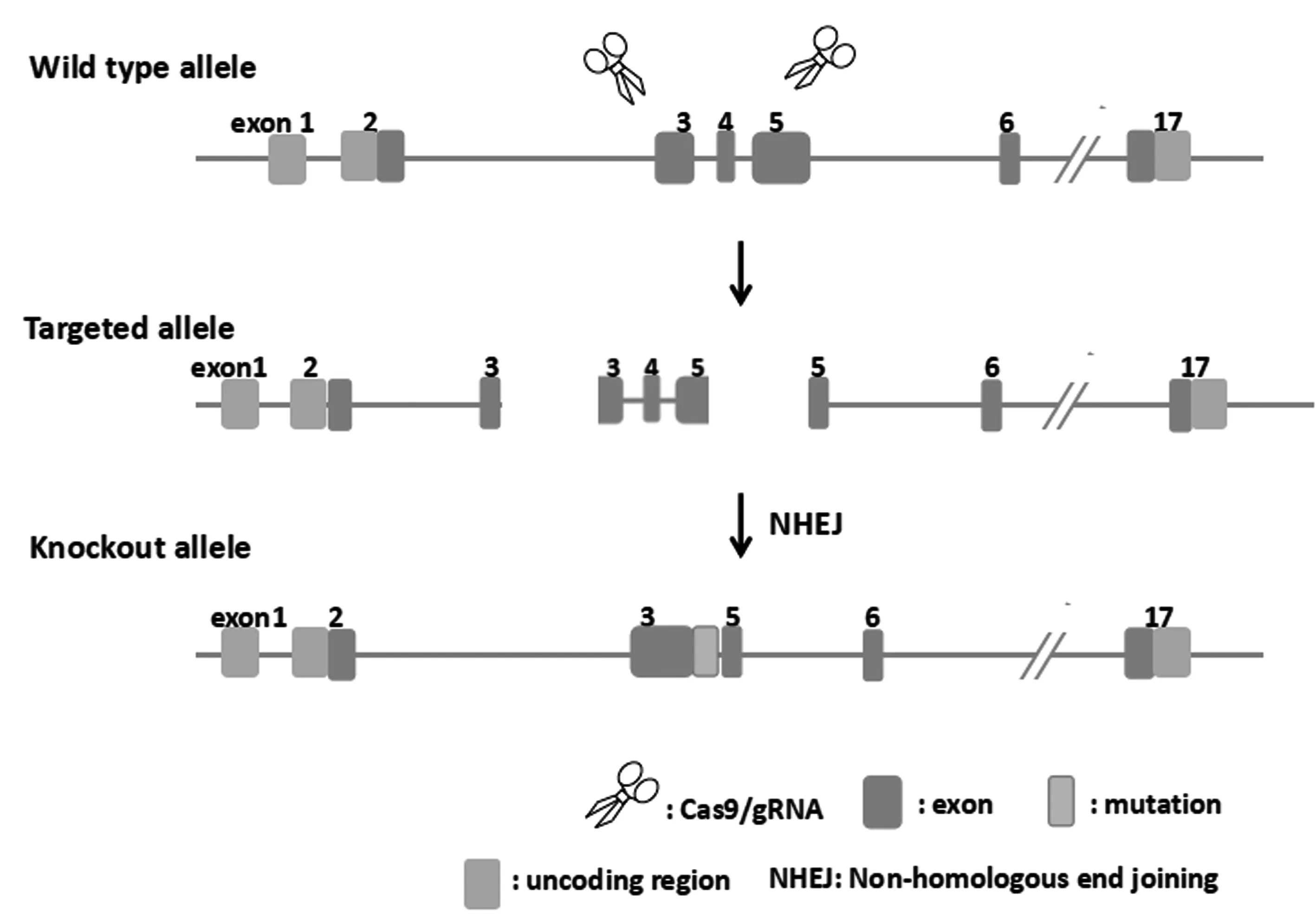
图1 Mekk2敲除策略示意图Fig.1 Schematic diagram of Mekk2 knockout strategy

表1 在Mekk敲除中的Cas9和gRNA体外转录信息Table 1 The transcription information of Cas9 and gRNA in Mekk2 knockout
1.1.2野生型乳鼠来源及培育条件:用于受精培育、MicroCT及含药血清制备的小鼠为C57BL/6,雌雄均有,SPF级,6~8周龄,小鼠体重18~20 g;用于原代成骨细胞提取的乳鼠为C57BL/6品系的5 d大乳鼠。由广州中医药大学动物实验中心[SCXK(粤)2013-0001]标准饲养,实验过程中对动物的处置符合中国科技部颁布的《关于善待实验动物的指导性意见》。培育条件室温控制在23 ℃~25 ℃, 相对湿度50%~60%, 光照时间07:00~19:00, 自由饮水及进食。
1.2 方法
1.2.1MicroCT检测小鼠骨组织表型:将6~8周野生型小鼠和Mekk-/-小鼠处死后取右侧胫骨,置于Micro-CT平台上,从胫骨近端扫描至远端,得出整个胫骨的3D重建层面图片。通过Micro-CT自带计算机分析系统根据所创建图片的有效信息,依次计算骨表面积与骨骼体积比(BS/BV)、骨小梁厚度(Tb.Th)、骨小梁数目(Tb.N)、骨小梁间隙(Tb.Sp)。
1.2.2FTZ含药血清制备:小鼠(共10只)先适应性饲养7 d,给药前将小鼠禁食6 h。将复方贞术调脂胶囊(购自广东药科大学附属第一医院)剖开,参照人用药量及所规定的人与鼠体表面积关系得出小鼠所需的等效剂量,以5倍等效剂量对小鼠进行药物灌胃,2次/d,连续7 d。末次灌胃1 h后,行浅麻醉,心脏取血1~2 mL。室温静置30 min后取上清液,3 000 r/min离心15 min,分离血清,取上清液,冰冻保存备用。每次使用10 %含药血清(1 mL培养液中添加0.1 mL含药血清)作为添加量。
1.2.3成骨细胞培养和分化测定:通过胶原酶II消化从5 d的新生乳鼠头盖骨中分离出细胞。将细胞在含有抗坏血酸和β-甘油磷酸的培养基中培养,以分化成原代成骨细胞。将原代成骨细胞培养于含有10 %FBS、2 mmol/L 1-谷氨酰胺、1%青霉素/链霉素的α-MEM培养基中。
1.2.4免疫沉淀(PI)实验:用裂解液裂解成骨细胞,测定蛋白浓度,向蛋白上清液中加入1.0 μg IgG和80 μL protein A/G珠子孵育,离心后取上清,加入10 μL抗体沉淀p-MEKK2/3和MEKK2并孵育过夜,再加入80 μL A/G-珠子孵育,收集免疫沉淀物,加入缓冲液,剩余步骤同1.2.5。
1.2.5Western blot实验:将细胞裂解液与缓冲液混匀形成样品,吸取样品与预染蛋白marker注入电泳,350 mA转膜3 h。随后5%脱脂奶粉封闭1 h。加入一抗(β-catenin及p-β-catenin,均按照厂家说明稀释,Sigma公司,美国)。经孵育过夜后,TBST洗涤并加入相应二抗。最后在凝胶成像系统中进行曝光和成像分析。
1.2.6Luciferase报告实验:将0.5 μg的TOPflash质粒和50 ng海肾荧光素酶质粒瞬时转染在12孔板上生长的C3H10T1/2细胞(Thermo Fisher Scientific公司,美国)。转染24 h后按空白对照组、FTZ含药血清、Wnt3蛋白(Sigma公司,美国)以及FTZ含药血清和Wnt3共同干预,继续培养48 h,随后裂解细胞,并使用双重荧光素酶报告基因测定系统获得标准化的荧光素酶活性。
1.3 统计学处理
计量资料以均数±标准差(mean ±SD)表示, 所有统计分析均使用SPSS 22.0统计软件处理。组间均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 Mekk2+/-小鼠构建与鉴定
经受精卵显微注射,本研究共获得38只F0代小鼠。通过PCR的方式,对F0代小鼠的基因型进行鉴定,共获得8只目的基因蛋白读码框移码的阳性F0代小鼠;F0代小鼠PCR产物,经测序,阳性F0代阳性小鼠(1号和16号)分别与野生型C57BL/6 J小鼠交配,最终获得6只F1代杂合子小鼠(Mekk2+/-)。
2.2 Mekk2-/-小鼠培育
将获得的Mekk2+/-小鼠(Mekk2+/-)分成两部分:一部分杂合子小鼠与野生型小鼠交配,扩群繁育较多的Mekk2+/-小鼠;一部分杂合子小鼠自交,获得基因敲除纯合子小鼠(Mekk2-/-),本实验最后共获得Mekk2-/-乳鼠20只用于原代细胞提取。
2.3 Mekk2-/-小鼠与野生型小鼠表型差异
采用MicroCT对Mekk2-/-小鼠与野生型小鼠进行骨组织的表型检测。结果提示,Mekk2-/-小鼠与野生型小鼠相比,前者BV/TV、Tb.N、Tb.Th值降低(P=0.014,P=0.035,P=0.028),Tb.sp无差异变化(P=0.084)。见表2。

表2 MicroCT检测Mekk2-/-小鼠与野生型 小鼠骨组织Table 2 MicroCT detects the bone tissue of Mekk2-/- mice and wild type mice
2.3 FTZ含药血清激活MEKK2以稳定成骨细胞中的β-catenin
分别加入FTZ含药血清以刺激野生型小鼠成骨细胞和Mekk2-/-成骨细胞,干预时间为10、20、40 min,并通过Western blot分析β-catenin(S675)的磷酸化水平。结果提示,FTZ含药血清在40 min时可增强野生型小鼠细胞β-catenin(S675)的磷酸化水平(P=0.026),但是在Mekk2-/-小鼠细胞中则明显降低,特别是在40 min时(P=0.032)。见图2。

图2 FTZ含药血清促进β-catenin磷酸化水平 A:FTZ含药血清添加到野生型(WT)小鼠和Mekk-/-小鼠的成骨细胞,干预时间在0、10、20、40 min不等,Western blot检测p-β-catenin表达水平;B:p-β-catenin与β-catenin表达水平比率。Fig.2 FTZ containing serum promotes phosphorylation of β-catenin A:FTZ containing serum is added into the primary osteoblast of wild type mice and Mekk2-/- mice at 0, 10, 20, 40 mins. Western blot is used to detect the expression of p-β-catenin;B:the ratio of p-β-catenin and β-catenin.
2.4 FTZ含药血清诱导MEKK2磷酸化
在野生型小鼠原代细胞中,采用FTZ含药血清和FGF2(诱导MEKK2的激活因子)对细胞进行干预。结果发现,FTZ含药血清和FGF2干预后的原代细胞中,p-MEKK2/3表达水平均比不干预时细胞增强(P=0.003,P=0.008),且二者提高水平不存在明显差异(P=0.062,P=0.071)。见图3。
2.5 FTZ含药血清促进β-catenin活化
将TOPflash质粒和海肾荧光素酶质粒瞬时转染入C3H10T1/2细胞中。用FTZ含药血清或Wnt3a以及二者共同干预细胞。结果提示,FTZ含药血清和Wnt3a均促进β-catenin活化,而FTZ含药血清和Wnt3a共同干预细胞后,可见β-catenin活化程度更高,效果呈累加效应(P<0.05)。见图4。

图3 FTZ含药血清诱导MEKK2磷酸化 A:FGF2(25 ng/mL)与FTZ含药血清共同干预野生型小鼠原代成骨细胞,并用免疫沉淀技术检测p-MEKK2/3和MEKK2表达;B:p-MEKK2/3和MEKK2表达水平比率。Fig.3 FTZ containing serum induces phosphorylation of MEKK2 A:FGF2 (25 ng/mL) and FTZ containing serum are added into the primary osteoblast of wild type mice. Immunoprecipitation is used to detect the expression of p-MEKK2/3;B: the ratio of p-MEKK2/3 and MEKK2.

图4 FTZ含药血清和Wnt3a促进β-catenin活化Fig.4 FTZ containing serum and Wnt3a promoteβ-catenin activation
3 结论
GIOP的发生和发展密切关系着骨吸收破坏的平衡稳定或者失衡,通过药物寻求再平衡至关重要[10]。从细胞层面上看,GC抑制Wnt/β-catenin经典通路,加速β-catenin磷酸化降解,从而激活泛素系统,是造成GIOP的重要环节和基础分子机制。当GC超量时,抑制β-catenin泛素系统的上游机制被阻断,可抑制Wnt下游因子[11-12],激活Wnt抑制因子[12-17],更可以抑制Wnt自身表达[18]。而最新的研究发现,MEKK/SET11亚家族成员MEKK2可有效地抑制β-catenin的泛素化。研究[5]指出,由FGF2所激活MEKK2可以通过USP15的募集,从有别于Wnt经典通路之外,实现抑制β-catenin泛素化的效果,从而阻止其组成蛋白酶产生周转。这一种创新性发现,提出了MEKK2的正向调控对实现细胞内β-catenin的稳定性具有开拓性意义。基于此,笔者团队认为,如果能寻找到正向介入MEKK2通路的效用药物,即可以发挥与Wnt经典通路同样的预期效果。
在既往的研究当中发现,FTZ中药方剂的效用机制契合GIOP骨脂代谢分子机制,在生物表型上能够系统解决骨组织内脂肪沉积,成骨活性减弱,骨代谢紊乱等[6-8]。这也是FTZ作为降脂类中成药在骨科领域的发展。笔者团队经研究进而发现,在GIOP模型当中,FTZ不仅提高了骨量,抑制了骨质疏松的进展,同时还调控骨组织内Wnt3a、MEKK2、β-catenin蛋白表达,这提示FTZ通过MEKK2-Wnt偶联信号通路从而促进GIOP成骨功能。在细胞层面也证实了这一点,FTZ同时促进了β-catenin和MEKK2的蛋白表达。另外,研究[9]还发现,FTZ可增强β-catenin/TCF/LEF转录活性,从而激活Wnt/β-catenin信号通路下游靶基因的表达。
基于上述研究基础,笔者团队更深入地通过建立Mekk2-/-小鼠,经与野生型小鼠比较,观察成年小鼠的表型改变。结果显示,Mekk2-/-小鼠的成骨量比野生型小鼠减少,尽管在重建当中未见骨小梁的结构紊乱,但是Mekk2-/-小鼠因缺少Mekk基因而导致骨发育的迟缓与不足是明显的,这与文献当中的结论是一致的。本研究又通过提取Mekk2-/-小鼠和野生型小鼠的原代成骨细胞,研究FTZ对于β-catenin磷酸化的作用。结果表明,FTZ在Mekk2-/-小鼠的成骨细胞中,β-catenin磷酸化的水平相比野生型的细胞下降,这提示FTZ确系通过激活MEKK2发挥稳定成骨细胞内β-catenin水平,抑制β-catenin泛素化的作用。另外,已知FGF2是激活MEKK2的重要因子,而在与FTZ的比较当中提示,FTZ与FGF2所能促进MEKK2磷酸化的水平基本一致,这提示FTZ或直接或通过FGF2间接激活MEKK2活性。最后,通过Luciferase报告实验,团队发现FTZ与Wnt3a均可以促进β-catenin活化,当二者结合干预,可出现β-catenin活化的叠加效应,因此提示FTZ具有独立于Wnt经典通路,通过作用于MEKK2来发挥效应的。通过与之前研究的比较发现,FTZ在分子层面的药理作用是整体性的,即作用于Wnt通路又作用于MEKK2通路,但是二者相互独立,又相互配合,最终起到了β-catenin去泛素化的效果。
综上所述,FTZ可以作为一个较为理想的药物,既促进Wnt/β-catenin通路,又通过对MEKK2的正向调控作用,避免了Wnt或其同源受体的因激活而过度冗余,消除信号传导过程中多种混杂因子参与,减少Wnt /β-catenin通路的消极表型[19],从而实现治疗GIOP的良好作用。

