绿狐尾藻湿地对养殖废水中不同污染负荷氮去除效应
朱辉翔,张树楠,彭英湘,刘 锋,肖润林
绿狐尾藻湿地对养殖废水中不同污染负荷氮去除效应
朱辉翔1,2,张树楠1※,彭英湘3,刘 锋1,肖润林1
(1. 中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验,长沙农业环境观测研究站,长沙 410125;2. 中国科学院大学,北京 100049;3. 湖南省生态环境监测中心,国家环境保护重金属污染监测重点实验室,长沙 410014)
为研究绿狐尾藻湿地对不同污染负荷养殖废水氮去除效应和影响因素,该研究在野外建立了9条表面流绿狐尾藻湿地,以低负荷(60 L/d废水+120 L/d清水)、中负荷(120 L/d废水+60 L/d清水/d)和高负荷(180 L/d废水)养殖废水为处理对象,研究了不同污染负荷下绿狐尾藻湿地水体氮素时间变化规律;结合线性混合模型,进一步探究了影响绿狐尾藻湿地氮去除的关键环境因子。结果表明,整个试验期间(2014-07-2015-05),绿狐尾藻湿地对低、中、高负荷废水铵氮(NH4+-N)和总氮(Total Nitrogen,TN)去除率均较高,其中NH4+-N平均去除率为85.0%~98.7%,TN平均去除率为83.6%~97.1%。线性混合模型分析结果表明,影响绿狐尾藻湿地NH4+-N去除的关键环境因子是水体溶解氧和硝态氮以及底泥NH4+-N含量,其中水体溶解氧对绿狐尾藻湿地NH4+-N去除影响最大。由于绿狐尾藻湿地对不同污染负荷废水NH4+-N和TN去除率均达到80.0%以上,因此绿狐尾藻可作为耐铵植物处理高负荷养殖废水。该研究结果可为绿狐尾藻湿地在规模养殖场的实际应用提供参考。
废水;氮;养殖;绿狐尾藻;人工湿地;污染负荷;去除效应
0 引 言
中国是世界上生猪主要生产国之一,随之而来的是养殖废弃物环境污染问题。2020年生态环境部发布的《第二次全国污染源普查公报》表明,每年排放的养殖废水中含总氮(Total Nitrogen,TN)37.00万t,总磷(Total Phosphorus,TP)8.04万t,化学需氧量(Chemical Oxygen Demand,COD)604.83万t。中国养殖业主要分布在广大农村地区,由于成本和技术问题,大多养殖户选择将养殖废水直接排放到自然水体中,导致农村污水污染面积大、污染来源广、结构成分复杂,进而导致农村环境严重恶化。因此在农村地区,亟需发展一种成本低廉和操作简便的养殖废水处理技术。人工湿地是一种成本低、易操作、处理效果良好的生物处理技术,它不仅可以促进污水中的污染物质良性循环来改善水质,同时还具有良好的生态环境效益[1-3]。研究表明,影响人工湿地对氮、磷等污染物去除效果的因素很多,包括植物种类、种类配置模式、湿地基质、污染负荷、水力停留时间等[4-7]。其中污染负荷对人工湿地处理效果有重大的影响,它会影响湿地溶解氧(Dissolved Oxygen,DO)水平以及硝化-反硝化微生物种群数量[8],进而影响人工湿地氮去除。
过去研究中,人工湿地通常被用于处理低氮负荷(NH4+-N:14.32~26.84 mg/L,TN:28.42~55.14 mg/L)生活污水[9-10]。即使处理养殖废水,人们仅将稀释后或经前期处理的低负荷养殖废水用于人工湿地研究[11-12]。然而养殖场排放的原养殖废水通常以高铵态氮(NH4+-N)、高COD和高颗粒悬浮物(Suspended Solids,SS)为特征。高NH4+-N会抑制植物生长并导致植物产生中毒症状[13]。然而,有关人工湿地处理高污染负荷养殖废水的研究较少。
绿狐尾藻()是一种多年生沉水或浮水草本植物,它的去氮能力受到污水氮浓度的显著影响,但对高铵氮具有较强的耐受性,可被用于高氮浓度污水的修复[14-16]。野外示范工程也表明绿狐尾藻能够生长在高NH4+-N的养殖废水中[8]。然而,关于绿狐尾藻湿地氮去除的报道大多属于短期室内模拟试验[17-18],有关野外绿狐尾藻湿地对高负荷养殖废水原位氮去除的报道不多。
本研究开展野外定位试验,以养殖废水为处理对象,通过测定不同氮负荷下绿狐尾藻湿地水体NH4+-N、硝态氮(NO3--N)和TN随时间变化规律,研究绿狐尾藻湿地对养殖废水不同氮负荷的去除效应;通过测定不同氮负荷下绿狐尾藻湿地环境因子、底泥碳氮含量等指标,结合多元混合模型,探明影响绿狐尾藻湿地氮去除的关键环境因子。本研究有助于深入认识绿狐尾藻对养殖废水的耐铵范围及绿狐尾藻湿地氮去除规律,为后续机理研究提供科学依据。
1 材料与方法
1.1 表面流人工湿地构建
试验区位于湖南省长沙县金井河流域。当地属于亚热带湿润季风气候,年平均气温16.6~20.5 ℃,极端最低气温−5.2 ℃,极端最高气温39.1 ℃。年平均降雨量1 389 mm,降雨多集中在4-6月,占全年降雨的76%。经前期调查,该流域零散分布着大量养殖户或小型养殖场,一般情况下养殖废水未经处理直接排放到自然水体中。为了使当地养殖废水得到适宜的处理,本研究通过构建表面流人工湿地,以研究人工湿地对养殖废水氮的去除效应。
本研究的表面流人工湿地构建于中国科学院长沙农业环境观测站内。根据试验需要,养殖废水人工湿地处理系统由废水池(100 m3)、清水池(400 m3)、布水池(长×宽×深:0.5 m×2 m×1 m)和表面流人工湿地(长×宽×深:15 m×2 m×0.5 m)组成(图1)。废水池为人工湿地提供养殖废水,其中的废水由长沙县白沙镇大花养殖场提供,废水理化特征为:NH4+-N 249.3~512.7 mg/L,NO3--N 0.24~1.27 mg/L,TN 315.6~702.1 mg/L,TP 42.6~115.3 mg/L。清水池为低负荷和中负荷废水配置提供水源,其清水由附近水库提供,水质比较稳定,理化特征为:NH4+-N 0.2 mg/L,NO3--N 0.4 mg/L,TN 0.8 mg/L,TP 0.03 mg/L。表面流人工湿地构建于水稻田,南北方向平行排列,由不锈钢板将不同小区间隔开。为了防止湿地间相互渗水,不锈钢板被镶插到土壤的犁底层。由于表面流人工湿地不存在堵塞问题,其填料为微生物丰富的水稻土。人工湿地前端设置1个布水池,布水池靠近湿地一侧装有布水凹槽。人工湿地的出水口处安装2根L型排水管以控制水位。
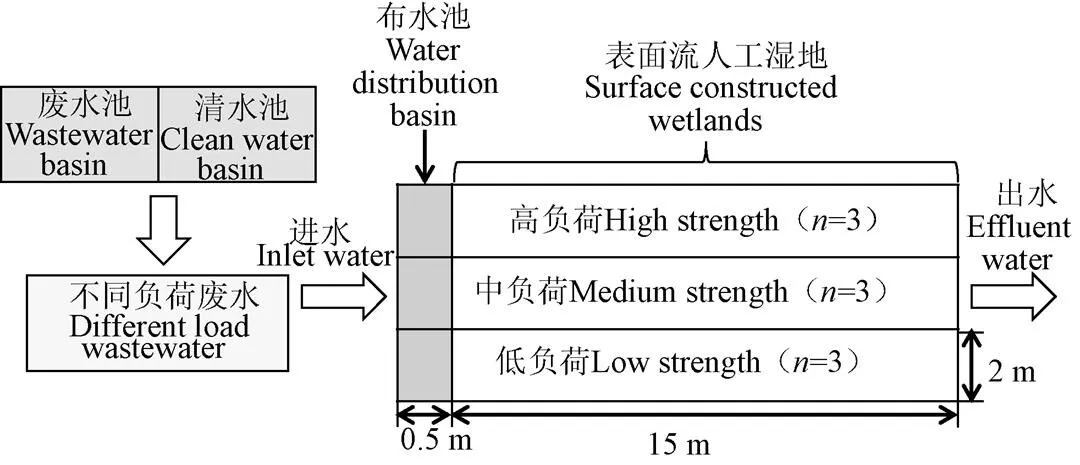
注:n代表各处理重复数。
1.2 处理设置
2014年5月,在野外沟渠采集绿狐尾藻,选取生长健壮、大小相当的植株,截取前段20 cm,种植在人工湿地小区中。试验开始前,将清水放入人工湿地小区中,使植物在清水中预培养7~8周。待植物长好后,往各小区中加入不同污染负荷的养殖废水,正式开始试验。试验共设3个处理:低负荷(60 L废水+120 L清水)、中负荷(120 L废水+60 L清水)和高负荷(180 L废水),每个处理3次重复。试验期间,低、中、高负荷进水TN容积负荷范围分别为2.67~5.46、5.09~12.14和9.45~20.74 mg/(m3·d)。各处理选择间歇式进水,即各处理按上述低、中、高负荷每天进水180 L,其水力停留时间为33 d,该数值与Ibekwe等[19]已报道的处理养殖废水人工湿地相近。当水位低于10 cm时,绿狐尾藻湿地氮去除过程中温室气体排放较高;高于25 cm时,不利于微生物氮去除[20],因此试验水位设置在20 cm。
1.3 样品采集与分析
1.3.1 湿地水样
从2014年7月到2015年5月,每月中旬采集一次人工湿地不同处理进水口和出水口水样。由于表层水样污染物浓度最接近湿地出水,而样品采集时,并不是所有时间均能收集到出水口水样,因此本试验统一采集了湿地出水口0~5 cm表层水样代表湿地出水。水样采集时,每个湿地随机选取多个采集点,每个点位用注射器吸取0~5 cm表层水样50 mL,然后将多个点位的水样混合均匀带回实验室,放置于−20℃冰箱保存待测。水样NH4+-N和NO3--N测定前先过0.45m的滤膜,然后在流动注射分析仪上(Fir-star 5000,瑞士)分析其浓度。水样TN先用碱性过硫酸钾在高压灭菌锅中消化,然后在流动注射分析仪上测定。水样COD通过重铬酸盐法(GB11914-89)测定。另外,用便携式多参数测量仪(Mettler Toledo SG68,瑞士)原位测定湿地的pH值、DO和氧化还原电位(Eh)。
1.3.2 湿地底泥
从2014年7月到2015年5月,每月中旬采集一次人工湿地不同处理的底泥样品。底泥样品采集时,每个取样点附近随机选择多个点位,每个点位用圆柱形采样器采集0~10 cm底泥样,自封袋封装后放入4 ℃冰箱保存待测。样品测定前先将根系、石子等杂质去除,然后混匀。其中一部分用于测定底泥NH4+-N、NO3—N和可溶性有机碳(Dissolved Organic Carbon,DOC);另一部分底泥经风干、磨碎、过筛(0.25 mm),用于测定TN含量。底泥NH4+-N、NO3--N和DOC用0.5 mol/LK2SO4提取法:取80 mL 0.5 mol/L K2SO4溶液加到30 g底泥中,振荡1 h,通过定性滤纸过滤悬浊液,滤液通过流动注射分析仪测定NH4+-N和NO3--N含量,通过有机碳分析仪(TOC-VWP,日本)测定DOC含量;TN测定方法是半微量凯式定氮法。
1.4 统计分析
由于本研究考虑了污染负荷和采样时间等影响因子,另外绿狐尾藻湿地水体溶解氧和硝态氮存在显著相关性,因此线性混合模型更适合用于探明绿狐尾藻湿地NH4+-N去除的关键影响因子。线性混合效应模型具体如下:
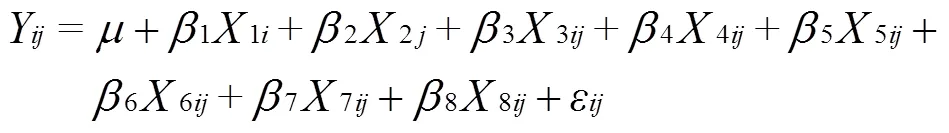
式中为污染负荷水平(=3);为采样次数(=11);
Y为绿狐尾藻湿地第个污染负荷在第次采样时出水NH4+-N浓度;为回归模型的截距,即回归直线与轴的交叉点;1~8为回归系数;ε为随机误差;1i代表第个污染负荷具体数值;2j代表第次采样具体天数;3ij代表第个污染负荷在第次采样时水体pH值;4ij代表第个污染负荷在第次采样时水体DO浓度,mg/L;5ij代表第个污染负荷在第次采样时水体Eh值(氧化还原电位),mV;6ij代表第个污染负荷在第次采样时水体COD浓度,mg/L;7ij代表第个污染负荷在第次采样时水体NO3--N浓度,mg/L;8ij代表第个污染负荷在第次采样时底泥NH4+-N含量,mg/L。
为了避免潜在过度拟合现象,采用十折交叉验证方法对模型进行验证,具体步骤参考孙成等[21]文章。本研究变量的正态分布检验和方差分析采用SPSS 11.5软件(SPSS Inc.,芝加哥,美国)。所有变量的正态分布检验采用One-way Kolmogorov-Smirnov法。所有变量的差异显著性检验采用One-way ANOVA法,统计检验的显著性水平为0.05(<0.05)。
2 结果与分析
2.1 不同污染负荷对水体环境因子的影响
水体中pH值、DO、Eh和COD的时间变化特征见图2。整个试验期间,绿狐尾藻湿地低、中、高氮污染负荷水体pH值变化范围为5.95~7.87,随时间变化不大。不同氮污染负荷的平均pH值大小依次为:高负荷(7.45)、中负荷(7.14)、低负荷(6.77)。各污染负荷的DO浓度随时间呈峰型变化,高峰值分别出现在2014年12月和2015年2月。整个试验期间,低、中、高负荷DO浓度范围为0.81~5.33 mg/L,这一范围能够为NH4+-N氧化提供足够的氧,因为参与硝化过程的氨氧化菌和亚硝酸盐氧化菌的氧饱和常数分别为0.2~0.4和1.5 mg/L[22]。该现象说明绿狐尾藻湿地NH4+-N氧化不受污染负荷影响,这可能和绿狐尾藻根系强泌氧有关[23]。各污染负荷Eh值的变化范围为−200.40~144.90 mV。在试验初始阶段,各湿地Eh值逐渐降低;在2014年9月份后,Eh值呈峰型变化,显著的低峰值和高峰值分别出现在2015年1月份和3月份。各污染负荷平均Eh值大小为:低负荷(18.51 mV)、中负荷(−41.49 mV)、高负荷(−114.34 mV)。一般情况下,水体氧化还原电位与DO浓度有一定关系[24],低负荷高Eh值与其高DO浓度有关。整个试验期间低负荷COD浓度变化范围为56.01~279.01 mg/L,各污染负荷平均COD浓度大小为:高负荷(410.10 mg/L)、中负荷(239.83 mg/L)、低负荷(125.96 mg/L)。

注:图中数据代表平均值±标准差,下同。
2.2 不同污染负荷对水体氮浓度的影响
由图3a可知,绿狐尾藻湿地低负荷进水NH4+-N浓度为67.15~173.65 mg/L,出水浓度为0.04~16.01 mg/L,整个试验期间NH4+-N去除率变化不大,均在90%以上。2014年7-12月,湿地中负荷NH4+-N进水浓度大约为200 mg/L,2015年1月份以后,NH4+-N进水浓度上升到250 mg/L左右(图3a)。随进水浓度增加,NH4+-N去除率随时间呈小幅度下降趋势,变化范围为82.4%~99.9%。与低、中负荷相比,绿狐尾藻湿地对高负荷处理的NH4+-N去除率略有降低,这可能和高负荷DO和Eh值更低有关[25]。绿狐尾藻湿地对TN的去除率和NH4+-N有相似趋势(图3b),即低负荷的TN去除率在整个试验期间变化不大,中、高负荷TN去除率随时间呈小幅度下降趋势。不同污染负荷的TN平均去除率大小依次为:低负荷(97.1%)、中负荷(88.8%)、高负荷(83.6%)。整个试验期间,低、中、高污染负荷的NO3--N进水浓度均较低,变化范围为0.05~1.33 mg/L(图3c)。与低负荷相比,绿狐尾藻湿地中、高负荷出水中有更高的NO3--N浓度,这可能和中、高负荷为硝化反应提供更多NH4+-N底物有关;另外,在湿地系统中,微生物去除NH4+-N优先于NO3--N,NH4+-N的存在可抑制微生物去除NO3--N[26]。绿狐尾藻湿地中、高负荷有更高浓度的NH4+-N,对微生物去除NO3--N不利,因此中、高负荷出水出现了更高NO3--N浓度。

图3 绿狐尾藻湿地对不同污染负荷养殖废水氮去除效应
2.3 不同污染负荷对底泥碳、氮含量的影响
不同污染负荷处理的底泥碳、氮含量见图4。低、中、高负荷底泥NH4+-N含量均随时间逐渐上升,变化范围为14.52~316.75 mg/kg。各污染负荷底泥NH4+-N含量在最初6个月(2015年7-12月)上升幅度较小,在2016年1月后上升幅度较大,这是因为2016年1月以后,废水NH4+-N浓度明显升高。与低负荷相比,中、高负荷底泥NH4+-N含量随时间上升的幅度更大,这可能是因为底泥带负电荷[27],而中、高负荷废水NH4+-N浓度远高于低负荷,因此由于静电引力吸附到中、高负荷底泥中的NH4+-N含量更高。整个试验期间不同污染负荷NO3--N含量变化范围为0.28~1.18 mg/kg,各污染负荷的底泥NO3--N平均含量大小依次为:高负荷(0.64 mg/kg)、中负荷(0.45 mg/kg)、低负荷(0.38 mg/kg),这是因为高负荷底泥含有更高NH4+-N含量,可为硝化过程提供更多底物[8]。整个试验期间,各污染负荷底泥TN含量变化范围为1.08~2.13 g/kg,而高负荷底泥TN平均含量比中、低负荷分别高20.38%和22.30%,而中负荷和低负荷的底泥TN含量相差不大,该现象与底泥NH4+-N和NO3--N含量变化趋势相似。各污染负荷底泥DOC含量随时间大体呈上升趋势,变化范围为42.22~141.40 mg/kg。与低负荷相比,中、高负荷底泥DOC含量随时间上升的幅度更大。各污染负荷的底泥DOC平均含量大小依次为:高负荷(94.83 mg/kg)、中负荷(87.13 mg/kg)、低负荷(62.91 mg/kg)。中、高负荷有机碳含量较高,可为NH4+-N提供更多吸附点[28-30],这是中高负荷底泥吸附更多NH4+-N的另一重要原因。
2.4 影响水体NH4+-N去除回归模型分析
绿狐尾藻湿地NH4+-N出水浓度与影响因素的回归分析结果见表1。以高负荷为参照水平比较低负荷和中负荷NH4+-N出水浓度,结果表明低负荷和中负荷NH4+-N出水浓度显著低于高负荷(<0.05),其中低负荷NH4+-N出水浓度比高负荷低11.99%,中负荷比高负荷低4.06%,该现象和上述NH4+-N在不同污染负荷去除情况一致。随着湿地运行时间的延长,各负荷NH4+-N出水浓度随之增加,但增加不显著(>0.05)。水体pH值、COD均与出水NH4+-N浓度呈正相关性,但差异不显著(>0.05)。水体NO3--N浓度增加时,绿狐尾藻湿地NH4+-N出水浓度会显著降低(−0.62%,<0.05),这是因为NH4+-N被硝化微生物氧化为NO3--N[31]。与其他环境因子相比,水体DO浓度对NH4+-N去除影响最大:水体DO浓度每增加一个单位,NH4+-N出水浓度平均降低1.33%(<0.05),这可能与DO浓度是湿地中NH4+-N氧化的限制性因素有关[32]。水体Eh值对NH4+-N去除也有影响,但影响不显著(>0.05)。然而,随着湿地中底泥NH4+-N积累,出水NH4+-N浓度显著增加(0.35%,<0.001),这可能和底泥理化特性有关,当底泥对NH4+-N吸附达到饱和时,其吸附量会逐渐减少[33]。

图4 绿狐尾藻湿地不同污染负荷底泥碳、氮含量动态变化
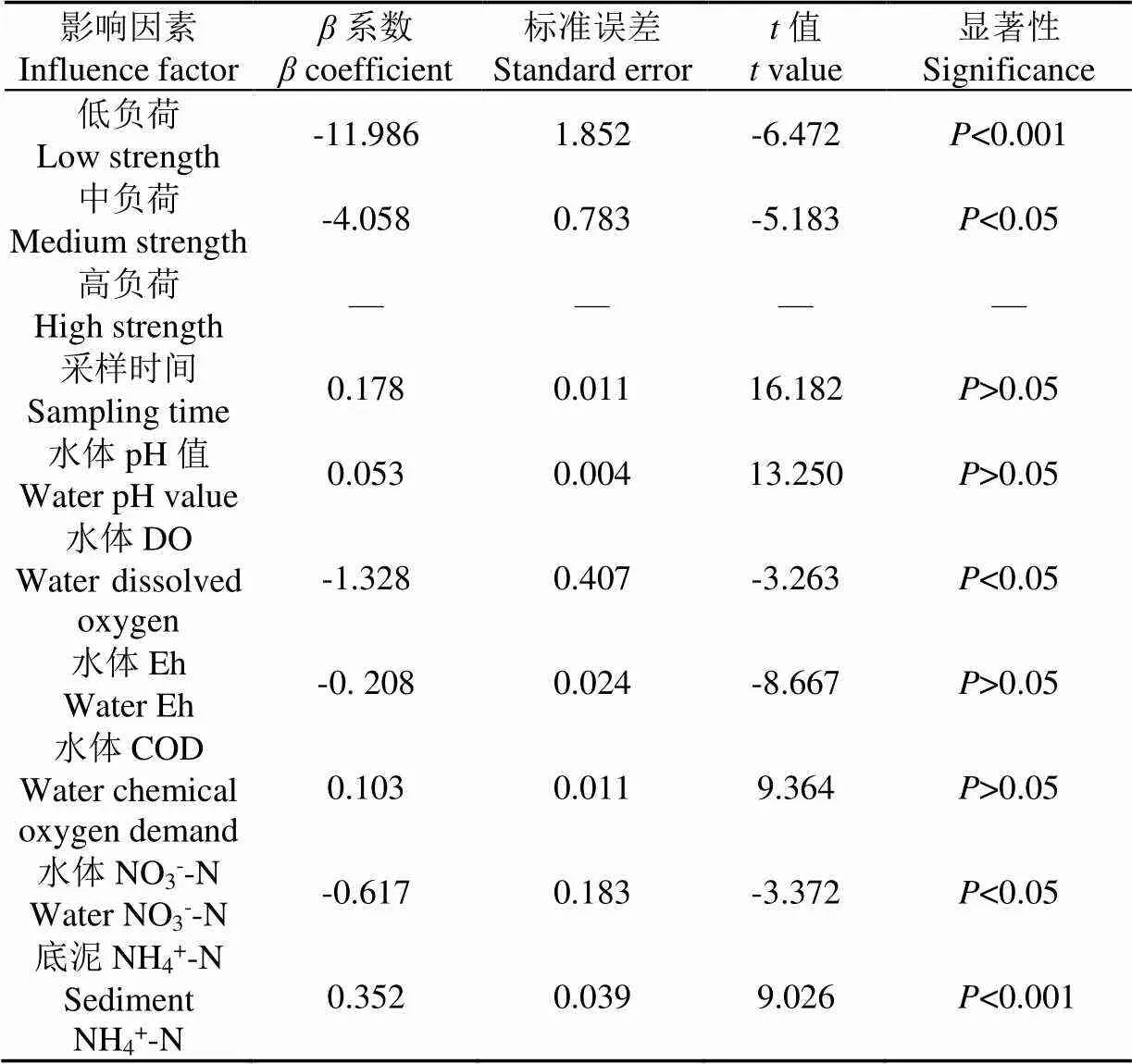
表1 绿狐尾藻湿地出水NH4+-N浓度和影响因素的混合效应回归分析
3 讨 论
养殖废水以高铵氮为特征。由于高NH4+-N浓度对水生植物生长有抑制作用[34],因此在处理不同NH4+-N浓度养殖废水时,合适的湿地植物选择是极其重要的。不同水生植物耐铵水平有差异,例如慈姑、灯心草、香蒲和水葱耐铵上限低于200 mg/L[35-38];伞草耐铵范围为147~236 mg/L[38-39]。本研究绿狐尾藻湿地在高负荷养殖废水(NH4+-N:229.3~499.2 mg/L)中可正常生长,说明绿狐尾藻比慈姑、灯心草、香蒲、水葱和伞草有更高耐铵能力。尽管绿狐尾藻湿地可耐受高铵氮浓度,但是其NH4+-N去除能力受污染负荷影响。在本研究中,绿狐尾藻湿地对低负荷的NH4+-N去除率显著高于中、高负荷(<0.05),具体顺序大小为:低负荷(98.7%)、中负荷(94.2%)、高负荷(85.0%)。该研究结果与Morgan等[40]的报道相似,他们通过生态处理组合系统处理养牛场废水,发现废水中NH4+-N去除率随着污染负荷增加而降低。
多元线性混合模型表明,在所有环境因子中,水体DO浓度对NH4+-N去除影响最大。水体DO浓度每增加一个单位,NH4+-N出水浓度平均降低1.33%(<0.05)。另外,绿狐尾藻湿地平均DO浓度大小依次为:低负荷(3.18 mg/L)、中负荷(2.43 mg/L)、高负荷(1.61 mg/L),而各负荷NH4+-N去除率顺序与DO浓度相同,即低负荷(98.7%)、中负荷(94.2%)、高负荷(85.0%),该结果进一步说明氧气对绿狐尾藻湿地系统NH4+-N去除的重要性。Kouki等[32]的研究也表明DO是湿地系统NH4+-N去除的关键因素。另外,水体NO3--N浓度增加时,绿狐尾藻湿地NH4+-N出水浓度会显著降低(-0.62%,<0.05)。Zhang等[31]同样研究表明,人工湿地水体NO3--N浓度与NH4+-N浓度呈显著负相关性(<0.05)。由于NO3--N是硝化反应的产物,因此微生物硝化是绿狐尾藻湿地NH4+-N去除的重要途径。尽管NO3--N是硝化反应的产物,但同时是反硝化反应的初始底物,因此湿地系统NO3--N浓度由硝化和反硝化反应共同决定[33]。在本研究中,低、中和高负荷出水NO3--N浓度在1月、2月和3月份远高于进水浓度。Zhang等[20]和Luo等[8]同样发现,在种植绿狐尾藻的湿地中,冬季低温季节出水NO3--N出现累积现象。另外,Zhang等[41]其他研究表明绿狐尾藻湿地冬季氧化亚氮排放量远高于其他时期。这些结果均表明即使在冬季低温环境下绿狐尾藻湿地也发生了强烈的硝化反应。冬季NO3--N出现累积与湿地系统高DO浓度有关,高DO浓度促进硝化反应,却抑制反硝化反应的进行。基于绿狐尾藻湿地NO3--N在冬季出现累积现象,若将NH4+-N从湿地系统中彻底去除,湿地末端需连接反硝化生物反应器,绿狐尾藻湿地-反硝化生物反应器组合系统将是本研究下一步研究重点。
4 结 论
1)绿狐尾藻湿地对不同污染负荷养殖废水NH4+-N和TN去除率均较高,其中NH4+-N平均去除率为85.0%~98.7%,TN平均去除率为83.6%~97.1%。
2)废水pH值和COD浓度随着污染负荷的增加而增加,废水DO和Eh随着污染负荷的增加而降低;不同污染负荷底泥NH4+-N和DOC含量随着污染负荷增加而增加。
3)多元混合回归模型表明,影响绿狐尾藻湿地NH4+-N去除的因素包括水体DO、水体NO3--N浓度和底泥NH4+-N含量。与其他因素相比,水体DO浓度对绿狐尾藻湿地NH4+-N去除影响最大;水体溶解氧浓度每增加一个单位,NH4+-N出水浓度平均降低1.33%。
4)绿狐尾藻湿地在高负荷养殖废水(NH4+-N:229.3~499.2 mg/L)中可正常生长,其NH4+-N和TN平均去除率分别高达85.0%和83.6%,因此绿狐尾藻可作为耐铵植物处理高负荷养殖废水。
[1] Conley L M, Dick R I, Lion L W. An assessment of the root zone method of wastewater treatment[J]. Research Journal of the Water Pollution Control Federation, 1991, 63: 239-274.
[2] Green B M, Upton J. Constructed reed beds: A cost-effective way to polish wastewater effluents for small communities[J]. Water Environmental Research, 1994, 66(3): 188-192.
[3] 成水平,王月圆,吴娟. 人工湿地研究现状与展望[J]. 湖泊科学,2019,31(6):1489-1498.
Cheng Shuiping, Wang Yueyuan, Wu Juan. Advances and prospect in the studies on constructed wetlands[J]. Journal of Lake Sciences, 2019, 31(6): 1489-1498. (in Chinese with English abstract)
[4] 马震,崔远来,郭长强,等. 基于水力性能和净化效果的表面流人工湿地设计参数优化[J]. 农业工程学报,2019,35(12):157-164.
Ma Zhen, Cui Yuanlai, Guo Changqiang, et al. Optimization of design parameters of surface flow constructed wetland based on hydraulic performance and pollutant purification effect[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(12): 157-164. (in Chinese with English abstract)
[5] 张彩莹,王岩,王妍艳. 潜流人工湿地对畜禽养殖废水的净化效果[J]. 农业工程学报,2013,29(17):160-168.
Zhang Caiying, Wang Yan, Wang Yanyan. Purification effect of subsurface flow constructed wetland on livestock wastewater[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2013, 29(17): 160-168. (in Chinese with English abstract)
[6] 谢小龙,贺锋,徐栋,等. 垂直流人工湿地配水均匀性的研究[J]. 中国环境科学,2009,29(8):828-832.
Xie Xiaolong, He Feng, Xu Dong, et al. Uniformity of water distribution system in vertical constructed wetland[J]. China Environmental Science, 2009, 29(8): 828-832. (in Chinese with English abstract)
[7] 郝明旭,霍莉莉,吴珊珊. 人工湿地植物水体净化效能研究进展[J]. 环境工程,2017,35(8):5-10,24.
Hao Mingxu, Huo Lili, Wu Shanshan. Research progress on water purification of plants in constructed wetland[J]. Environmental Engineering, 2017, 35(8): 5-10, 24. (in Chinese with English abstract)
[8] Luo P, Liu F, Zhang S N, et al. Nitrogen removal and recovery from lagoon-pretreated swine wastewater by constructed wetlands under sustainable plant harvesting management[J]. Bioresource Technology, 2018, 258: 247-254.
[9] 王勇,张宝莉,汤灿,等. 寒冷地区多级垂直流人工湿地系统设计及氮磷去除效率[J]. 农业工程学报,2016,32(23):218-225.
Wang Yong, Zhang Baoli, Tang Can, et al. Multistage vertical-flow constructed wetlands and removal efficiency of nitrogen and phosphorus in cold area[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(23): 218-225. (in Chinese with English abstract)
[10] Liu X, Huang S L, Tang T F Z, et al. Growth characteristics and nutrient removal capability of plants in subsurface vertical flow constructed wetlands[J]. Ecological Engineering, 2012, 44: 189-198.
[11] Forbes D A, Reddy G B, Hunt P G, et al. Comparison of aerated march-pond-marsh and continuous marsh constructed wetlands for treating swine wastewater[J]. Journal of Environmental Science and Health Part A, 2010, 45: 803-809.
[12] Dong X L, Reddy G B. Nutrient removal and bacterial communities in swine wastewater lagoon and constructed wetlands[J]. Journal of Environmental Science and Health Part A, 2010, 45: 1526-1535.
[13] Mehrer I, Mohr H. Ammonium toxicity: Description of the syndrome and the search for its causation[J]. Physiology Plant, 1989, 77: 545-554.
[14] 李红芳,刘锋,黎慧娟,等. 生物滤池/人工湿地/稳定塘工艺处理农村分散污水[J]. 中国给水排水,2015,31(2):84-87.
Li Hongfang, Liu Feng, Li Huijuan, et al. Combined process of biofilter, constructed wetland and stabilization pond for treatment of rural decentralized sewage[J]. China Water & Wastewater, 2015, 31(2): 84-87. (in Chinese with English abstract)
[15] 马永飞,杨小珍,赵小虎,等. 污水氮浓度对粉绿狐尾藻去氮能力的影响[J]. 环境科学,2017,38(3):1093-1101.
Ma Yongfei, Yang Xiaozhen, Zhao Xiaohu, et al. Effect of wastewater nitrogen concentrations on nitrogen removal ability of[J]. Environmental Science, 2017, 38(3): 1093-1101. (in Chinese with English abstract)
[16] 马永飞,杨小珍,赵小虎,等. 污水氮浓度和NH4+/NO3-比对粉绿狐尾藻去氮能力和植物体氮组分的影响[J]. 环境科学,2018,39(3):1167-1179.
Ma Yongfei, Yang Xiaozhen, Zhao Xiaohu, et al. Effects of wastewater nitrogen concentrations and NH4+/NO3-on nitrogen removal ability and the nitrogen component of(Vell.) Verdc[J]. Environmental Science, 2018, 39(3): 1167-1179. (in Chinese with English abstract)
[17] Saunkaew P, Wangpakattanawong P, Jampeetong A. Growth, morphology, ammonium uptake and nutrient allocation ofCambess. under high NH4+concentrations[J]. Ecotoxicology, 2011, 20: 2011-2018.
[18] Zhang S N, Liu F, Xiao R L, et al. Emissions of NO and N2O in wetland microcosms for swine wastewater treatment[J]. Environmental Science and Pollution Research, 2015, 22(24): 19933-19939.
[19] Ibekwe A M, Ma J, Murinda S, et al. Bacterial community dynamics in surface flow constructed wetlands for the treatment of swine waste[J]. Science of The Total Environment, 2016, 544: 68-76.
[20] Zhang S N, Liu F, Huang Z R, et al. Are vegetated drainage ditches effective for nitrogen removal under cold temperatures?[J]. Bioresource Technology, 2020, 301: 122744.
[21] 孙成,王卫,刘方田,等. 基于线性混合效应模型的河北省PM_(2.5)浓度时空变化模型研究[J]. 环境科学研究,2019,32(9):1500-1509.
Sun Cheng, Wang Wei, Liu Fangtian, et al. Spatial-temporal simulation of PM2.5 concentration in Hebei province based on linear mixed effects model[J]. Research of Environmental Science, 2019, 32(9): 1500-1509. (in Chinese with English abstract)
[22] Park K Y, Lee J W, Inamori Y, et al. Effects of fill modes on N2O emission from the SBR treating domestic wastewater[J]. Water Science and Technology, 2001, 43: 147-150.
[23] Maltais-Landry G, Maranger R, Brisson J, et al. Nitrogen transformations and retention in planted and artificially aerated constructed wetlands[J]. Water Research, 2009, 43: 535-545.
[24] 唐晓,王佳. 海水ORP的影响因素[J]. 装备环境工程,2004,1(4):37-39.
Tang Xiao, Wang Jia. Factors affecting the ORP in seawater[J]. Equipment Environmental Engineering, 2004, 1(4): 37-39. (in Chinese with English abstract)
[25] 陈昢圳,郑向群,华进城. 不同污染负荷对废砖垂直流人工湿地处理农村生活污水的影响[J].生态环境学报,2019,28(8):1683-1690.
Chen Peizhen, Zheng Xiangqun, Hua Jincheng. Effects of different pollution loads on vertical flow constructed wetland with crushed bricks for the treatment of rural domestic sewage[J]. Ecology and Environmental Sciences, 2019, 28(8): 1683-1690. (in Chinese with English abstract)
[26] Metcalf L, Eddy H P, Tchobanoglous G. Wastewater Engineering: Treatment, Disposal and Reuse[M]. New Delhi: McGraw-Hill Companied. Inc, 2003: 940-982.
[27] Pincam T, Jampeetong A. Treatment of anaerobic digester effluent using Typha angustifolia L. growth responses and treatment efficiency[J]. Journal of Water and Environment Technology, 2020, 18(2): 105-116.
[28] Boatman C D, Murray J W. Modeling exchangeable NH4+adsorption in marine sediments: process and controls of adsorption[J]. Limnology and Oceanography, 1982, 27: 99-110.
[29] de Lange G J. Distribution of exchangeable, fixed, organic and total nitrogen in interbedded turbiditic/pelagic sediments of the Madeira Abyssal-Plain, eastern North-Atlantic[J]. Marine Geology, 1992, 109: 95-114.
[30] Van Raaphorst W, Malschaert J F P. Ammonium adsorption in superficial North Sea sediments[J]. Continental Shelf Research, 1996, 16: 1415-1435.
[31] Zhang S N, Xiao R L, Liu F, et al. Effect of vegetation on nitrogen removal and ammonia volatilization from wetland microcosms[J]. Ecological Engineering, 2016, 97: 363-369.
[32] Kouki S, M’hiri F, Saidi N, et al. Performances of a constructed wetland treating domestic wastewaters during a macrophytes life cycle[J]. Desalination, 2009, 246: 452-467.
[33] Zhang S N, Liu F, Xiao R L, et al. Effects of vegetation on ammonium removal and nitrous oxide emissions from pilot-scale drainage ditches[J]. Aquatic Botany, 2016, 130: 37-44.
[34] Cronk J K. Constructed wetlands to treat wastewater from dairy and swine operations: A review[J]. Agriculture Ecosystems & Environment, 1996, 58: 97-114.
[35] Boyd C E. The dynamics of dry matter and chemical substances in apopulation[J]. American Midland Naturalist, 1971, 86: 28-45.
[36] DeBusk T A, Peterson J E, Reddy K R. Use of aquatic and terrestrial plants for removing phosphorus from dairy wastewaters[J]. Ecological Engineering, 1995, 5: 371-390.
[37] Clarke E, Baldwin A H. Responses of wetland plants to ammonia and water level[J]. Ecological Engineering, 2002, 18: 257-264.
[38] Leto C, Tuttolomondo T, Bella S L, et al. Effects of plant species in a horizontal subsurface flow constructed wetland–phytoremediation of treated urban wastewater withL. andL. in the West of Sicily (Italy)[J]. Ecological Engineering, 2013, 61: 282-291.
[39] Tao W D, Han J Q, Li H Y. Investigation into ammonia stress onand its impact on nutrient removal in microcosm experiments[J]. Journal of Environmental Management, 2015, 163: 254-261.
[40] Morgan J A, Martin J R. Performance of an ecological treatment system at three strengths of dairy wastewater loading[J]. Ecological Engineering, 2008, 33: 195-209.
[41] Zhang S N, Liu F, Luo P, et al. Does rice straw application reduce N2O emissions from surface flow constructed wetlands for swine wastewater treatment?[J]. Chemosphere, 2019, 226: 273-281.
Effect ofwetland on nitrogen removal from swine wastewater under different pollution loads
Zhu Huixiang1,2, Zhang Shunan1※, Peng Yingxiang3, Liu Feng1, Xiao Runlin1
(1.,,,,410125,; 2.,100049,; 3.,,410014,)
Pollutions caused by livestock industry have posed substantial concerns on ecological environment. The random discharge of swine wastewater has resulted in excessive nutrients transport to rivers and lakes, in turn inducing eutrophication of surface water. Given that China is one of the largest pork producers in world, the treatment of swine wastewater is becoming a very urgent issue. In this study, 9 pilot-scale surface flow constructed wetlands vegetated withwere constructed to treat swine wastewater, in order to investigate nitrogen removal effect and influence factors ofwetlands. The pilot-scalewetlands were exposed to swine wastewater under three strengths: low loading rates (swine wastewater diluted with fresh water at a 1:2 ratio), medium (swine wastewater diluted with fresh water at a 2:1 ratio), and high (pristine swine wastewater without dilution). Thewetlands were operated using an intermittent flow regime with a total volume of 180 L/d, and the theoretical hydraulic retention time was 33 d in the surface flow constructed wetlands. Water samples (inflow and outflow) were collected once a month from July 2014 to May 2015 for measuring ammonium nitrogen (NH4+-N), nitrate nitrogen (NO3--N), total nitrogen (TN), and chemical oxygen demand, and concurrently the water temperature, pH, and dissolved oxygen were determined in the field. Monthly sediment samples were collected to determine NH4+-N, NO3--N, TN, and dissolved organic carbon. The linear mixed-effect model was used to explore the key factors affecting NH4+-N removal in thewetlands. The results showed that during the whole test period (July 2014 -May 2015), the removal rates of NH4+-N and TN in low, medium, and high load wastewater were relatively high, where the removal rates of NH4+-N and TN were 85.0%-98.7% and 83.6%-97.1%, respectively. Nitrogen removal was different under different pollution loads, whereas, the removal rates of NH4+-N and TN decreased with the increase of pollution loads. The results of linear mixed model analysis showed that the key environmental factors affecting NH4+-N removal in the wetland were the dissolved oxygen and NO3--N in wastewater, and the content of NH4+-N in sediment, where the dissolved oxygen in wastewater presented the greatest impact on NH4+-N removal in the wetland. In every unit increased in the concentration of dissolved oxygen, the effluent concentration of NH4+-N decreased by 1.33% on average. With the accumulation of NH4+-N in sediment, the effluent NH4+-N concentrations increased significantly (<0.001). As the dissolved oxygen in wastewater decreased as the pollution loads increased, the sediment NH4+-N increased as well, indicating that the variation in nitrogen removal of different pollution loads in thewetlands. The removal rates of NH4+-N and TN in wetlands under different pollution loads were above 80.0%, although gradually decreased with the increase of pollution loads. Therefore, thecan be used as an ammonia-tolerant plant to treat high-load swine wastewater. The finding can provide a promising potential application ofwetlands in large-scale farms.
wastewater; nitrogen; aquaculture;; constructed wetland; pollution load; removal effect
朱辉翔,张树楠,彭英湘,等. 绿狐尾藻湿地对养殖废水中不同污染负荷氮去除效应[J]. 农业工程学报,2020,36(19):217-224.doi:10.11975/j.issn.1002-6819.2020.19.025 http://www.tcsae.org
Zhu Huixiang, Zhang Shunan, Peng Yingxiang, et al. Effect ofwetland on nitrogen removal from swine wastewater under different pollution loads[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(19): 217-224. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.19.025 http://www.tcsae.org
2020-06-17
2020-08-18
中国科学院战略性先导科技专项(XDA23020402;XDA23020502);国家自然科学基金(41771302);中国科学院重点部署项目(KZZD-EW-11)
朱辉翔,主要从事面源污染生态控制研究。Email:1300616513@qq.com
张树楠,助理研究员,博士,主要从事农业面源污染研究。Email:zhang-shu-nan@163.com
10.11975/j.issn.1002-6819.2020.19.025
X703
A
1002-6819(2020)-19-0217-08

