CaCO3改性BaSO4复合材料的制备及性能表征
杨强,李燕怡,崔孝炜
(商洛学院化学工程与现代材料学院/陕西省矿产资源清洁高效转化与新材料工程研究中心,陕西商洛 726000)
硫酸钡(BaSO4)是以天然重晶石为原料,经过物理粉碎、高温煅烧、化学浸取而制备的,因其光学性能佳、分散性好、粒径可控等优点,在造纸、涂料、高分子材料等行业具有广泛应用[1-4]。作为一种无机粉体填充剂,BaSO4粒子因内聚能过高,在干燥过程中容易发生团聚现象,从而使其性能降低[5]。因此,从开拓BaSO4应用领域而言,需要对其进行改性处理。BaSO4的改性方法主要分为物理机械法和化学改性法两大类,化学改性法因改性剂种类丰富、选择性高、改性条件简单而受到广泛关注[6-8]。目前,常用的化学改性法包括偶联剂改性法[9]、表面活性剂改性法[10]、复合改性剂改性法[11]、表面沉积改性法[12]、无机物包覆改性法[13]。
表面沉积改性法通过吸附、接枝等作用在BaSO4表面形成包覆层,并利用包覆层无机物的排斥作用,以此改善BaSO4粉体的分散性、沉降性。王新星等[14]利用酸性水解法在BaSO4表面形成SiO2包覆层,并研究了其包覆机理。结果表明,SiO32-在酸性条件下逐步解离,Si—O则以二聚体的形式沉积在BaSO4表面,以此提高BaSO4复合材料的分散性。因此,利用表面沉积法在BaSO4表面形成一层无机物包覆层,可以有效改善BaSO4的性能。
本研究以商洛市BaSO4粉体为原料,利用CaCO3为改性剂,采用表面沉积法对BaSO4进行包覆改性,研究反应温度、改性剂浓度对BaSO4的包覆效果、粒径分布、沉降时间、活化度的影响,以此讨论其分散性的改善效果。
1 材料与方法
1.1 原料及试剂
BaSO4(工业级,商洛某公司提供),Na2CO3(AR,成都市科隆化学品有限公司),CaCl2(AR,成都市科隆化学品有限公司),EtOH(AR,天津市富宇精细化工有限公司)。
1.2 实验方法
1.2.1 溶液的配制
配制1%BaSO4溶液,在恒温30℃下分散30min,备用。分别准确配制 1,2,3,4,5 mol·L-1Na2CO3溶液和 1,2,3,4,5 mol·L-1CaCl2溶液。
1.2.2 CaCO3改性BaSO4复合材料的制备
移取10 mL BaSO4分散液,分别搅拌并滴加等体积 1,2,3,4,5 mol·L-1CaCl2溶液,再逐滴加入等体积 1,2,3,4,5 mol·L-1Na2CO3溶液,恒温反应2 h,陈化4 h,过滤,用EtOH洗涤2~3次,105℃烘干。其余90℃改性样品重复上述操作。
1.2.3 测试表征
采用Vectory-22型傅里叶红外光谱仪(FT-IR)对样品进行结构分析;采用X'Pert-Powder X射线衍射仪(XRD)对所制备的样品进行物相分析,测试条件为CuKα,电压为 40 kV,扫描速度为 0.2(°)·s-1;采用 S-4800型扫描电镜(SEM)对样品进行表面分析,Pt处理;采用Mastersizer 3000粒度分析仪对改性样品进行粒径分布分析。
1.2.4 沉降时间的测定
称取1 g CaCO3改性的BaSO4复合材料,加入盛有50 mL H2O的量筒中,分散1 h,分别记录样品的沉降时间。
1.2.5 活化度的测定
称取0.3 g CaCO3改性的BaSO4复合材料,置于盛有60 mL H2O的烧杯中,在45 Hz、25℃条件下超声分散5 min,再静置30 min,待溶液体系环境不再变化时,分别将沉淀物和烧杯烘干至恒重,室温下再次冷却至恒重。按照式(1)计算活化度:
式中,m2表示沉淀物和烧杯干燥至恒重后的质量,g;m1表示烧杯干燥至恒重后的质量,g;m表示样品原质量,g。
2 结果与讨论
2.1 SEM分析
不同改性条件下,改性BaSO4复合材料的SEM图如图1、图2所示。从图1、图2发现,经不同温度、浓度CaCO3改性后,不仅能发现BaSO4晶体结构,也能看出CaCO3沉积在BaSO4表面,说明上述反应条件均能形成CaCO3包覆层,并以此对BaSO4进行改性。从图1发现,在25℃下,复合改性材料分布相对分散,当 CaCO3浓度为 1 mol·L-1时,BaSO4表面沉积的改性剂较少(图1(a)),而随着改性剂浓度逐渐增大,CaCO3在BaSO4表面的沉积量逐渐增大,当浓度为5 mol·L-1时,改性BaSO4复合材料出现了明显的团聚现象(图1(e))。

图1 25℃下CaCO3改性BaSO4复合材料的SEM图
而从图2可以看出,在90℃改性温度下,CaCO3的沉积量明显增大。随着浓度的增大,BaSO4表面的改性剂包覆层相对更厚,团聚效应更明显,当改性剂浓度为5 mol·L-1时,因空间位阻效应的影响,CaCO3沉积层出现了脱落现象(图2(e))。对比图1和图2的微观形貌,可以发现90℃改性后,复合材料的比表面积、沉积量均能获得较好改善,但是更容易发生团聚现象。

图2 90℃下CaCO3改性BaSO4复合材料的SEM图
2.2 FT-IR分析
从图3所示的红外光谱图中可以看出,650,670,1160 cm-1附近是 SO42-的特征吸收峰,3 420 cm-1附近归属于BaSO4吸潮后-O-H-的振动峰。经CaCO3改性后,1 500 cm-1处发现了CO32-的特征振动峰,在1 390 cm-1处出现了明显的特征峰,归属于-C-O-键的非对称伸缩振动,同时在700 cm-1到800 cm-1处的特征峰归属于-C-O-键的对称伸缩振动。其次,从图3中还可以发现,在相同温度下,随着反应浓度的增加,CaCO3的特征峰强度逐渐减弱,说明随着CaCl2溶液和Na2CO3溶液浓度的增加,所生成的CaCO3之间空间位阻斥力逐渐增大,导致CaCO3吸收峰强度逐渐减弱。另外,结合SEM的分析结果,对比在 25 ℃(图 3(a))和 90 ℃(图 3(b))下的改性样品,均能发现CaCO3的特征吸收峰。与SEM的分析结果相结合,表明在上述反应条件下,均能在BaSO4表面形成CaCO3包覆层。

图3 CaCO3改性BaSO4复合材料的FT-IR谱图
2.3 XRD分析
图4是不同改性条件下,BaSO4复合材料的XRD谱图。从图4中可以看出,2θ=22.8°,32.8°,44.0°,48.9°归属于 BaSO4的特征衍射峰,分别对应 111,211,041,330 晶面。而 2θ=29.0°,35.2°,42.7°,57.0°归属于 CaCO3的特征衍射峰,上述分析也佐证了SEM和FT-IR的结果,说明成功制备了CaCO3包覆改性的BaSO4复合材料。其次,对比不同改性条件下复合材料的XRD谱图,BaSO4的特征衍射峰位置并未发生变化,只是部分衍射峰的强度有变化,说明改性过程不会改变BaSO4的晶体结构。但经过90℃处理后,2θ=42.7°处归属于CaCO3的特征衍射峰强度变弱,表明90℃下不利于CaCO3包覆层的沉积,这与FT-IR的分析结果相似。
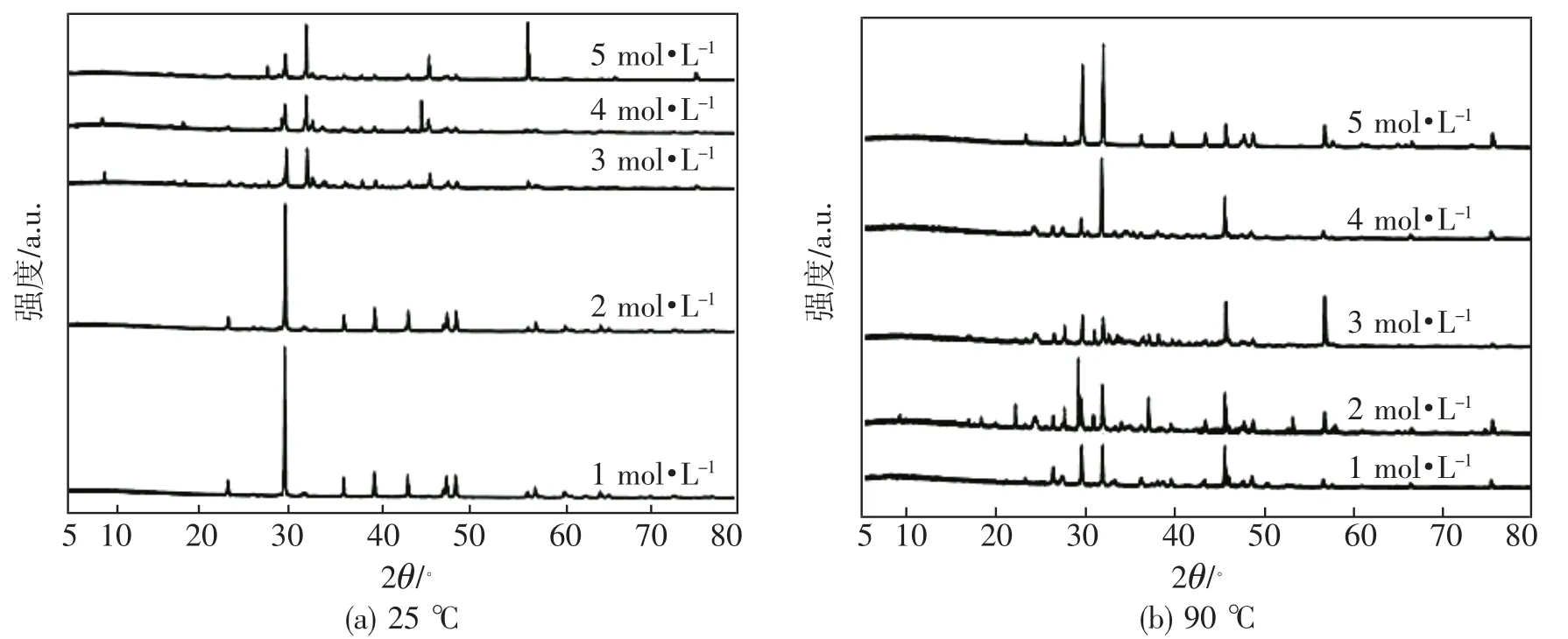
图4 CaCO3改性BaSO4复合材料的XRD谱图
2.4 不同改性条件对粒径分布的影响
从图5所示的粒径分布图中可以看出,在同一改性温度下,随着改性剂浓度的增大,BaSO4复合材料的粒径分布均呈现出线性增大趋势。在25℃改性条件下,BaSO4复合材料的粒径主要分布在1 000~2 000 nm处,分布范围较窄且分布均匀。结合图4(a),发现当浓度为1 mol·L-1时,CaCO3在BaSO4表面的沉积量较少,复合材料的粒径几乎接近于BaSO4粉体的粒径。从图5(a)可以看出,在25℃下,CaCO3改性浓度为2 mol·L-1时,粒径分布最窄。其次,从图5(b)可以看出,经90℃高温改性后,虽然BaSO4复合材料的粒径分布呈现出线性增大趋势,但粒径主要分布在2 000~5 000 nm,其粒径分布较宽且不均匀。当浓度为5 mol·L-1时,粒径分布区间几乎与1 mol·L-1条件下重合,原因在于,随着温度、浓度上升,CaCO3沉积层的空间位阻效应愈来愈大,导致大部分CaCO3从BaSO4表面脱落,这与SEM的分析结果相似。上述结果说明,25℃是适宜的改性温度,且具有较好的分散性。

图5 CaCO3改性BaSO4复合材料的粒径分布
2.5 不同改性条件对活化度的影响
由表1可知,25℃改性后,BaSO4复合材料的活化度随着改性剂用量的增加,呈现出先增大后减小的趋势,当改性剂浓度为2 mol·L-1时,具有最佳的活化度,达到了88.2%。其原因在于,当改性剂浓度较小时,只有少量改性剂能附着于BaSO4表面;而改性剂浓度过大时,会造成BaSO4与改性剂粘连和团聚,不利于分散,导致活化度降低。其次,从改性温度角度而言,经90℃改性后,不同浓度下BaSO4复合材料的活化度集中在47%~48%区间,均低于25℃下的改性效果,可能的原因是高温条件下,不适宜CaCO3沉积在BaSO4表面。

表1 不同浓度CaCO3不同温度改性后的活化度
2.6 不同改性条件对沉降时间的影响
沉降时间与样品分散性的改善效果密切相关。由表2可知,25℃下改性BaSO4复合材料的沉降时间随着改性剂用量的增加,呈现出先升后降的趋势,当改性浓度为2 mol·L-1时,沉降时间达到最大值,为7.5 h,较未改性样品提高了5 h,说明在该条件下,CaCO3改性BaSO4复合材料具有最佳的分散性。而当改性温度为90℃时,改性材料的平均沉降时间为5.7 h,改善效果不佳,均低于25℃的改性效果。结合上述结果,认为温度为25℃,浓度为2 mol·L-1是最适宜的改性条件。

表2 不同浓度CaCO3不同温度改性后的沉降时间
3 结论
采用表面沉积法,以CaCO3为改性剂对商洛BaSO4进行了包覆改性,并研究了改性温度、浓度对复合材料分散性的影响。SEM测试表明,随着改性温度、浓度的增大,因空间位阻的影响,改性剂会发生脱落现象;粒径分布结果表明,改性复合材料的粒径在25℃下分布较窄且均匀,集中在1 000~2 000 nm。活化度和沉降时间测试结果发现,当改性条件为 25 ℃,2 mol·L-1时,具有最佳的改性效果,其活化度可达88.2%,沉降时间长达7.5 h,这对BaSO4复合材料的工业化生产具有一定的指导意义。

