一种建立骨肿瘤肺转移模型的方法研究
白磊鹏 吕家兴 李哲宏 孔令伟 曹海营 金 宇
骨与软组织肉瘤均来源于间叶组织,其转移方式几乎都是血道扩散,肺因为双重血供的特殊解剖结构,是骨与软组织肉瘤早期转移的好发部位[1, 2]。恶性骨肿瘤肺转移率高达1%~9%,高度恶性的骨原发性肉瘤患者在确诊时15%~20%肺部有微小转移病灶[3, 4]。临床中对于骨与软组织肉瘤的治疗,尤其是出现肺转移的患者,需要多学科联合治疗,延长生存时间,但此类患者的预后都较差[5]。由于骨与软组织肉瘤发生肺转移的患者病情十分复杂,涉及多个系统,在基础实验中缺乏理想的骨肿瘤肺转移动物模型,导致骨肿瘤肺转移的相关研究较少见。因此,建立一种稳定的恶性骨肿瘤的肺转移动物模型对于研究其发生机制、生物学特性、治疗方法等具有十分重要的意义。
目前,骨肿瘤常用的动物模型有小鼠模型、裸鼠模型等,而大型哺乳类动物模型常用兔VX2骨肿瘤模型[6~8]。理想的恶性骨肿瘤的肺转移模型应与人类的肺转移发生的机制相同或接近,在局部浸润、转移方式等方面具有代表性,且对于肺部的观察简便易行。VX2肿瘤细胞是由Shope病毒诱导的人乳头瘤来源的鳞状细胞癌,经过72代移植后形成[9]。大量研究表明,兔VX2肝肿瘤生长迅速,可以接种到肺、肝、肌肉或骨骼[10]。VX2兔骨肿瘤模型具有人类恶性骨肿瘤类似生物学特性,可用于模拟人骨肿瘤的增殖和转移过程[11]。因此,本研究选择在制作兔VX2骨肿瘤动物模型的基础上,探究一种建立骨肿瘤肺转移的动物模型的方法,以精准地体现骨肿瘤肺转移的发生、发展过程,可以更好地了解其生物学特性,为今后的相关研究提供参考。
材料与方法
1.动物和瘤株:普通级日本大耳白兔31只,雌雄不限,月龄2.5个月,体质量2.0~2.5kg。购自北京市昌扬西山养殖场,实验动物许可证号:SCXK(京)2016-0007。所有实验兔喂养环境温度为25℃,湿度为50%。维持12/12h的光/暗周期,室内通风良好,食物和水的获取受到限制(每天2次)。VX2肿瘤细胞株购自重庆蒙博生物科技有限公司,实验地点为承德医学院附属医院中心实验室。本研究遵循承德医学院实验动物保护和使用要求,遵循医学伦理学要求。
2.VX2肿瘤组织块的制备:在常温常压环境中,由两名实验员将VX2肿瘤细胞组织植入1只日本大耳白兔左大腿肌肉处。3周后,肿瘤生长至3cm×3cm×3cm肿块。经耳缘静脉注射1%戊巴比妥钠(35mg/kg)麻醉,以兔角膜反射消失为麻醉成功标志。去除肿瘤区兔毛,俯卧位固定于动物实验操作台上,碘伏消毒术区,铺盖无菌孔巾,切开皮肤,分离皮下组织、肿瘤。将肿瘤完整取出后移至无菌工作台上,置于37℃的PBS中清洗3遍,去除肿瘤中血迹、坏死组织和纤维组织,眼科剪将肿瘤剪成1mm×1mm×1mm的组织块,置于含10%的胎牛血清中,常温常压下临时存放备用。
3.VX2骨肿瘤模型的制作:30只日本大耳白兔术前4h禁食水,经耳缘静脉注射1%戊巴比妥钠(35mg/kg)麻醉,后肢备皮仰卧位固定于操作台上,碘伏消毒3遍后铺无菌孔单。选取左侧膝关节内侧皮肤做一1cm长切口,逐层切开皮下组织和筋膜,暴露髌韧带,纵行钝性分离髌韧带,显露胫骨平台,在胫骨平台面用1mm克氏针钻孔,用顶棒将体积为1mm3的VX2肿瘤组织块沿套管推入胫骨髓腔内,拔出套管,骨蜡封堵骨孔,无水乙醇冲洗骨孔周围组织3遍,每次保留无水乙醇浸泡1min以上,两侧髌韧带缝合重建后,逐层缝合切口,模型制作完成。缝合后连续3天大腿肌内注射青链霉素混悬液预防感染,模型制作完成。以上操作于中心实验室动物实验间完成,实验间设备及环境由专业人员定时清理消毒。
4.局部转移和肺转移的观察:在建模完成后,每周对左侧胫骨进行1次X线检查,连续2周。由高年资骨肿瘤临床医生做出评估,肿瘤生长速度,骨皮质破坏及局部转移显影情况与临床患者表现差异。第1周随机选取15只家兔1%戊巴比妥钠(40mg/kg)腹腔注射麻醉后经耳缘静脉空气栓塞处死,解剖获取肺脏大体病理标本,由病理科医生进行固定、包埋、切片、苏木精-伊红(HE)染色。镜下观察VX2肿瘤在肺组织中表现与周围正常组织的关系。第2周同样方法处死剩余家兔后取材后经HE染色镜检。取材操作于中心实验室动物实验间完成,HE染色及镜检由医院病理科医生于病理实验室完成。
结 果
30只家兔肺中均出现肿瘤组织,建模成功率100%。30只家兔第1周胫骨X线显示肿瘤在髓内生长迅速,出现骨膜反应;第2周3只家兔肿瘤浸润至骨外。大体解剖可见,第1周,15只家兔全部可在肺部见多发肿瘤结节,主要分布在肺部边缘处,从肺边缘向肺门逐渐减少;第2周,15只家兔全部肺部布满肿瘤结节,明显多于第1周。HE染色镜下,肿瘤细胞在肺脏中聚集成巢,结节中心为坏死细胞,周围为核大深染的肿瘤细胞和炎性细胞,肿瘤细胞与正常肺组织间边界不清晰(图1)。
讨 论
骨与软组织肉瘤是来源于骨骼、肌肉、脂肪、血管及纤维结缔组织等间叶组织的恶性肿瘤,肺是骨与软组织肉瘤最常见的转移部位[12, 13]。骨与软组织肉瘤早期几乎全部经血源性扩散转移到肺部。据相关报道,15%~20%的骨与软组织肉瘤患者会发生远处转移,其中肺转移者可达90%[14, 15]。发生肺转移的恶性骨肿瘤患者的预后极差,这种结果一方面是由于恶性肿瘤复杂的生物学特性引起的,另一方面显示了目前对于恶性骨肿瘤的远处转移的研究不足[16]。
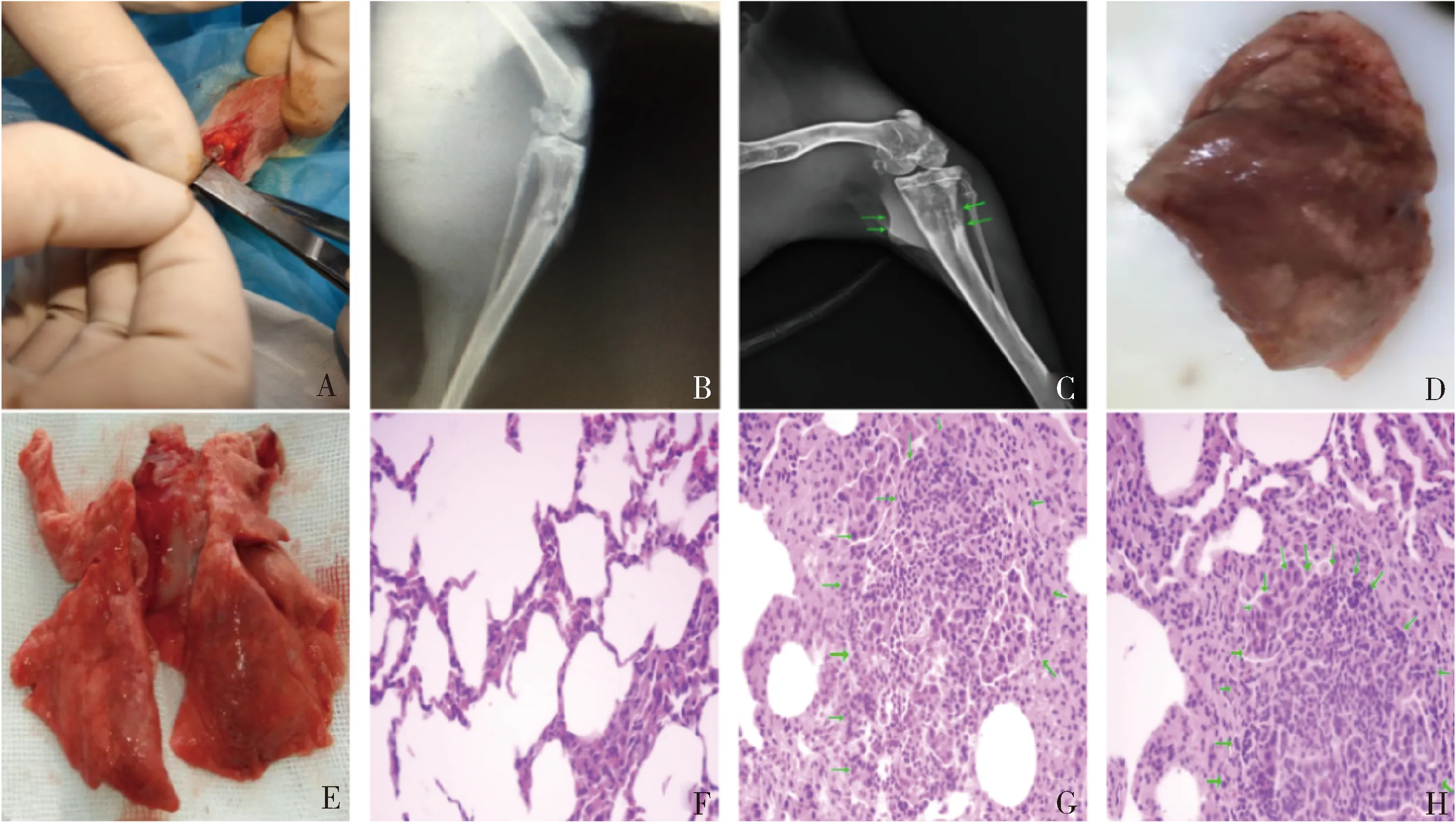
图1 骨肿瘤肺转移模型的制作和检测A.经胫骨种植VX2肿瘤;B.第1周X线示肿瘤在髓腔内生长,破坏骨皮质;C.第2周X线示肿瘤浸润至骨外;D.第1周,肺转移结节分布从肺边缘至肺门逐渐减少;E.第2周,P肺转移结节布满全肺;F.镜下正常肺组织(HE,×40);G.第1周肺组织肿瘤结节(HE,×40);H.第2周肺组织肿瘤结节(HE,×40)
目前,临床中治疗骨与软组织肉瘤肺转移的方法主要有外科手术切除、局部消融、放疗、化疗、分子靶向治疗以及最新兴起的免疫治疗等[17]。这些治疗大多具有良好的近期效果,但是远期疗效尚未有明显的改善。因此,建立符合人类骨与软组织肉瘤肺转移的动物模型可以精准地体现肿瘤在病患体内的发生、发展过程,可以更好地了解肿瘤肺转移的生物学特性,对于制定个体化治疗方案及肿瘤肺转移的基础和临床研究具有重要意义。理想的骨与软组织肉瘤肺转移模型,应与人类的肺转移过程具有相同或相近的生物学行为,在局部扩散、远处转移、肺部浸润等方面提供临床研究价值。研究表明,兔VX2肿瘤生长迅速,可以接种至骨骼制成恶性骨肿瘤动物模型。同时,VX2肿瘤细胞转移到肺部后可以早期产生淋巴结转移[11, 18]。这表明VX2兔骨肿瘤模型具有相关生物学特性,可用于模拟人转移性骨肿瘤。
兔胫骨VX2骨肿瘤肺转移动物模型的优点:①操作简便,时间短;②创伤小;③肺部无损伤;④自发转移过程符合肿瘤特性;⑤成模率高。以往的肺部植瘤模型,需要根据肺部解剖对植瘤部位和方式进行严密操作,植瘤术后并发症高,易造成动物死亡。而兔胫骨VX2骨肿瘤肺转移模型不需要对肺部进行操作,只需在胫骨植入肿瘤,随着肿瘤的自发转移过程,1周即可获得肺转移瘤模型,其操作步骤十分简单,手术创伤也仅在胫骨植瘤部位留下1cm左右的切口,手术不会对肺部造成损伤。肿瘤肺转移的过程是肿瘤生物学特性的表现,避免了肺部植瘤的手术干扰因素。更小的创伤使得动物更易耐受手术操作,降低了动物的死亡率,因此成模率极高,本实验中,30只家兔全部建模成功,已证明了这一点。对植瘤的胫骨X线检查发现,在第1周时,肿瘤在髓腔内迅速生长,并且出现骨膜反应;第2周时,部分家兔胫骨中肿瘤已浸润至骨外,扩散到周围软组织中。通过大体解剖发现,在第1周时,尽管肿瘤还在髓腔内生长,但是肺部已经出现肺缘分布的肿瘤结节,而第2周时,肿瘤基本上布满全肺。病理切片镜下观察,可见肺组织中成团落聚集的肿瘤结节,HE 染色中心区域为坏死细胞,呈嗜碱性红染,外周表现为浓染的肿瘤细胞、结缔组织和炎性细胞,这与以往研究中的VX2肿瘤细胞的镜下表现相同[19]。
总结本方法建模的经验:①简化操作,减小创伤,可以极大提高动物植瘤后的成活率;②通过向胫骨内植入较大的肿瘤组织块,可以加速肿瘤生长,更快获得肺转移模型;③通过胫骨植瘤的肺转移模型,可以避免种植瘤的局部浸润影响对远处转移的观察;④肿瘤的远处转移是一个动态的过程,该生物学行为在植瘤后第1周内即可发生。
综上所述,本研究采用经胫骨移植VX2肿瘤组织块,建立兔胫骨骨肿瘤模型,肿瘤在胫骨髓腔内生长至一定程度后发生远处转移,形成肺转移瘤模型,该方法避免了肺部的损伤,保留了肺部的完整结构,且获得的病理标本均为多发的肺肿瘤结节,这与临床中肺转移瘤的特性相同,可以较为真实地研究恶性骨肿瘤肺转移的生物学行为[20]。该模型制作方法简单,成功率高,在构建途径、生长方式和病理上均接近于人类恶性骨肿瘤肺转移过程,能全面表现肿瘤浸润、转移全过程,值得在基础研究中推广。
本研究的不足之处在于缺乏肺部完整的影像学资料。VX2肿瘤细胞虽然是基础研究较为成熟的造模瘤株,但恶性骨肿瘤多为间叶组织来源,而VX2肿瘤细胞是鳞状细胞癌,其生物学特性与恶性骨肿瘤比较,仍存在许多差异,因此本研究仅对制作骨肿瘤肺转移模型的方法具有一定的参考价值,而对于恶性骨肿瘤的肺转移参考价值有限。

