20~30mm磨玻璃肺结节的影像学特征及术后病理分析
苏 雷 张 毅 李元博 钱 坤 王腾腾
肺部磨玻璃密度影(ground-glass opacity,GGO)是基于高分辨率计算机断层扫描(HRCT)技术的一个以局灶性、不遮蔽肺血管或支气管结构、朦胧的不透明区域为特征的影像学表现[1~4]。对以GGO的定性诊断和外科治疗策略成为临床研究的热点。本课题组曾在2013、2015和2017年报告了孤立性肺结节的胸腔镜治疗结果[3]。在此基础上,笔者对2017年1月~2019年12月手术治疗的29例20~30mm磨玻璃肺结节患者的影像学特征和术后病理结果等临床资料进行回顾性分析。
资料与方法
1.临床资料:(1)患者一般数据:本组29例患者中,男性13例,女性16例。患者平均年龄为64.7岁(49~78岁)。随访观察时间4~2190天,平均随访观察时间为261.76天,详见表1。(2)患者影像学数据:术前患者胸部影像学数据除3例来自外院PETCT结果,26例均来自笔者医院影像科CT扫描数据。收集在肺窗(设定条件120kV,110mAs)表现为最大径>20mm且≤30mm的纯GGO(pure GGO,p-GGO)和CTR(consolidation/tumor ratio)≤0.3的GGO(heterogeneous GGO,h-GGO)。GGO的影像学特征包括的形态、边缘征象、内部征象、PETCT和动态观察结果。
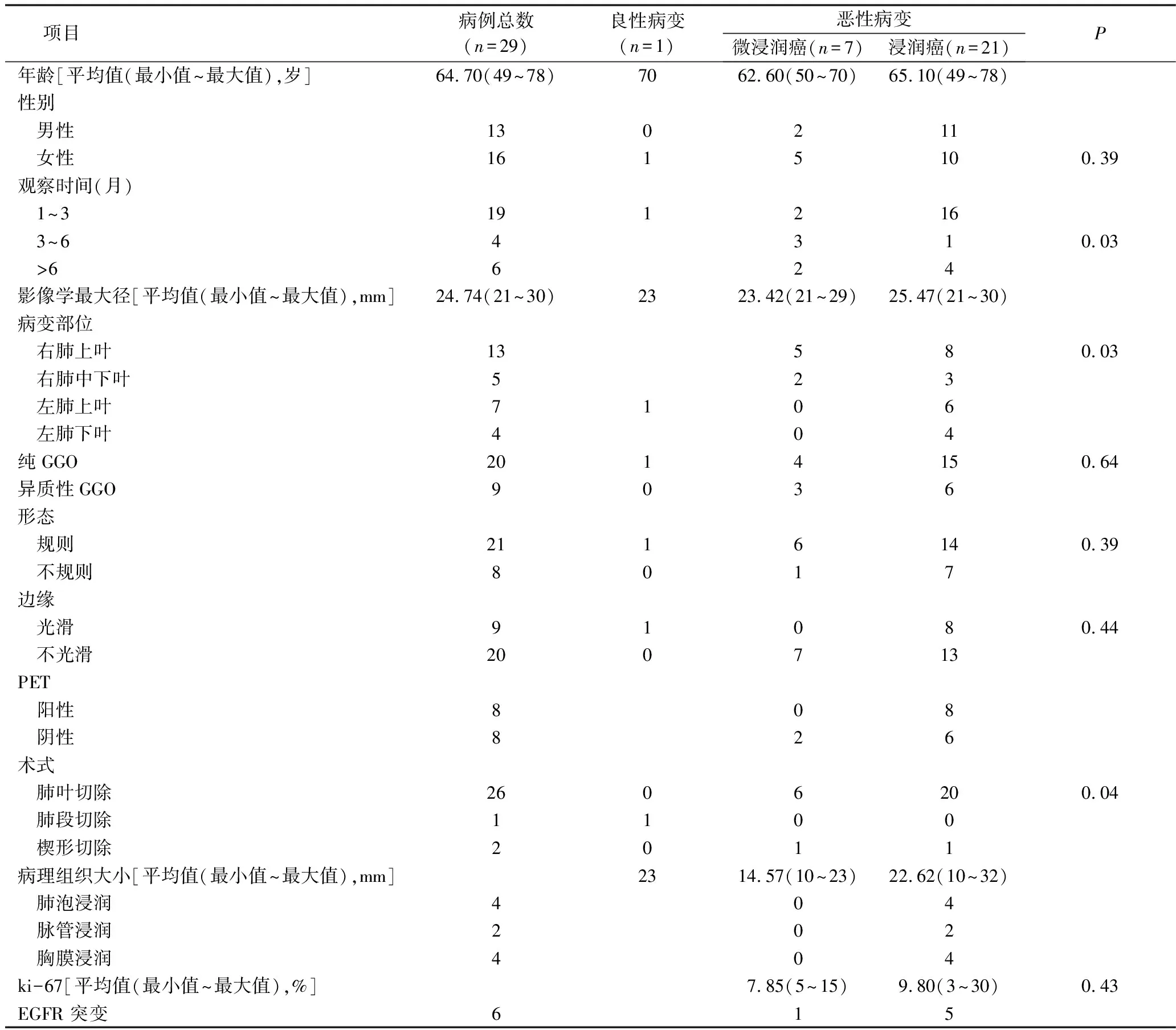
表1 一般临床资料
2.手术方法:根据术前定位标志或术前规划确定病变部位并在术中获得病变组织,对于周围性GGO,用内镜切割缝合器(Endo-GIA)或铥激光距病变2cm处楔形切除病变所在部位肺组织;对于肺实质内深在的GGO病变,通过解剖肺段切除的方法获取病变组织[3]。根据术中冷冻病理结果及患者耐受情况确定术式。
3.术中及术后病理:由首都医科大学宣武医院病理科胸部肿瘤专业组医师做常规病理诊断和分子病理分析。着重描述病灶大小、病理及亚型分析、细胞核增殖指数ki-67、是否发现淋巴结转移或脏层胸膜或肺泡内或脉管润浸润、9组基因检测。
结 果
1.患者基本情况:29例患者中有男性13例(44.83%),女性16例(55.17%)。年龄<50岁患者1例(3.45%),50~65岁患者12例(41.38%),65~80岁患者16例(55.17%),详见表2。

表2 纯GGO与异质性GGO的临床资料分析
2.影像学特征:29例患者中,病变位于右肺上叶13例,右肺中叶例,右肺下叶5例,左肺上叶6例,左肺下叶4例。在胸部CT扫描中发现GGO的最大径均值为24.74mm(21~30mm)。病变形态:呈圆形或椭圆形的GGO 21例(72.41%),不规则形态的GGO 8例(27.59%)。边缘光滑的GGO 9例(31.03%),呈分叶状或毛刺等边缘不光滑的20例(68.97%);观察到有胸膜牵拉征象16例(55.17%)。p-GGO病例20例,CTR<0.3的h-GGO病例9例(表2)。观察到血管征象的18例(62.07%)。从发现肺部GGO至住院治疗的时间为4天~6年。23例GGO在随访期间的影像学特征变化不明显;1例出现密度增高;5例表现为病变最大径的变化,其中3个月内增大(增大2mm)2例,1年内增大(增大5mm)3例。16例患者在术前选择了PETCT检查,其中有8例GGO病灶SUVmax均值为2.68(0.98~6.75)。
3.切除范围:全组术式包括亚肺叶切除3例(楔形切除术2例,肺段切除术1例),肺叶切除术26例,附加系统淋巴结切除21例。
4.术后病理:29例患者中有1例为硬化性肺泡细胞瘤;28例为恶性GGO(96.55%),包括7例微浸润腺癌(minimally invasive adenocarcinoma, MIA)和21例浸润期肺癌(invasive adenocarcinoma, IA),其中观察到肺泡内肿瘤细胞浸润4例,脉管浸润2例,脏层胸膜浸润(T2)4例。没有发现N1和N2病例。7例MIA的病灶最大径均值为14.57(10~23)mm,21例IA病灶均值为22.62(10~32)mm,小于HRCT影像学显示数据23.42(21~29)mm和25.47(21~30)mm。有1例IA病灶最大径(32mm)大于其影像学的检查结果(28mm)。在28例恶性病变中可以观察到24例呈现明确的病理亚型,其中贴壁为主型(lepidic predominant pattern, LPP)15例(62.5%),腺泡为主型(acinar predominant pattern, APP)7例(29.17%)和乳头为主型(papillary predominant pattern,PPP)2例(8.33%)。3种亚型发生肺泡内浸润的例数为2、1和1例;发生脉管浸润的例数为1、0和1例;脏层胸膜浸润的例数分别为2、0和2例,详见表3。通过对术后病变组织的特殊免疫组织化学染色,可以观察到在MIA和IA病理组织ki-67指数的不同,分别为7.85%和9.80%。在LPP、APP和PPP亚型的ki-67指数分别为8.53%、11.86%和12.50%(表3)。在MIA和IA组织中的EGFR突变例数分别为1例和5例,主要为19外显子的L858R/L861Q。在LPP、APP和PPP的EGFR突变例数分别为4、1和0例。
5.术后治疗及随访:本组中28例病理报告为恶性肿瘤的GGO患者术后均行术后随访。目前随访时间为1~3年,未发现复发病例。
讨 论
GGO作为肺结节一种常见的影像学表现越来越受到临床医生的关注[2,5~9]。Kakinuma等[5]在2016年提出的针对GGO影像学特征的“三分类法”被业界普遍接受,第1类是纯GGO(p-GGO),第2类是仅在纵隔窗可见实性成分的异质性GGO(h-GGO),第3类就是在肺窗和纵隔窗均可见实性成分的部分实性GGO(part-solid GGO)。在2016年更新的针对非小细胞肺癌的TNM分期(第8版),已经把Part-solid GGO实性成分的大小作为“T”分期的标准,但没有包括p-GGO和h-GGO[4,5~7,10]。Suzuki等[8]认为,GGO的实性成分才是影响预后的独立因素,“不适合”把p-GGO和h-GGO列为“T1a”。有文献提出GGO属于“惰性”的癌前期病变[5,8~11]。
本研究纳入的20例p-GGO和9例h-GGO的术后病理结果,只有1例为硬化性肺泡细胞瘤的良性病变。在其余28例恶性病变中包括了7例MIA和21例IA,而且观察到肿瘤细胞发生肺泡内浸润4例、脉管浸润2例、脏层胸膜浸润(T2)4例。已经不再是癌前期和非浸润期病变,而且肿瘤细胞的局部浸润被认为是肺癌局部复发和转移的高风险因素[1,4,7,9~12]。

表3 病理亚型的临床资料分析
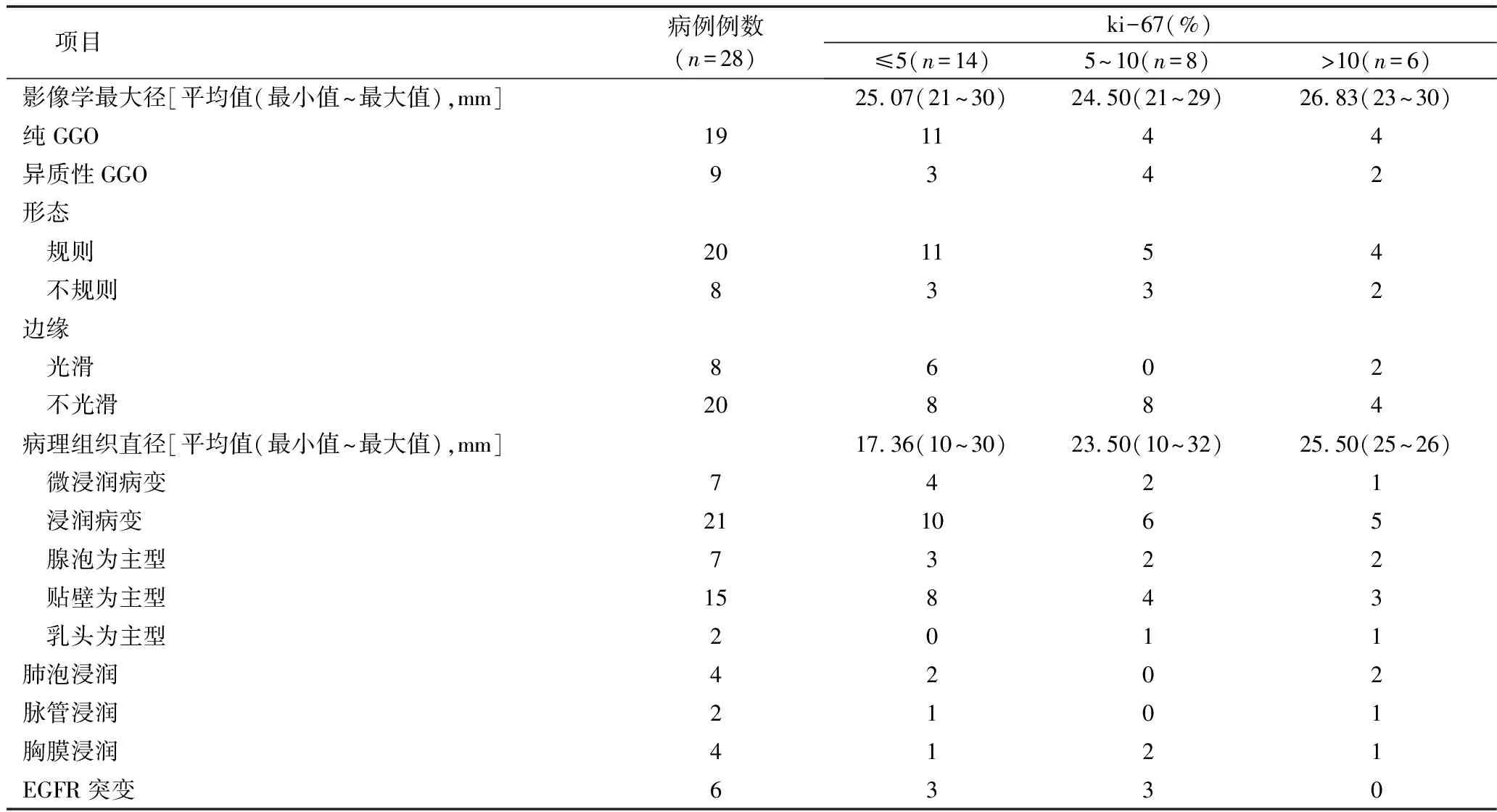
表4 GGO病灶组织细胞核增殖指数ki-67的临床资料分析
根据2011年国际肺癌研究协会(IASLC)发布的肺腺癌分类,笔者在术后病理组织切片中观察到以LPP亚型15例(62.50%),APP亚型7例(29.17%)、PPP亚型2例(8.33%)[7]。3种亚型中,APP 亚型有1例发生肺泡内浸润;LPP亚型中有1例仅发生肺泡内浸润,1例发生肺泡内伴脉管浸润,2例浸润脏层胸膜;PPP亚型中1例出现肺泡内、脉管和胸膜浸润,1例浸润脏层胸膜。这3种亚型的ki-67指数分别为8.53%、11.86%和12.50%,表明PPP亚型的肿瘤细胞有较快的生长速度。
从GGO的形态分析,有14例p-GGO和7例h-GGO呈形态规则的表现,其对应的术后病理:p-GGO病灶中硬化性肺泡细胞瘤1例、MIA3例、IA 10例;h-GGO病灶中,MIA3例、IA 4例。发现有肺泡、脉管、胸膜浸润例数为2、1、3例;ki-67均值为8.53%。脏层胸膜是否受累与病灶相邻胸膜的距离有关,在ki-67均值为8.53%的p-GGO中检出3例胸膜浸润的病例值得思考[6,11]。8例形态不规则的GGO,包括6例p-GGO和2例h-GGO,术后病理为MIA 1例、IA 7例,发生肺泡、脉管、胸膜浸润的例数为2例、1例、1例;ki-67均值为11.63%。即使以形态规则为影像学特征的p-GGO中,仍有66.67%(14例)为IA病例;在4例被检出发生胸膜浸润的病例中,包括了3例形态规则的p-GGO。这个结果与之前的文献报告不尽相同[5,7,11,12]。ki-67均值的不同,提示GGO形态与肿瘤细胞的生长速度有关,是否能够反映肿瘤细胞的浸润程度有待进一步观察。
从GGO的边缘特征分析:在20例(68.97%)呈分叶状和(或)短毛刺等边缘不光滑的GGO中包括p-GGO 11例、h-GGO 9例。对应的术后病理为MIA 7例、IA 13例(p-GGO:MIA 4例、IA 7例;h-GGO:MIA 3例,IA 6例);亚型分析:APP 5例(p-GGO 1例,h-GGO 4例)、LPP 9例(p-GGO 6例,h-GGO 3例)、PPP 2例(p-GGO 2例);肺泡、脉管、胸膜浸润例数为3例、1例、2例(均为p-GGO);ki-67均值为10.15%(p-GGO:8.91%;h-GGO:11.67%)。
胸膜牵拉征象也是评估GGO的重要影像学指标。呈胸膜牵拉征象的10例p-GGO和6例h-GGO的术后病理:MIA 4例(p-GGO 3例,h-GGO 1例)、IA 12例(p-GGO 7例,h-GGO 5例);亚型分析:APP 4例(p-GGO 1例,h-GGO 3例)、LPP 9例(p-GGO 6例,h-GGO 3例)、PPP 2例(p-GGO 2例);发现肺泡、脉管、胸膜浸润例数分别为3例、1例、2例,均为p-GGO;ki-67均值为11.13%(p-GGO为9.3%;h-GGO为14.17%)。
边缘相对光滑的9例GGO对应的术后病理为:硬化性肺泡细胞瘤1例、IA 8例;亚型分析:APP 2例、LP P6例;肺泡、脉管、胸膜浸润例数为1、1、2例;ki-67均值为7.25%。需要讨论的,9例边缘相对光滑的GGO,均为p-GGO,说明GGO的边缘征象与CTR比值有关。观察到边缘光滑、边缘单纯呈现毛刺和(或)分叶状、胸膜牵拉征象GGO的病理组织细胞的ki-67均值分别为7.25%、10.15%和11.13%。提示ki-67均值与肺结节的边缘征象有关。笔者发现在4例发现有脏层胸膜浸润的病例中,有2例为ki-67均值为12.5%的PPP亚型,另外2例为ki-67均值为7.5%的LPP亚型。这4例的影像学征象均为p-GGO表现,2例PPP呈现短毛刺和胸膜牵拉征象,另外2例LPP的则表现为边缘光滑的影像学征象。尚不能印证GGO的毛刺征或分叶征与发生胸膜浸润有关[5~7,9~11]。
与GGO形态和边缘征象比较,血管征象是在这组病例中除了CTR之外能够观察到的主要的内部影像学征象,占所观察病例的有62.07%(18例),包括10例p-GGO和8例h-GGO。10例p-GGO的术后病理为硬化性肺泡细胞瘤1例、MIA 1例、IA 8例,亚型分析:APP 3例、LPP 4例、PPP 2例,发生肺泡、脉管、胸膜浸润例数分别为1、0、3例,ki-67均值为7.56%;8例h-GGO的术后病理:MIA 3例、IA 5例;亚型分析:APP 4例、LPP 2例,未发现肺泡、脉管、胸膜浸润病例,ki-67均值为11.88%。其余11例无血管征象的GGO,包括10例p-GGO和1例h-GGO。前者对应的术后病理:MIA 3例、IA 7例;亚型分析9例:LPP 8例和PPP 1例,发生肺泡、脉管、胸膜浸润的例数为2例、2例、1例,ki-67均值为8.8%;1例h-GGO的术后病理为APP亚型,无局部浸润,ki-67值为10%。“血管贯穿”和“血管集束”是肺结节血管征较为常见的形式。有研究者认为“血管贯穿”征象是穿越肺间隔的静脉,“血管集束”征象与肺结节内部纤维成分的收缩有关[4,9,12]。在本组血管征象阳性的病例中没有观察到发生脉管浸润的病例,其ki-67均值也与阴性病例的均值类似(9.59% vs 8.91%,P=0.371),这两种现象也提示GGO的血管征象仅反映其所含纤维成分的多少而非其生长速度。
判断GGO是否“惰性”,不能忽视GGO自身的大小。本组病例中从发现肺部GGO至住院治疗的最短时间为4天,随访最长时间为6年,平均随访时间为262.00天,其中在6个月内接受手术治疗的患者较多(79.31% vs 20.69%,P=0.030)。在23例随访期间影像学特征变化不明显的GGO中,除1例病理报告为硬化性肺泡细胞瘤,余22例包括MIA 4例、IA 18例;亚型分析包括APP 6例、LPP 10例、PPP 2例,发现有肺泡、脉管、胸膜浸润例数为2例、1例、3例,ki-67均值为8.4%。有5例观察到病变最大径的变化,其中3个月内增大2例(均值2mm),1例为23mm的形态规则但边缘不光滑且有胸膜牵拉的p-GGO,1例为21mm的形态不规则、血管征阳性的h-GGO。术后病理均为MIA,ki-67均值为5%,其中胸膜牵拉征阳性的p-GGO发现有肺泡内浸润。1年内增大的病例包括26mm p-GGO 1例、23mm h-GGO 2例(均值为5mm),术后病理:MIA 1例、IA 2例;亚型包括APP 1例、LPP 2例,ki-67均值为13.33%,其中1例以p-GGO表现的LPP亚型累及脏层胸膜,2例以h-GGO表现的病变未发现局部浸润。有1例p-GGO在随访中表现密度略增高,术后病理为发生肺泡和脉管浸润、ki-67为3%的LPP亚型,也提示ki-67反映病灶的增长速度而非浸润程度。
在PETCT扫描显示代谢增高的8例GGO病灶中,有6例p-GGO和2例h-GGO。术后病理均为IA,ki-67均值为12.5%。以p-GGO表现的术后病理包括APP1例、LPP5例,ki-67均值为10%,其中1例LPP发生肺泡浸润;2例h-GGO的术后病理为APP亚型,未发现有局部浸润,ki-67均值为20%。PETCT阴性的8例GGO对应的术后病理为MIA 2例、IA 6例;亚型分析包括APP 3例、LPP 4例、PPP1例;发生肺泡内浸润2例、脉管浸润1例、胸膜浸润4例。发生局部浸润的例数高于PETCT阳性的病例,而ki-67均值(7%)明显低于PETCT阳性病灶的ki-67均值(12.5%)。这与上面观察到ki-67均值可能反映病灶的增长速度的现象相吻合,也提示GGO的PETCT阳性反映的是病灶肿瘤细胞的生长速度而非浸润程度。
综上所述,从以上的观察结果和分析可以看出,GGO作为胸部影像学的一种特殊表现,其静态征象中的边缘征象(形态、分叶征/毛刺征等)、内部征象(血管贯穿等)和周围征象(血管集束征和胸膜牵拉征等)以及动态观察和代谢检查(PETCT)尚不能完全作为鉴别良恶性和评估病变浸润程度的依据。在本组20~30mm的GGO中,恶性GGO所占比例为96.55%(p-GGO的95%)。即使是形态规则、边缘规整、动态观察中影像学特征没有明显变化的p-GGO也会发生局部浸润如肺泡内、脉管内甚至脏层胸膜的浸润(T2)。本研究观察到GGO的形态、边缘征象、内部征象、PETCT所反映的病灶代谢征象和动态观察征象,似乎与病灶组织细胞的ki-67均值的关系更为密切。应重视GGO的大小,是否应该重新审视把p-GGO和h-GGO排除在“T”分期的观点,还需要开展更多的临床数据分析予以证实。

