浙江省甜瓜根、叶部镰孢菌种类的分离与鉴定
郝芳敏 严蕾艳 臧全宇 马二磊 丁伟红 黄芸萍 王毓洪


摘 要:从宁波和台州的不同地区采集了具有发病症状的甜瓜根部和叶部样品,采用常规的组织分离法进行分离纯化,共获得32株镰孢菌,经过分子鉴定,利用ITS和TEF-1α序列构建系统进化树,分别包含11个尖孢镰孢菌(Fusarium oxysporum)、11个腐皮镰孢菌(F. solani)、4个厚垣镰孢菌(F. chlamydosporum)、4个共享镰孢菌(F. commune)和1个层生镰孢菌(F. proliferatum),其中尖孢镰孢菌占镰孢菌总量的34.38%,对其中1株尖孢镰孢菌菌株TG5进行致病力测定,认为其可以造成甜瓜的枯萎症状,该结果为明确浙江省的镰孢菌种类奠定了基础。
关键词:甜瓜;镰孢菌;分离纯化;分子鉴定
中图分类号:S652 文献标志码:A 文章编号:1673-2871(2020)11-013-05
Abstract: To identify the Fusarium species of Cucumis melo L. crops in Zhejiang province, symptomatic roots and leaves of the samples were collected from different areas in Ningbo and Taizhou. The Fusarium strains were isolated and purificated by the conventional tissue method. The total 32 isolates were isolated from the roots and leaves of the samples. Based on the sequences of ITS and TEF-1α, two phylogenetic trees were established, which were identified as 5 species of Fusarium, 11 isolates of Fusarium oxysporum, 11 isolates of F. solani, 4 isolates of F. chlamydosporum, 4 isolates of F. commune, 1 isolates of F. proliferatum, respectively. The species of F. oxysporum accounting for 34.38%. The pathogenicity of one strain TG5 of F. oxysporum was determined, which could cause the wilt symptoms of melon.
Key words:Cucumis melo L.; Fusarium; Isolation and purificated; Molecular identification
甜瓜(Cucumis melo L.)是葫蘆科一年生蔓生草本植物,又名哈密瓜、甘瓜、香瓜等,食用价值高,广受消费者喜爱,是世界十大水果之一[1-2]。西瓜甜瓜产业是浙江省十大农业主导产业之一,也是浙江省重要的经济作物,在浙江省的蔬菜瓜果产业中占有重要地位[3]。
但是,甜瓜病害一直是生产上的难题,尤其是甜瓜枯萎病。甜瓜枯萎病是由尖孢镰孢菌甜瓜专化型(Fusarium oxysporum f. sp. melonis)引起的一种真菌病害,是一种世界类土传维管束病害。甜瓜枯萎病又称为蔓割病、死秧、萎蔫病、疫病、死藤等,在甜瓜全生育期均可发生,其中,甜瓜开花期至坐果期是发病的高峰期,发病率在50%~70%[4]。甜瓜枯萎病常常造成植株的主根颜色变褐并出现腐烂的症状,空气湿度大时,根部甚至会出现粉红色或者白色的霉状物,田间一旦发现病株,病害会很快在田间蔓延,对甜瓜产业造成严重的经济损失。此外,其他镰孢菌属真菌也可引起甜瓜萎蔫及果实腐烂等症状,造成严重的经济损失[5-6]。例如腐皮镰孢菌(F. solani)可引起甜瓜根腐病[7];层生镰孢菌(F. proliferatum)和木贼镰孢菌(F. equiseli)可引起甜瓜根茎腐烂[8];砖红镰孢菌(F. lateritium)[9]、变红镰孢菌(F. incarnatum)[10]、木贼镰孢菌(F. equiseti)[11]均可引起甜瓜果腐病。此外,镰孢菌属真菌可以通过种子传播,也可在土壤中存活多年[12],对甜瓜品质造成严重损害。
笔者从浙江省宁波和台州两地发病的甜瓜根部和叶部采集了38个病样进行分离,获得了32个镰孢菌分离物,根据核糖体内转录间隔区(rDNA-ITS)和转录延伸因子(TEF-1α)的序列鉴定,以期进一步了解甜瓜根部镰孢菌的种类,为防控镰孢菌对甜瓜的危害提供理论基础。
1 材料与方法
1.1 供试培养基和试剂
马铃薯葡萄糖琼脂(PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 mL,121 ℃灭菌20 min。
PDB培养基:马铃薯200 g,葡萄糖20 g,蒸馏水1 000 mL,121 ℃灭菌20 min。
CTAB:CTAB 20 g,NaCl 81.82 g,1 mol·L-1 Tris-HCl (pH 8.0) 100 mL,0.5 mol·L-1 EDTA (pH 8.0) 40 mL,加蒸馏水定容为l L,121 ℃灭菌20 min。
1.2 采样和病原菌分离
2019年在浙江省宁波市、台州市甜瓜种植区采集甜瓜病根、病叶,在实验室对感病组织进行病原菌分离,方法为:将甜瓜病根、病叶切成小块,浸入1%次氯酸钠溶液中3 min,取出浸入75%酒精1 min,再使用无菌水冲洗3遍,吸干水分后,转移到含链霉素PDA培养基(培养基链霉素质量浓度为100 μg·L-1)上,在25 ℃的恒温培养箱中培养,直至长出真菌菌落后,用平板稀释法进行单孢分离,将分离的真菌分别进行纯化、保存。
1.3 DNA序列扩增及种特异性检测
DNA提取:采用CTAB裂解法提取菌株的DNA[13]。采用50 μL的PCR反应体系进行内部转录间隔区(Internal Transcribed Spacer,ITS)和翻译延伸因子-1α(Translation Elongation Factor 1α,TEF -1α)的PCR扩增,扩增ITS的引物ITS1/ITS4(ITS1序列:5?-TCCGTAGGTGAACCTGCGG-3?,ITS4序列:5?-TCCTCCGCTTATTGATATGC-3?),TEF-1α的引物EF1/EF4(EF1序列:5?-ATGGGTAAGGA(A/G)GACAAGAC-3?,EF2序列:5?-GGA(G/A)GTACCAGT(G/C)ATCATGTT-3?)。PCR产物采用1%的琼脂糖凝胶电泳法检测,对纯化阳性PCR产物进行克隆和测序[14]。
1.4 系统进化树的构建
将测序获得的ITS序列和TEF-1α序列在NCBI网站(http://www.ncbi.nlm.nih.gov/)上进行核酸序列比对,所有真菌的ITS序列和TEF-1α序列利用MEGA 7[15]软件的邻接法构建系统进化树,获得所对应的菌株分类地位。
1.5 致病力测定
病原菌孢子悬浮液的培养:将TG5菌株在PDA平板上培养3 d,用6 mm的打孔器在新鲜的菌丝边缘打孔,将15个6 mm大小的菌丝块,置于在200 mL的PDB培养基摇培40 h,补充转速和温度,两层擦镜纸过滤,孢子液稀释至4×106个·mL-1[16-17]。
接种:在甜瓜幼苗2叶1心时,以50株幼苗为1组,3次重复,一半接种,一半不接种。接种的将长势一致的幼苗從穴盘中取出,轻度损伤根系,洗净根部,在准备好的孢子液中浸根15 min,保持根系全部浸入,中间摇动2次,防止孢子沉降;不接种的在清水中浸根15 min。浸根接种后,幼苗移栽至营养土中。接种后前3 d保持遮阴,温度保持在25 ℃,3 d缓苗后撤掉遮阳网,剔除不正常的苗子,之后在温室正常管理,10 d后调查枯萎病发病情况[18]。
2 结果与分析
2.1 基于ITS序列进行的分子鉴定
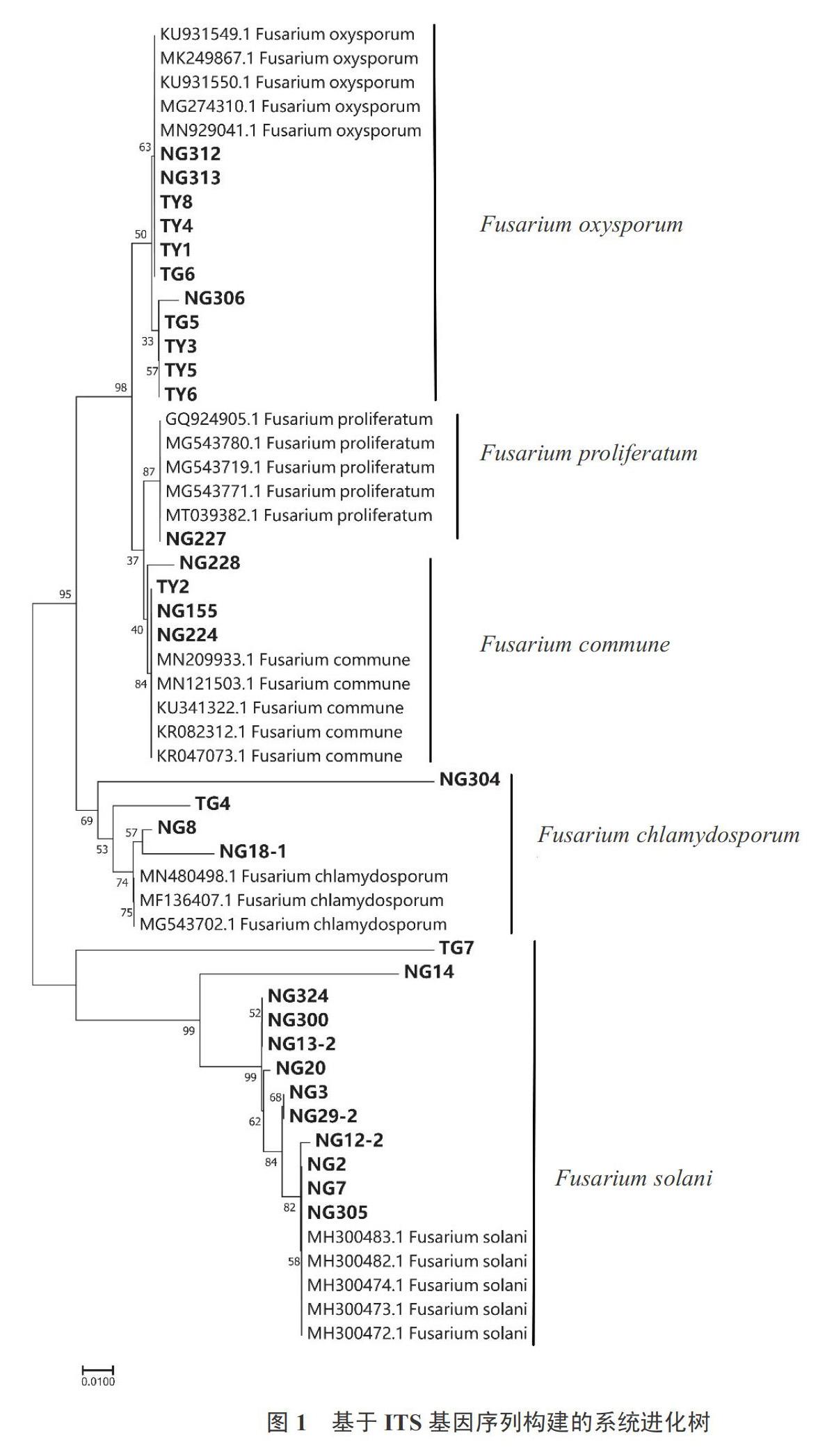
用ITS和TEF-1α引物扩增,将获得的片段纯化、连接、转化、测序,在NCBI中进行比对,共获得32个镰孢菌属真菌(表1)。系统进化树分析基于ITS序列构建的系统进化树表明,菌株NG312、NG313、NG306、TY1、TY3、TY4、TY5、TY6、TY8、TG5、TG6与F. oxysporum聚为一簇,属于尖孢镰孢菌(F. oxysporum),NG312、NG313和NG306分离于台州,其余8个菌株分离于宁波地区;菌株NG324、NG300、NG13-2、NG20、NG3、NG29-2、NG12-2、NG2、NG7和NG305与F. solani聚为一类,认为这11个菌株属于腐皮镰孢菌(F. solani),均分离于宁波地区;菌株NG228、NG155、NG224和TY2与F. commune聚为一支,认为这4个菌株属于共享镰孢菌(F. commune);菌株NG304、NG8、NG18-1和TG4与F. chlamydosporum聚为一簇,认为这4个菌株为厚垣镰孢菌(F. chlamydosporum);仅1个菌株NG227与F. proliferatum的菌株聚在一类,认为NG227属于层生镰孢菌(F. proliferatum)(图1)。
2.2 基于TEF-1α序列进行的分子鉴定
对其中的一些菌株进行基于TEF-1α序列构建的系统进化树分析,验证了这些菌株的分类地位(图2),例如NG312与F. oxysporum聚为一簇;NG305、NG14、NG324、NG300、NG13-2、NG20、NG3、NG29-2、NG7与F. solani聚为一类;NG228、NG155与F. commune聚为一支;与基于ITS序列构建的系统进化树相一致。
2.3 致病力的测定
此外,对尖孢镰孢菌(F. oxysporum)TG5进行致病力的测定,发现可以造成甜瓜植株的枯萎等症状(图3),认为TG5是尖孢镰孢菌甜瓜专化型(F. oxysporum f. sp. melonis),其他菌株的致病力需要进一步的测定。
3 讨 论
尖孢镰孢菌甜瓜专化型(Fusarium oxysporum f. sp. melonis)是引起甜瓜枯萎病的一种真菌病害。为了解和明确甜瓜根部和叶部的镰孢菌群体,笔者从发病的甜瓜根部和叶部进行镰孢菌的分离,共获得了32个镰孢菌分离物,其中包括11个尖孢镰孢菌(Fusarium oxysporum)、12个腐皮镰孢菌(F. solani)、4个厚垣镰孢菌(F. chlamydosporum),4个共享镰孢菌(F. commune)和1个生镰孢菌(F. proliferatum)等5个种,对其中的尖孢镰孢菌TG5进行致病性测定,发现TG5是具有致病力(图3),可引起甜瓜枯萎等症状。鉴定的4个共享镰孢菌(F. commune)目前尚未在甜瓜病害中发现,但其致病力仍需进一步明确,其他的镰孢菌对甜瓜是否有致病性也需要进一步研究。之前有对山西省瓜类作物根茎部上镰孢菌种类的研究,共获得353株镰孢菌菌株,包括尖孢镰孢菌(F. oxysporum)、芬芳镰孢菌(F. redolens)、腐皮镰孢菌(F. solani)、轮枝镰孢菌(F. verticillioides)、层生镰孢菌(F. proliferatum)、禾谷镰孢菌(F. graminearum)、半裸镰孢菌(F. semitectum)和锐顶镰孢菌(F. acuminatum)8个种,但未明确其致病性[19];此外马国苹研究甜瓜种子携带的镰孢菌种类,从甜瓜种子上分离获得了4个尖孢镰孢菌(F. oxysporum)、5个层生镰孢菌(F. proliferatum)、5个木贼镰孢菌(F. equiseti)和9个轮枝镰孢菌(F. verticillioides),均对甜瓜的幼苗有致病性[20]。
本研究结果明确了浙江宁波、台州地区甜瓜根部和叶部镰孢菌群的种类,为更好地防治镰孢菌对甜瓜造成的危害提供了一定的基础。
参考文献
[1] 林德佩.中国栽培甜瓜植物的起源、分类及进化[J].中国瓜菜,2010,23(4):34-36.
[2] 焦自高,齐军山.甜瓜高效栽培与病虫害识别图谱[M].北京:中国农业科学技术出版社,2015.
[3] 胡美华,汪炳良,王毓洪,等.浙江省甜瓜产业现状与发展对策[J].浙江农业科学,2015,56(12):1911-1914.
[4] 刘春艳,王万立,郝永娟,等.大棚甜瓜枯萎病的发生及综合防治[J].农业科技通讯,2010(1):171-172.
[5] LESLIE J F,SUMMERELL B A.The Fusarium laboratory manual[M].Ames:Blackwell Publishing.2006.
[6] LEYVA-MADRIGAL K Y,LARRALDE-CORONA C P,APODACA-SANCHEZ M A,et al.Fusarium species from the Fusarium fujikuroi species complex involved in mixed infections 1 of maize in Northern Sinaloa, Mexico [J].Journal of Phytopathology,2015,163(6):486-497.
[7] 楊颖,耿丽华,王建设,等.甜瓜根腐病病原分离与抗源鉴定[J].华北农学报,2010,25(4):218-220.
[8] CHEHRI K,SALLEH B,YLI-MATTILA T,et al.Molecular characterization of pathogenic Fusarium species in cucurbit plant from Kermanshah province, Iran[J].Saudi Journal of Biological Scienceas,2011,18(4):341-351.
[9] 柴兆祥,李金花,李敏权,等.白兰瓜果腐病优势病菌鉴定及其产孢条件研究[J].果树学报,2005,22(1):40-43.
[10] 王燕,王春伟,王琳,等.甜瓜镰刀菌果腐病新病原菌Fusarium incarnatum的鉴定及生物学特性[J].园艺学报,2019,46(3):529-539.
[11] 肖敏,吉训聪,王运勤,等.海南岛甜瓜镰刀菌果腐病药剂防治研究[J].长江蔬菜,2011(2):63-65.
[12] BORA T,?ZAKTAN H,G?RE E,et al.Biological control of Fusarium oxysporum f. sp. melonis by wettable powder formulations of the two strains of Pseudomonas putida [J].Journal of Phytopathology,2004,152(8/9):471-475.
[13] 王少斌,程水源,王燕,等.提取板栗DNA的CTAB法和SDS法的比较[J].湖北农业科学,2012,51(14):3101-3103.
[14] WU M D,ZHANG L,LI G Q.Genome characterization of a debilitation-associated mitovirus infecting the phytopathogenic fungus Botrytis cinerea [J].Virology,2010,406(1):117-126.
[15] KUMAR S,STECHER G,TAMURA K.MEGA7:Molecular evolutionary genetics analysis version 7.0 for bigger databases[J]. Molecular Biology and Evolution,2016,33(7):1870-1874.
[16] 邵元健,周小林,包卫红,等.甜瓜枯萎病不同生理小种的鉴定方法[J].长江蔬菜,2012(8):65-66.
[17] 黄奔立,许云东,张顺琦,等.根系分泌物影响黄瓜枯萎病抗性的机理研究[J].扬州大学学报(农业与生命科学版),2007,28(3):77-81.
[18] 李晓慧,梁慎,常高正,等.西瓜枯萎病苗期抗性鉴定及抗源筛选[J].江苏农业科学,2018,46(17):91-94.
[19] 袁微微,李新凤,高俊明,等.山西省瓜类作物根茎部镰刀菌的分离与鉴定[J].山西农业科学,2013,41(3):246-250.
[20] 马国苹,梁芷健,梁佳媛,等.甜瓜种子传带真菌初步研究[J].种子,2019,38(6):1-5.

