国内他克莫司群体药代动力学的研究进展
佘红丽 张婷婷 陈琼 张静 张田芳 时莹 倪清清 胡秀萍
滁州市第一人民医院,安徽 滁州 239200
他克莫司为链霉菌中提纯出大环内酯化合物,具有强效免疫抑制作用,是一种钙调磷酸酶抑制剂,依赖钙信号传导通路促使细胞内Ca2+浓度增加,阻断基因转录,抑制T细胞的增殖,起到免疫与抑制的双重作用,主要用于实体器官移植后的排异反应,相对于环孢素,他克莫司服用更方便,能显著减少急性排斥反应[1]。
他克莫司因有肾毒性和神经毒性,给药过程中需要检测血药浓度,及时调整剂量,确保治疗效果,减少毒副作用。1998年国内开始使用,因个体化差异大,不良反应多,很多研究机构开展了该药的群体药代动力学(population pharmacokinetics,PPK)研究,通过定量考察药物体内处置过程的影响因素,并将变异因素模型化,为患者个体化给药提供依据,现对国内该药PPK研究进展综述如下。
1 健康人体内的PPK
徐新军等[2]首次研究了国内男性健康志愿者的药代动力学,3p87程序拟合结果表明,他克莫司吸收快,消除缓慢,药代动力学符合二室模型一级吸收,口服单剂量0.15mg/kg的不同个体,半衰期和表观分布容积分别相差4和5倍。
北京武警医院给予40名健康男性口服单剂量2mg他克莫司,检测851例样本,非线性混合效应模型预测清除率32.8L/h,间隙分布容积、中央分布容积和周围分布容积分别是 76.3、22.7 和 916.0L[3]。
施孝金等[4]研究了口服单剂量5mg他克莫司的22名健康男性药动学特征,主要药动学参数为:T1/2=(31.4±9.0)h,Cmax=(41.3±19.6)ng/mL,Tmax=(1.7±0.8)h,AUC0-t=(330.3±143.5)h·ng/mL,AUC0-∞=(394.9±186.3)h·ng/mL,相对标准偏差接近或大于30%,变异的来源与CYP3A4/5的基因多态性有关,CYP3A4*18BGG携带者代谢比非GG携带者明显慢,AUC相差1.9倍,CYP3A5*3GG携带者代谢比非GG携带者明显慢,AUC相差1.95倍[4]。
国产和进口他克莫司胶囊生物等效性研究证实,服用受试制剂或参比剂2mg,血药峰浓度和0~36h的表观分布容积90%可信区间分别落在参比制剂的70%~143%和80%~125%之间,符合生物等效性判断标准[5]。
由以上研究的结果可以看出,同一研究中他克莫司在健康人的半衰期长、表观分布容积大,相对于表观分布容积清除率相对较小,而且半衰期长、峰浓度和表观分布容积个体差异很大,国产和进口他克莫司具有生物等效性。
2 肾移植患者的PPK
肾移植患者术后,根据排斥反应期不同,能达到最大获益的治疗窗效浓度不断变化[6-8],国内一项研究分别建立了术后 1、1~3、3~6、6~12 个月和 12 个月以上的最佳治疗窗的血药浓度,分别为 5~20、5~15、4~12、4~10、3~8μg/L,尤其是术后3个月内根据血药浓度检测结果调整给药[8]。也有观察结果发现术后1个月小于5μg/L易引起排斥反应,大于15μg/L易引起高血糖和肾毒性,对肝功能影响小[9]。文献报道,他克莫司清除率随术后时间延长和年龄增高而降低,清除率=18.6*(千克体质量/0.0729)0.266,预测表观分布容积=314L[10,11]。
CYP3A5不同基因型在中国人群分布,各项研究数据显示,CYP3A5*1/*1、CYP3A5*1/*3 和 CYP3A5*3/*3分别为 6.8%~17.5%、31.1%~45.9%、47.3%~60.7%[6,12]。
肾移植患者术后3个月,CYP3A5*3/*3组给药2h他克莫司血药浓度低于CYP3A5*1/*3和CYP3A5*1/*1组,术后1周及1、3个月,CYP3A5*3/*3组给药2h他克莫司血药浓度与给药剂量(C0/D)比高于CYP3A5*1/*3和 CYP3A5*1/*1 组。术后 1、2 周及 1、3、6 个月,CYP3A5*3/*3组清晨谷浓度与给药(校正)剂量比高于CYP3A5*1/*3和CYP3A5*1/*1组,CYP3A5多态性是最重要的变体,占总变异的19.5%他克莫司药物动力学。他克莫司C0/D与CYP3A5基因型、红细胞压积(HCT)和白蛋白(ALB)有相关性,设定CYP3A5*3/*3为1,CYP3A5*1/*3和CYP3A5*1/*3为0,建立多元回归方程如[13]:
C0/D=86.350+72.053×CYP3A5+2.658×HCT-2.097×ALB
中南大学以231例成年人为研究对象,结果显示,清晨谷浓度(C0)与给药剂量(D)比值,与尿液中内源性的氢化可的松和可的松含量(MR)、CYP3A5基因型(CYP3A5*3/*3为 0,CYP3A5*1/*3、CYP3A5*1/*3 为 1)、术后时间和年龄有关。给药剂量(D)与体重(W)比值,与尿液中内源性的氢化可的松和可的松含量(MR)、CYP3A5基因型(CYP3A5*3/*3为 0,CYP3A5*1/*3、CYP3A5*1/*3 为 1)、术后时间、体重指数(BMI)、性别(gender,男性为 0,女性为 1)、总胆红素(TBIL)、年龄(age)有关,并且以总样本231例和173例基因型为CYP3A5*3/*3患者的数据分别做回归分析,建立预测模型公式如下:
总样本模型公式

基因型CYP3A5*3/*3模型公式
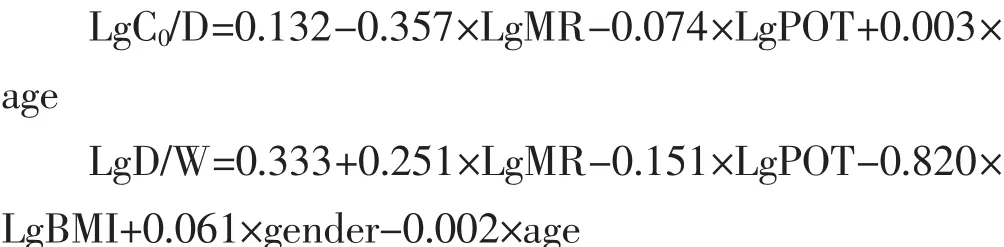
欲达到目标浓度为 3~7μg/L,应给日剂量(3.4±1.5)mg/d,对检测出 CYP3A5*3/*3 基因者应按(3.1±1.5)mg/d 减量给药[14]。
基因多态性可能影响他克莫司C0/D,国内研究主要有免疫基因遗传多态性 IL-3 rs181781、IL-18 rs1946518、CTLA4 rs4553808、CYP3A5 rs776746 和CYP3A4 rs2242480 、rs4646437[15-16],但 ABCB1 基因多态性未发现他克莫司对肾移植患者的治疗,为肾移植患者调整给药剂量提供了理论依据[17]。
国外研究表明他克莫司在不同种族间存在浓度差异,国内研究了广西壮族和汉族肾移植患者,术后1个月内壮族明显高于汉族,其余时间段无明显差异,随着年龄增大,血药浓度升高,可能与清除能力减弱有关[11,18]。
儿童肾移植后,排斥反应率高于成年人,单位体重给药量高于成年人。可能原因为儿童生物利用度虽与成人相仿,但回肠短,吸收面积小,体内分布容积、肝药酶活性和清除率相对较高[19]。
他克莫司缓释制剂与普通制剂对比,谷浓度近似,缓释剂日剂量高于普通制剂,半衰期延迟1小时,24小时内的血药浓度均高于谷浓度。普通制剂早上给药后的吸收和消除均快于晚上,12小时后的浓度低于谷浓度[20]。
3 肝移植患者的PPK
对肝移植患者血药浓度的影响因素有很多,如性别、年龄、肝功能、术后时间、首次给药剂量和合并用药等[21-24],中央室和外周室的清除率分别高于健康人的2.34和1.69倍[25],移植 3周清除率显著提高[26]。北京武警医院观察112名肝移植患者,检测1100例样本,预测清除率18.4L/h,每小时低于健康人群14.4L[3]。
成年人肝移植患者,供者和受着CYP3A5基因多态性均影响他克莫司的浓度与剂量比,并拟合根据血药浓度调整给药剂量公式:调整给药剂量=1.025+0.625×供者CYP3A5+0.520×受者CYP3A5+0.021×术后时间-0.008×年龄(携带CYP3A5*1为 0,非携带 CYP3A5*1为1)[27]。一项对汉族人的研究表明,携带CYP3A5*1的供者FMO3基因片段rs1800822和rs909530等位基因T影响他克莫司代谢,尤其在术后2、3和4周,可参照按FMO3基因多态性个体化调整浓度与剂量比[28]。根据供者和受者CYP3A5基因型调整给药初始剂量,可尽早达到目标浓度,减少排斥和不良反应的发生率[29,30]。
85例婴幼儿肝移植患者的研究结果表明,供者和受着CYP3A5基因多态性也影响他克莫司的浓度与剂量比[31]。60%左右儿童活体肝移植受者的血药浓度在术后第3天达到平台期,浓度与给药剂量不成线性关系,浓度与给药剂量比第5天开始下降,可能与尿素氮、肌酐、天冬氨酸转氨酶、受者移植物与体重比有关[32]。
4 肾病综合征患者的PPK
与雷公藤多苷片比较,他克莫司治疗肾病综合征有效率没有明显差异,他克莫司达到有效率时间提前,无明显差异,但会减低肾小球滤过率,复发率较高,其安全性有待进一步研究[33,34]。血药浓度维持在5.10~9.32μg/L疗效确切,对Ⅰ期治疗效果优于Ⅱ期,较长疗程优于短疗程,血药浓度不完全依赖给药剂量,维持在5.10~9.32μg/L,可能与 CYP3A 家族基因多态性有关[35]。
对于儿童患者,性别和年龄影响代谢,达到目标浓度,幼儿期所需剂量高于其他年龄段,青少年期最少,可能与幼儿期肝脏相对重量是成人2倍,代谢率高有关,女性患者给药剂量高于男性,与成人组相似[36]。
5 重症肌无力的PPK
他克莫司治疗重症肌无力3个月后,效果趋于稳定[37],血药浓度大于 3.01μg/L 时控制效果好,低于2μg/L 时无效[38],不同基因型之间血药浓度/剂量对比,CYP3A5*1*1>CYP3A5*1*3>CYP3A5*3*3[39],CYP3A5*3*3基因型患者血药浓度维持在4.018~5.411μg/L时可有效降低乙酰胆碱受体抗体水平[40]。因此,快代谢者增加初始给药剂量,缩短给药间隔,慢代谢者反之,有利于优化治疗[41]。
6 肺移植患者的PPK
CYP3A5快代谢肺移植患者血药浓度/给药剂量比小于慢代谢者[42],术后 1~4周 IL-18 rs5744247和rs1946518、CYP3A5 rs776746的多态性影响血药浓度/给药剂量,术后1~2周IL-10 rs1800896多态性影响血药浓度/给药剂量[43,44],联合检测 CYP3A5 rs776746、IL-10、rs1800896IL-18、rs5744247 和 rs1946518 有助于指导个体化用药。
7 合并用药对PPK的影响
国内研究较多的能够增加他克莫司血药浓度的药物有抗真菌(伏立康唑)[45-47]、抗病毒、抗菌药[48](利福平除外)、质子泵抑制剂、钙离子通道阻滞药(氨氯地平)[49],还有一些植物药如五味子及其相关制剂(五酯胶囊、双环醇)[50-52]、盐酸小檗碱[53]、大黄[54],能够诱导肝药酶活性的药物和食物可降低其血药浓度[55]。
8 小结
随着医学的进步,合理用药不断深化,药品说明书不能完全实现患者个体化给药,依靠血药浓度或基因检测调整个体化给药仅在大型医院有条件开展,难以普遍开展,不能为大多数患者服务;同时,根据监测结果调整相对患者的治疗较滞后。目前我国群体药代动力学的发展为不同群体患者提供了用药依据。
国内对他克莫司的群体药代动力学相关性研究多集中于单中心回顾性研究,各研究之间基线不一致,结论有差异。如果基因型监测覆盖面更广,纳入更多的样本量,也许能更清楚的阐述不同群体的药代动力学特征。

