超声造影与多层螺旋CT在肝透明细胞型癌诊断及手术疗效评估中的应用比较
彭 川,沈国菊,符艳梅,罗 鹰,胡 健
攀枝花学院附属医院1放射科,3超声科,四川 攀枝花 617000;2攀枝花市中心医院病理科,四川 攀枝花 617000
肝透明细胞型癌(PCCCL)是肝癌中较为少见的类型,约占全部原发性肝癌患者的5%[1]。PCCCL患者发病后临床特征与普通肝癌类似,缺乏特异性的鉴别特征[2]。但有研究显示,PCCCL多数为中等分化程度以上,预后优于普通肝癌患者,因此科学有效的早期诊断对于PCCCL的治疗及预后具有积极意义[3]。当前由于PCCCL临床病例数较少,文献研究以个案报道居多,缺乏系统性诊断及预后判断的相关研究。超声造影(CEUS)是肝癌诊断的常见影像学手段,具有检测方便、价格低廉等优点,但对于细小癌灶的分辨存在一定的局限性[4]。多层螺旋CT(MSCT)可从采集的多层投影数据,经三维重建后可获得立体、清晰的扫描图像[5]。本研究通过比较CEUS和MSCT在PCCCL的诊断及手术疗效评估效果,旨在为PCCCL的临床诊断及预后提供科学依据,现汇报如下。
1 资料与方法
1.1 一般资料
选取2016年2月~2019年3月本院收治的经手术病理确诊的原发性PCCCL患者100例,另选取同期肝脏局灶性结节增生患者42例。纳入标准:手术治疗后经病理检测证实为原发性PCCCL或肝脏局灶性结节增生;右侧上腹部异常胀痛、肝脏组织硬化;病灶为单发性;患者临床资料完整;患者知情且自愿参与本研究。排除标准:不符合手术指征;造影剂过敏或不耐受者;孕期及哺乳期女性。本研究经医院伦理委员会审批同意。
1.2 检测方法
1.2.1 CEUS检查 使用荷兰Philips IU22及其配套设备进行CEUS检查,超声探头频率为2~6 MHz。患者取仰卧位,先采用常规超声扫描右侧上腹部肝脏所在部位,记录病灶分布、数量及大小。经肘部浅静脉快速注入Sono Vue造影剂,用量1.2 mL,启动超声内置计时器,观察病灶灌注情况及扫描回声强度变化。
1.2.2 MSCT检查 采用西门子炫速双源CT进行扫描,参数设置:电压140 kV,120 mAs,层厚5.0 mm,间距5.0 mm。造影剂为300 mg/mL的碘普罗胺,扫描范围由膈肌顶部到肝脏下缘,平扫扫描结束后将造影剂经肘静脉快速注入,注射剂量1.0~1.5 mL/kg,注射速度3.0~3.5 mL/s,动脉期延迟时间20~25 s,门静脉期延迟时间55~70 s,平衡期延迟时间110~125 s。扫描获得数据经工作站处理,获取病灶内部及其周边图像。
1.3 CEUS及MSCT判定方法
由2名副主任医师采用双盲法对142例患者的CEUS及MSCT影像学资料进行独立判断,意见不一致时交由主任医师进行评判。
1.4 观测指标
以手术病理结果为金标准,比较CEUS、MSCT对PCCCL患者不同尺寸病灶的诊断效果;比较两种检测方法对PCCCL患者腹腔积液、后腹膜淋巴结肿大、边缘不清等影像学表现的检测结果;统计CEUS、MSCT检测的灵敏度、特异度、漏诊率、误诊率;术后1年复诊时采用CEUS、MSCT结果对PCCCL患者的手术疗效(肿瘤复发、转移)进行评价。
1.5 统计学处理
采用SPSS23.0统计学软件进行数据分析,计数资料以率表示,采用卡方检验;计量资料采用均数±标准差表示,采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 CEUS与MSCT对不同尺寸病灶检出情况比较
结果显示,MSCT对小于1 cm的病灶检出情况优于CEUS(P<0.05,表1)。肝透明细胞癌手术前后影像学表现(图1)。
2.2 PCCCL患者影像学表现结果分析
CEUS对腹腔积液、后腹膜淋巴结肿大、边缘不清的检出率低于MSCT(P<0.05,表2)。
2.3 CEUS、MSCT对PCCCL的诊断分析
MSCT对PCCCL的诊断的灵敏度、特异度高于CEUS(P<0.05,表3),误诊率、漏诊率低于CEUS(P<0.05)。
2.4 CEUS、MSCT对PCCCL的漏诊率和误诊率比较
MSCT对PCCCL的诊断的误诊率、漏诊率低于CEUS(P<0.05,表4)。
2.5 CEUS、MSCT对PCCCL患者手术疗效的评价
MSCT对PCCCL患者术后肿瘤复发、转移的检出率高于CEUS(P<0.05,表5)。
3 讨论
PCCCL患者的肝癌细胞胞浆大部分呈透明状,富含糖原和脂质,部分呈颗粒状或絮状,细胞器体积和数量相比正常细胞明显减少[6]。目前国内外对于该病诊断标准存在分歧,国内临床通常以透明细胞占癌细胞一半以上作为诊断标准[7]。与原发性肝癌治疗手段一样,外科根治切除是PCCCL临床治疗的重要手段,介入治疗或门静脉栓塞术治疗也有助于肿瘤体积的缩小[8]。本研究中100例PCCCL患者经CEUS检查后发现的90个癌灶中,76.67%的病灶为高分化癌,提示PCCCL患者的癌灶分化程度较高,这可能是该病预后优于原发性肝癌的原因之一。有研究报道,PCCCL患者癌灶超声检查中回声随着癌灶的增大出现由强转弱的变化[9],与本研究观察到的情况相似。注入造影剂后,64个病灶表现表现为典型的“快进快出”,这与文献报道的高分化原发性肝癌癌灶影像学表现相近[10]。MSCT检查结果显示,PCCCL患者病灶密度明显低于正常肝脏组织,也低于普通肝癌细胞。这可能与PCCCL癌细胞中含有大量脂质和糖原有关,对于PCCCL和原发性肝癌的鉴别诊断有一定价值[11]。使用造影剂后,部分区域强化明显,但仍有部分区域密度较低,病灶边缘部位界限模糊,呈“慢进慢出”,与一般原发性肝脏恶性肿瘤存在差异[12]。MSCT能够清楚显示肝脏病灶与周围组织的关系,增强扫描后通过对比发现病灶内部的异常变化,明确观察局部组织的血供情况,相对较高的分辨率有助于及时发现微小癌灶[13-14]。刘力等[15]的研究显示,MSCT不仅能清晰显示肝脏肿瘤的位置、数目、大小及癌灶肝外供血动脉的走向,还能测定无肿瘤侧的肝脏体积,对肝脏恶性肿瘤清除手术安全性的预估有重要意义。本研究结果显示,MSCT对<1cm的病灶检出情况优于CEUS,腹腔积液、后腹膜淋巴结肿大、边缘不清等肝癌常见影像学表现检出效果也更加突出,提示相比CEUS而言,MSCT对微小癌灶的检测能力更加优异,MSCT扫描范围更广,可采集多层投影数据,经三维重建后形成立体图像信息,观测角度更加全面,细节更加精准,防止微小病变的遗漏[16],因而本研究中MSCT诊断的灵敏度、特异度、漏诊率、误诊率显著低于CEUS检测。值得注意的是,本研究中MSCT检查有15例漏诊,其中5例(33.33%)为血管平滑肌脂肪瘤,4例(26.67%)为炎性假瘤,4例(26.67%)为肝血管瘤,其余2例(13.33%)为增生结节,分析原因可能为PCCCL由于病例较少,临床影像学资料有限,而现代医学也缺乏对于PCCCL形成机制及病理特征的深入探究,因而在临床诊断中统一发生误诊、漏诊的情况。有研究对比MRI和CT对PCCCL的诊断效果,发现CT诊断组误诊率高达78.62%,显著低于MRI诊断的14.3%[17]。其误诊率明显高于本研究,可能与样本量、影像学医师对PCCCL的认知差异有关。另有研究指出,肝脏的局灶性结节增生主要由门静脉供血,增强扫描动脉期不会出现病灶强化,炎性假瘤在增强晚期则可出现环形或分隔强化现象[18]。以上特征可在诊断过程中加以区分。有研究显示,PCCCL诊断过程中影像学表现与海绵状血管瘤相似[19];但临床上海绵状血管瘤患者发病年龄低,且初期发病时无明显症状,可结合二者的临床表现进行诊断鉴别。影像学手段不仅在PCCCL的诊断中发挥作用,对患者手术疗效评估也具有重要价值。有学者将MSCT用于肝癌患者肝硬化程度和肝储备功能的评估中,为肝硬化的诊断分级提供重要参考依据[20]。本研究中,MSCT对于术后肿瘤复发及转移的检出率显著优于CEUS,说明MSCT对于PCCCL手术切除疗效的评估效果优于CEUS。
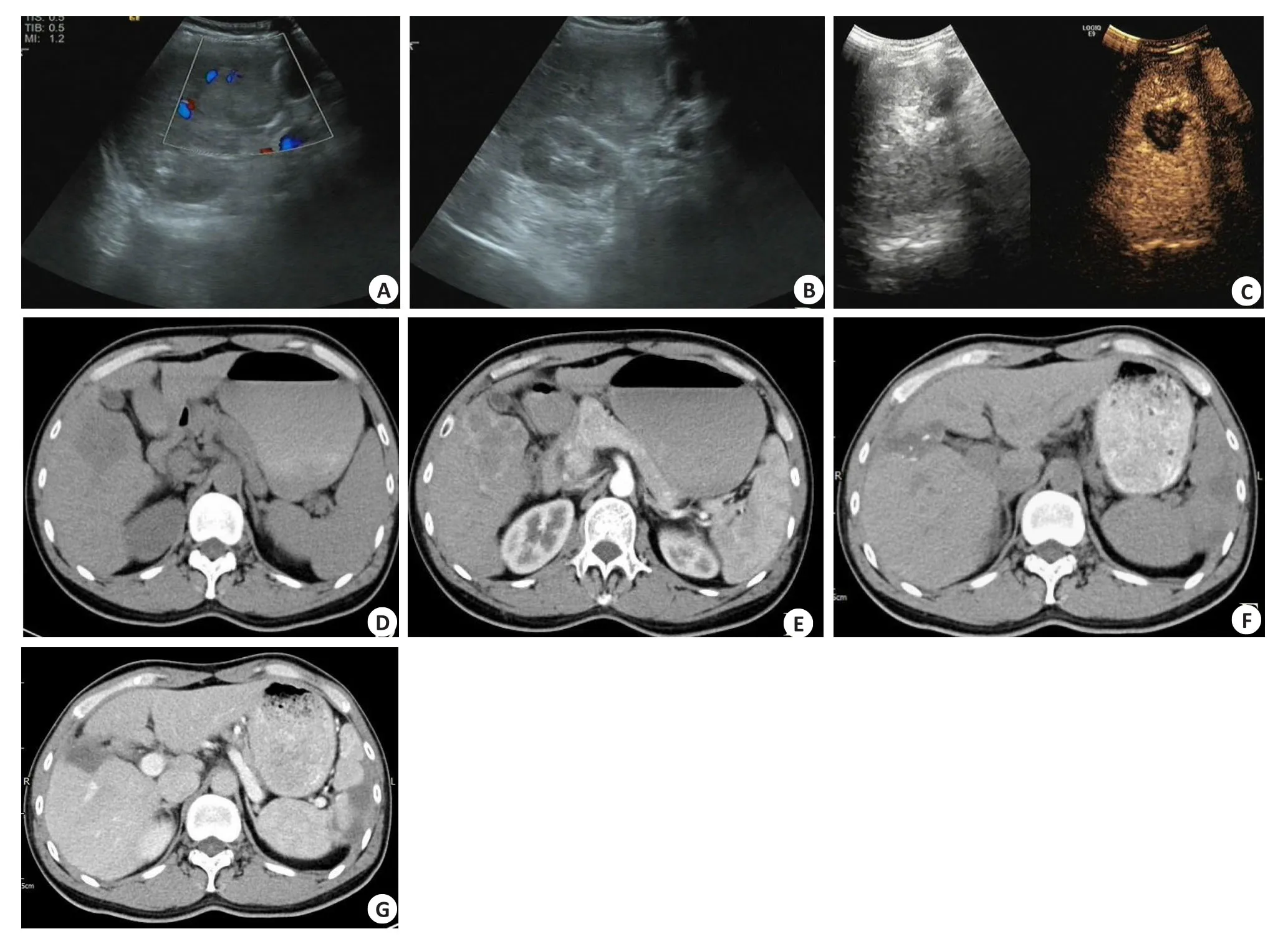
图1 肝透明细胞癌手术前后影像学图片Fig.1 IImages of PCCCLbefore and after surgery.
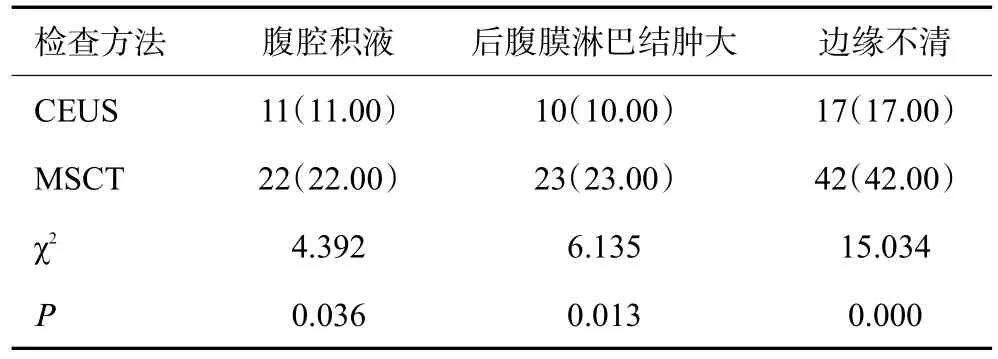
表2 PCCCL患者影像学表现结果分析[n=100,n(%)]Tab.2 Imaging findings of patients with PCCCL

表3 CEUS、MSCT对PCCCL的诊断分析(n)Tab.3 Diagnosis of PCCCLby CEUS and MSCT

表4 CEUS、MSCT对PCCCL的漏诊率和误诊率比较[n(%)]Tab.4 Comparison of missed diagnosis rates and misdiagnosed rates of CEUS and MSCT for PCCCL
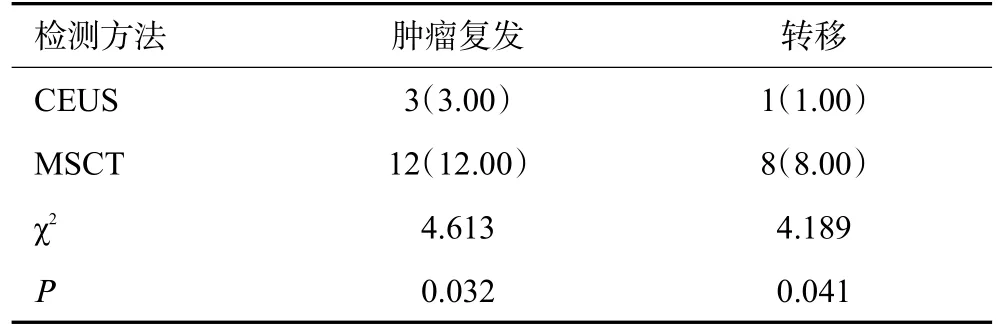
表5 CEUS、MSCT对PCCCL患者手术疗效的评价[n=100,n(%)]Tab.5 Surgical assessment of patients with PCCCL by CEUS and MSCT
综上所述,CEUS、MSCT对于PCCCL均有一定的诊断价值,但MSCT对于微小病灶及异常影像学表现的诊断效果更好,灵敏度、特异度更高,对手术疗效的评估效果更优,具有临床应用价值。

