吸附-超滤组合工艺对低浓度氨氮废水的处理研究
王皓辉,郝林林,李桂菊
(天津科技大学海洋与环境学院,天津 300457)
水体污染的典型问题之一是水体富营养化[1],这是一种由于大量的工业废水以及生活污水排入湖泊、水库、河口等缓流水体后,造成因水中氮、磷等营养元素含量过多而导致的水质污染情况.随着《“十三五”主要污染物总量控制规划》的出台,氨氮污染物成为衡量水体污染程度的第二项约束性控制指标,是我国“十三五”期间重点控制的污染物之一[2-3].
目前常用的水中氨氮去除方法主要有生物脱氮法、氨氮吹脱法、化学沉淀法、折点加氯法与离子交换吸附法等[4].针对深度处理中低浓度氨氮废水的研究中,沸石吸附法由于其成本低,去除效果好,便于操作等优点被广泛研究.Minato等[5]发现沸石对氨氮吸附能力可以通过马弗炉焙烧和碱浸泡进行提升.李忠等[6]发现钠改性沸石在吸附 15mg/L的氨氮废水时,吸附容量可达到 2.5mg/g,K+和 Na+会显著影响实验结果,但 Ca2+和 Mg2+则对吸附氨氮影响较小.唐登勇等[7]用0.8mol/L的氯化钠溶液,按照固液比1∶20加入天然沸石进行改性,装填改性沸石的吸附柱有效出水量是天然沸石的2.67倍.
近年来,对沸石吸附材料的研究大多为静态吸附或模拟吸附柱床研究,然而,吸附柱床在实际运行中存在耗能巨大、装置死体积较大和吸附剂利用率低等问题,Adam等[4]指出吸附-膜组合技术将是污水脱氮的发展趋势.因此,为解决上述问题,本研究提出一种新型吸附-超滤组合工艺,该工艺不仅能够实现较高浓度沸石吸附材料的有效分离,还可以有效避免出现死体积,提高沸石吸附材料的吸附效率[8].
本文为提升吸附剂对氨氮的离子交换能力,采用热盐改性方法制备了 HNa-Ze吸附剂,并通过吸附等温线和吸附动力学探讨了其对氨氮的去除性能;提出吸附-超滤组合装置,利用粉末改性沸石吸附剂对水中的氨氮进行高效的吸附后,再启动超滤膜过滤出水.超滤膜可将较高浓度的粉末沸石截留在吸附池中,便于后续吸附剂的分离回收、重复使用和再生处理[9-10].并针对吸附-超滤组合工艺,考察粉末沸石粒径、投加量和运行时间等对氨氮处理效果以及超滤膜比通量的影响[11].
1 材料与方法
1.1 实验材料
实验所用沸石为产自商丘市的天然斜发沸石.实验所用超滤膜组件是由某公司提供的 PVC内压式中空纤维膜,单个膜组件的膜面积为 5m2,设计通量为 9~12L/(m2·h),平均孔径为 1μm.实验所用模拟废水为15mg/L氯化铵溶液.真实废水采自生活污水处理厂二沉池出水,二沉池出水水质见表1.
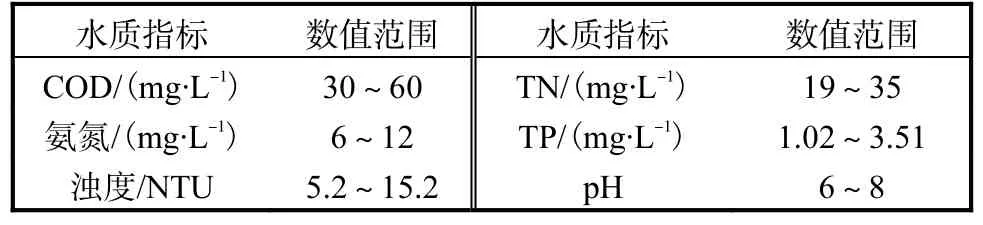
表1 二沉池出水水质Tab. 1 Secondary sedimentation water quality
1.2 实验装置
采用实验室小试规模的浸没式中空纤维膜处理装置进行废水处理,实验装置示意图如图 1所示,装置尺寸为750mm×250mm×440mm,容积为60L.

图1 吸附-超滤膜组合工艺实验装置示意图Fig. 1 Adsorption-ultrafiltration membrane experimental device
1.3 实验方案
1.3.1 改性沸石制备
称取 25g天然沸石于马弗炉中,在 300℃的温度下煅烧2h,冷却后置于0.5mol/L氯化钠溶液中搅拌12h后,用2L超纯水冲洗,于烘箱中在105℃下烘干,粉碎后过筛备用,命名为 HNa-Ze.在前期实验中,比较了不同浓度(0.25、0.5、1.0、1.5、2.0mol/L)氯化钠溶液的改性效果.改性沸石对氨氮的吸附效果最初随着氯化钠溶液浓度的上升而提升,在 0.5mol/L后开始平缓,所以从利用率和成本的角度考虑,选择0.5mol/L的NaCl溶液.为了更好地考察HNa-Ze对氨氮的吸附效果,单因素实验采用15mg/L的氯化铵溶液模拟废水.取 100mL模拟废水置于锥形瓶中,并加入吸附剂投加量为 5g/L的天然沸石和 HNa-Ze,以 160r/min振荡 3h,抽滤后测定氨氮浓度,计算氨氮的去除率和吸附剂的吸附容量.
1.3.2 吸附等温线拟合
配制 100mL 质量浓度分别为 15、25、35、70、100、135、170、250、350、450mg/L 的 NH4Cl溶液,加入 0.5g HNa-Ze于溶液中振荡 4h,温度为 20~25℃,测定吸附后的剩余氨氮浓度.
采用 Langmuir模型和 Freundlich模型,对比吸附剂对氨氮的吸附性能.Langmuir模型用于描述单分子层均匀表面的吸附,Freundlich模型用于描述不均匀表面的吸附.
Langmuir模型的方程为

Freundlich模型的方程为

式中:qe为平衡吸附量,mg/g;qm为最大吸附量,mg/g;Ce为溶液中氨氮的平衡质量浓度,mg/L;KL为Langmuir吸附系数;KF为 Freundlich吸附系数;1/n为与吸附强度有关的非均相参数.
1.3.3 吸附动力学拟合
配制 100mL质量浓度为 15mg/L的 NH4Cl溶液,加入 0.5g HNa-Ze吸附剂,吸附时间分别为 10、20、30、40、50、60、70、80、90、100、120、150、180、240min,分别测定不同时刻的剩余氨氮浓度.
准一级动力学模型假设吸附速率是由吸附剂表面的活性位点所控制,而准二级动力学模型是基于吸附速率受吸附剂表面官能团的相互作用如电子转移和共价键影响.
准一级动力学模型表达式为

准二级动力学模型表达式为

式中:t为反应时间,min;Qe为平衡吸附容量,mg/g;Qt为任意时间的吸附容量,mg/g;k1为准一级吸附的速率常数,min-1;k2为准二级吸附的速率常数,g/(mg·min).
1.3.4 运行参数对氨氮去除效果的影响
实验运行参数的筛选使用模拟废水,实验装置采用间歇出水方式,水力停留时间(HRT)为2h,水力反冲洗方式,反冲洗强度为 50L/(m2·h),超滤与反洗时间比为 59∶1,实验期间水温为 25℃,pH 为 6.5,出水泵压力为 1MPa.HNa-Ze为一次性投加,实验期间不换 HNa-Ze,通过单因素实验确定 HNa-Ze投加量、反洗通量和反洗时间等运行参数,讨论投加量和粒径对去除氨氮效果和膜污染的影响,确定最佳运行参数.以二沉池出水为实验用水进行真实废水实验,在最佳运行参数下进行实验.通过蠕动泵调节进出水流速,使 HRT 分别为 20、30、40min,连续运行装置,测定不同时刻出水氨氮.
氨氮采用纳氏试剂分光光度法测定(HJ 535—2009).膜比通量(JSF)是单位时间、单位操作压力下每平方米膜面积所透过的水量,本文使用归一化膜比通量(JSF/JSF0),考察超滤过程中的总膜污染、可逆膜污染及不可逆膜污染的状况.装置在运行初始时的归一化膜比通量为 1,JSF/JSF0的值越大,说明膜比通量的衰减越小.
2 结果与讨论
2.1 HNa-Ze的吸附效果
2.1.1 沸石改性前后对氨氮去除效果的对比
改性前后对氨氮去除效果的比较如图2所示,改性前后吸附剂的表面性状及 EDS能谱分析如图 3、图4所示.
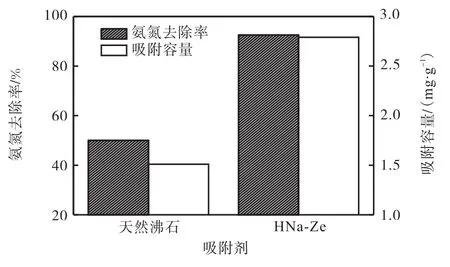
图2 改性前后对氨氮去除效果的比较Fig. 2 Comparison of ammonia nitrogen removal before and after modification

图3 改性前后吸附剂表面性状Fig. 3 Surface properties of adsorbents before and after modification

图4 天然沸石与HNa-Ze的EDS能谱分析Fig. 4 EDS energy spectrum of natural zeolite and HNa-Ze
由图 2可知:改性后对氨氮的去除率由 50%提升至 92.5%,较天然沸石提升 42.5%.吸附容量由1.51mg/g提升至 2.79mg/g.通过 SEM、EDS分析(图 3、图 4)可知高温预处理疏通沸石的孔道结构,NaCl溶液中 Na+交换下 Al3+、Mg2+等阳离子,Na+占据离子交换活性位点,提高了对交换能力且改性并未损坏沸石的鳞片状结构,HNa-Ze较天然沸石对氨氮的吸附效果有较为明显的提升.
2.1.2 吸附等温线拟合
为了探究 HNa-Ze对氨氮的吸附机理,利用Langmuir和 Freundlich吸附等温线对实验结果进行拟合.吸附等温线见图 5.Langmuir吸附等温线的回归参数:KL=0.1105、qm=18.149mg/g、R2=0.987;Freundlich吸附等温线的回归参数:KF=0.9364、1/n=0.4778、R2=0.946.
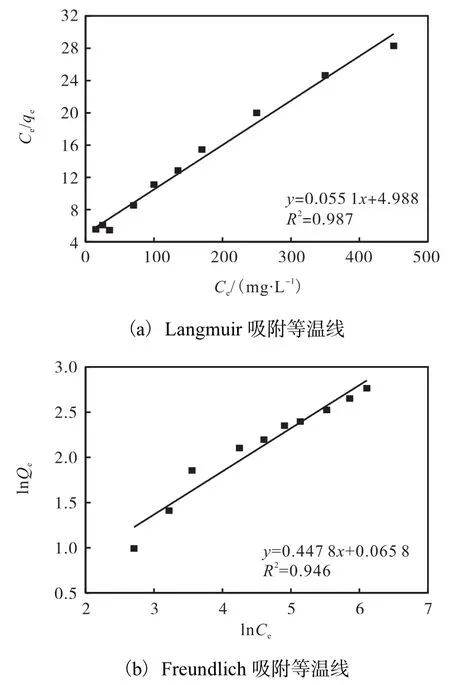
图5 Langmuir吸附等温线与 Freundlich吸附等温线拟合Fig. 5 Fitting of Langmuir adsorption isotherm and Freundlich adsorption isotherm
实验结果表明,Langmuir模型的相关系数略高于Freundlich模型的相关系数,二者均在0.94以上,Freundlich模型的吸附平衡常数较高,HNa-Ze对氨氮的吸附用两种吸附等温线均能很好地描述.这意味着 HNa-Ze的氨氮吸附中物理吸附和化学作用并存.另外,Freundlich模型中 1/n=0.4778,说明初始浓度的提高有助于HNa-Ze吸附氨氮.
2.1.3 吸附动力学拟合
为探究吸附过程中的吸附速率、影响吸附速率的因素以及解释反应速率规律的可能机理,对 HNa-Ze进行准一级和准二级动力学模型的实验和拟合,研究HNa-Ze对氨氮吸附速率的变化,动力学模型拟合参数结果见表2.

表2 动力学模型拟合参数Tab. 2 Kinetic model fitting parameters
实验结果表明:HNa-Ze吸附氨氮的速率与准一级反应动力学方程和准二级反应动力学进行拟合,准二级动力学方程合拟合程度更好.从表 2准二级动力学模型参数可以看出:HNa-Ze对溶液中氨氮的吸附速率随着温度的升高变快,温度由20℃升至60℃,k2由 0.0119g/(mg·min)提升至 0.0152g/(mg·min).通过计算可知20、40、60℃对应的ΔG分别为-1.52、-2.29、-2.56kJ/mol,吸附体系的ΔG<0表明HNa-Ze颗粒吸附氨氮是自发过程.随着温度升高,ΔG逐渐减小,证明温度的升高对 HNa-Ze吸附氨氮的过程是有利的,因此反应速率常数k2变大.
HNa-Ze对氨氮的吸附反应的第一阶段应该是静电引力作用,吸附速率较快,因此对准一级动力学模型有较好的拟合程度.吸附动力学曲线以及准二级反应动力学得出的理论吸附量与实验吸附量较为接近,因此准二级反应动力学方程能更好地描述氨氮在沸石颗粒上的吸附过程.由于准二级反应动力学方程是基于化学吸附,可见沸石颗粒吸附氮氮的基本原理属于化学吸附,主要是离子交换.
2.2 不同运行参数对吸附-超滤组合工艺去除氨氮效果的影响
2.2.1 HNa-Ze投加量对氨氮吸附效果的影响
实验中 HNa-Ze使用 100~200目的粒径,HNa-Ze投加量为10、20、25g/L,装置使用间歇出水,HRT为 2h,不更换吸附剂的条件下重复 3组,考察沸石投加量对氨氮的吸附效果,结果如图 6所示.在不投加吸附剂的情况下,出水氨氮浓度几乎没有变化,实验证实超滤膜本身对氨氮的去除没有效果,这是由于超滤膜的孔径(2nm)大于铵根离子(0.25nm).2h后投加量分别为 10、20、25g/L时,剩余氨氮浓度分别为 2.8、1.02、0.85mg/L,重复 3次后,出水氨氮虽然略有提高,20g/L和25g/L的投加量下的剩余氨氮浓度分别为1.48mg/g和1.28mg/g,基本达到天津市污水综合排放标准(DB12/356—2018)一级标准处理要求,随着粉末 HNa-Ze投加量的提高,氨氮的吸附率和吸附速率都有所提高,但 25g/L较 20g/L提升并不明显.从经济的角度考虑,装置中粉末 HNa-Ze的投加量选为20g/L.

图6 不同HNa-Ze用量对装置处理效果的影响Fig. 6 Effect of different HNa-Ze dosage on the treatment efficiency of the device
2.2.2 不同粒径对装置吸附氨氮效果的影响
在一定的转速搅拌下,不同粒径的HNa-Ze在水中的分散程度不同,会对 HNa-Ze的吸附速率有一定的影响.HNa-Ze投加量为20g/L,选择HNa-Ze粒径为30~50目、100~200目、200~500目、小于1500目,实验结果如图7所示.

图7 粒径对装置去除氨氮效果的影响Fig. 7 Effect of particle size on the removal of ammonia nitrogen
在第一个周期中,30~50目的HNa-Ze因粒径较大较重,沉于池底较多,所以吸附速率低于其他 3种粒径,而从2~6h的吸附效果可以看出粒径在100~200目和200~500目时吸附效果较好,而小于1500目的 HNa-Ze在第一个周期后对氨氮的吸附效果大幅下降.实验中发现,粒径太小时 HNa-Ze在池底发生团聚,在池底堆积难以被搅拌均匀,HNa-Ze与原水接触面积被大大降低,导致对氨氮的去除效果急剧下降,因此建议HNa-Ze的粒径为200目左右即可.
2.3 不同运行参数对超滤膜比通量的影响
2.3.1 HNa-Ze粒径对超滤膜比通量的影响
HNa-Ze粒径对膜比通量的影响如图 8所示.大颗粒 HNa-Ze(粒径为 5mm 左右)和 30~100目HNa-Ze在实验中连续运行 3h,JSF/JSF0均保持在0.90以上,100~200目HNa-Ze在3h的运行过程后JSF/JSF0下降至0.84,200~500目则下降至0.71,小于1500目运行 2h,因 JSF/JSF0下降至 0.60以下,为了保护膜组件,避免出现不可逆膜比通量下降,故停止运行.可见粒径较大时,膜比通量能够较长时间维持稳定,随着粒径变小,膜比通量下降明显变快.而粒径越小,膜外表面饼层越容易形成且不容易被水流横向剪切力去除.

图8 粒径对膜比通量的影响Fig. 8 Effect of particle size on membrane flux
2.3.2 HNa-Ze投加量对超滤膜比通量的影响
投加量对膜比通量的影响如图9所示.
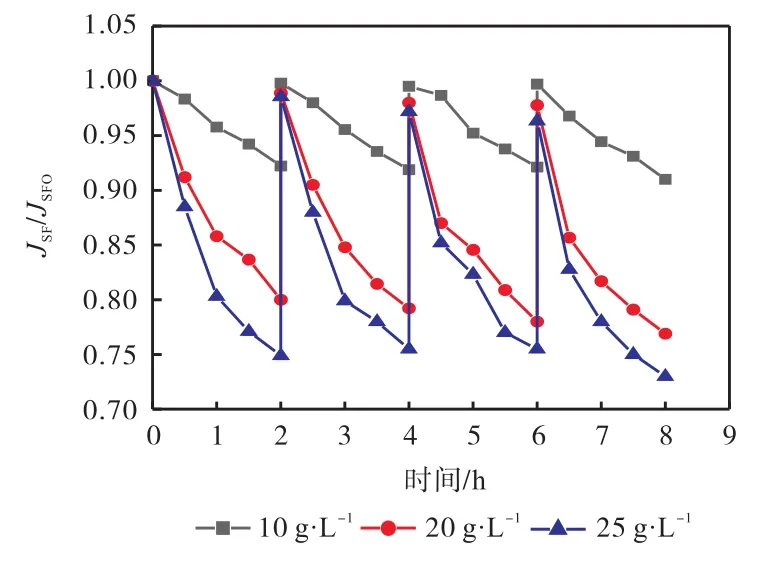
图9 投加量对膜比通量的影响Fig. 9 Effect of dosage on membrane flux
当投加量为 10g/L时,JSF/JSF0下降程度较小,4个实验周期结束后 JSF/JSF0下降为 0.91;投加量为20g/L时,4个实验周期结束 JSF/JSF0下降为 0.77;投加量为 25g/L时,4个实验周期结束 JSF/JSF0下降为0.73.可见随着投加量的增加,膜比通量呈现下降趋势,分析原因为在搅拌的条件下,随着投加量增加,超滤膜外表面积累吸附剂层厚度增加,因此膜比通量下降.结合之前实验结果,20g/L即可以满足装置处理氨氮的需要,对膜的污染相对于 25g/L较小,所以选用20g/L作为装置的最佳投加量.
2.4 反冲洗周期对超滤膜比通量的影响
因受到所用膜压力限制,为防止膜破损,选用50L/(m2·h)作为反冲洗通量,一次性投加 HNa-Ze 20g/L,100~200目沸石,每 30min测量膜比通量.采用长周期2h、反冲洗2min和短周期1h、反冲洗1min两种方式运行,其JSF/JSF0的变化如图10所示.1h作为反冲洗周期时,反冲洗后的膜比通量可以恢复到初始的膜比通量值.当2h作为反冲洗周期时,在几个周期后会出现明显的不可恢复污染,膜比通量无法恢复为初始通量且下降较为明显,在第3个运行周期后,JSF/JSF0下降为 0.96.在长周期运行中,膜外表面积累较厚饼层,导致在反冲洗过程中难以去除或出现冲洗的盲区.考虑装置的长期运行需要,反冲洗周期选为1h.

图10 反冲洗周期对膜比通量的影响Fig. 10 Effect of backwash cycle on membrane flux
2.5 真实废水处理效果
利用某生活污水处理厂二沉池出水为实验用水,其中氨氮质量浓度为 8mg/L.选用 100~200目HNa-Ze,投加量为 20g/L,超滤膜组反冲洗周期为1h.通过调节进出水流速,使 HRT 分别为 20、30、40min,连续运行小试装置,测定不同时刻出水氨氮浓度.实验结果如图11所示.在运行前30min HNa-Ze迅速吸附水中氨氮,并在 30min后逐渐平稳,因HNa-Ze逐渐吸附饱和,出水氨氮缓慢升高.在 HRT分别为20、30、40min的条件下,启动30min后出水氨氮分别为 1.68、1.38、1.21mg/L,在运行 180min时HRT为20min出水氨氮为2.21mg/L,已不能满足出水要求.240min后HRT为30min和40min出水氨氮分别为 1.47、1.25mg/L.可见 HRT为 30min和40min的情况下连续运行 4h可以满足水质排放要求,但考虑到实际应用处理效率,选择30min作为最佳HRT.吸附饱和的吸附剂在240min后的反冲洗阶段由装置的回收口排出,并在装置中加入新的吸附剂方可继续运行.在 HRT为 30min的条件下,每吨吸附剂可处理 4.5万 t氨氮含量为 8mg/L的废水.此外,HNa-Ze对废水中的COD和TP也存在一定的吸附效果,装置连续运行 240min后,出水COD和 TP分别由原水的45.3mg/L和2mg/L降低至35.7mg/L和1.59mg/L.利用该装置处理二沉池出水可以每4h更换一次吸附剂,回收的吸附剂可作为人工湿地填料或作为缓释肥使用.

图11 不同HRT处理效果Fig. 11 Processing effects of different HRT
3 结 论
(1)HNa-Ze对氨氮具有良好的吸附效果.HNa-Ze对氨氮的吸附效果比天然沸石提高 42.5%,吸附容量为2.79mg/g.
(2)HNa-Ze对氨氮的吸附更符合准二级动力学模型,说明 HNa-Ze对氨氮的吸附过程以化学作用为主.HNa-Ze对氨氮的吸附对两种吸附等温线模型的拟合程度均较高,说明 HNa-Ze对氨氮的吸附不仅是单层吸附,且物理吸附和化学吸附并存.
(3)超滤膜本身几乎没有对氨氮的去除效果,吸附-超滤组合可以实现吸附剂的回收.HNa-Ze投加量为 20g/L时,吸附-超滤组合工艺的最佳参数为:HNa-Ze的粒径100~200目,投加量20g/L,吸附2h后过超滤膜,反冲洗周期为1h、反冲洗时间1min.
(4)吸附-超滤装置可有效地处理二沉池出水中的氨氮,HRT为 30min,在连续运行 240min后出水氨氮为1.47mg/L,基本满足出水要求.

