扶正活血解毒方通过Wnt/β-catenin信号通路对口腔黏膜下纤维化的调控作用
谢赛飞 谭劲 郑玲 朱可可 周领航 陈明


〔摘要〕 目的 探索扶正活血解毒方對槟榔碱提取物(areca nut extract, ANE)诱导的口腔黏膜下纤维化(oral submucous fibrosis, OSF)Wnt/β-catenin 信号通路的作用机制。方法 体外培养大鼠口腔黏膜上皮细胞(epithelial cell, EC),分为正常组、模型组、中药高/中/低剂量组和IWR-1组。以ANE为诱导剂,扶正活血解毒方含药血清为干预药物,以Wnt/β-catenin信号通路抑制剂IWR-1为阳性对照物,采用CCK8检测EC细胞增殖;PCR检测Wnt1、β-catenin、Axin、cylinD1基因的表达;Western blot检测Wnt1、β-catenin、Axin、cylinD1蛋白的表达。结果 与正常组相比,模型组EC增殖水平提高,Wnt1、β-catenin、cylinD1基因及蛋白表达增加,Axin基因及蛋白表达降低(P<0.05);与模型组相比,中药高、中剂量组EC增殖水平降低,Wnt1、β-catenin、cylinD1基因及蛋白表达降低,Axin基因及蛋白表达升高(P<0.05);与模型组相比,IWR-1组EC增殖水平降低,Wnt1、β-catenin、cylinD1基因及蛋白表达降低,Axin基因及蛋白表达升高(P<0.05)。结论 扶正活血解毒方可通过调控Wnt/β-catenin信号通路,抑制ANE刺激的EC增殖,逆转OSF癌前病变的形成。
〔关键词〕 口腔黏膜下纤维化;槟榔碱提取物;扶正活血解毒;Wnt/β-catenin信号通路
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2020.11.001
〔Abstract〕 Objective To explore the mechanism of Fuzheng Huoxue Jiedu Prescription on Wnt/β-catenin signaling pathway induced by areca nut extract (ANE) in oral submucosal fibrosis. Methods The rat oral mucosa epithelial cells (ECs) cultured in vitro were assigned into a normal group, a model group, a Chinese materia medica high, medium and low dose group, a IWR-1 group. ANE was inducer, and Fuzheng Huoxue Jiedu Prescription-containing serum was intervention medicine. Wnt/β-catenin signaling pathway inhibitor IWR-1 was the positive control medicine. The CCK8 was used to test EC cell proliferation; PCR was used to detect Wnt1, β- catenin, Axin, cylinD1 gene expression; Western Blot was used to detect Wnt1, β-catenin, Axin, cylinD1 protein expression. Results Compared with the normal group, ECs proliferation levels of the model group increased, and Wnt1, β-catenin, cylinD1 gene and protein expression increased. Axin gene and protein expression decreased (P<0.05); Compared with model group, ECs proliferation levels of Chinese materia medica high and medium dose groups were reduced, and Wnt1, β-catenin, cylinD1 gene and protein expression were reduced. Axin gene and protein expression increased (P<0.05); Compared with the model group, ECs proliferation level of the IWR-1 group was reduced, and Wnt1, β-catenin, cylinD1 gene and protein expression were reduced. Axin gene and protein expression increased (P<0.05). Conclusion Fuzheng Huoxue Jiedu Prescription can inhibit the proliferation of EC cells stimulated by ANE, and reverse the formation of OSF precancerous lesions through regulating Wnt/β-catenin signaling pathway.
〔Keywords〕 oral submucosal fibrosis; areca nut extract; Fuzheng Huoxue Jiedu; Wnt/β-catenin signal pathway
口腔黏膜下纤维化或称口腔黏膜下纤维性变(oral submucous fibrosis, OSF)是一种口腔黏膜潜在恶性疾病[1-2]。其癌变率高达7%,WHO将OSF列为癌前状态[3]。流行病学调查表明,咀嚼槟榔是OSF主要的致病因素,但癌变机制尚不清楚,可能与槟榔的致癌成分槟榔碱、细胞因子、创伤及细胞免疫等关系密切[4-5],尤其认为某些细胞因子参与了OSF的癌变过程,其中以Wnt与TGF-β1介导的信号通路最具代表性[6-8]。如何阻断TGF-β与Wnt信号通路细胞因子间的联系,将成为防治OSF癌变的关键。前期研究发现扶正活血解毒中药通过调控TGF-β1/Smads信号转导通路能具有抑制槟榔碱提取物(areca nut extract, ANE)刺激的EC细胞增殖的作用[9-11]。本研究将从Wnt/β-catenin信号转导通路的角度探讨扶正活血解毒方对OSF癌前病变的作用机制,为临床OSF癌变的防治提供新的实验依据。
1 材料与方法
1.1 材料
1.1.1 实验细胞 口腔黏膜上皮细胞(epithelial cell, EC)购自于中国上海赛百慷生物技术股份有限公司。收到细胞后,选择相差显微镜对细胞进行鉴定,镜下细胞为多角形,胞核大,培养皿中细胞铺满的位置显微镜下可见铺路石状。高倍镜下未见成纤维细胞。
1.1.2 实验药物 (1)槟榔提取物(ANE)购于深圳润慧生物科技有限公司。(2)扶正活血解毒方所用药物为颗粒剂,由广东三九制药有限公司生产,由湖南中医药大学第一附属医院药剂科提供。具体组方规格如下:丹參10 g,玄参10 g,当归10 g,红花5 g,生地黄10 g,白花蛇舌草10 g,夏枯草10 g,生黄芪10 g,薄荷10 g,白芍10 g,茵陈10 g,桔梗10 g。克数为生药剂量,为同一批次同一产地药材。将以上中药按处方量取14剂,一剂生药(共115 g)加入500 mL温开水冲泡并充分搅拌,使用水煎浓缩的方法将药物浓缩成500 mL液体,生药浓度为0.23 g/mL,药物现配现用。
1.1.3 含药血清 8周龄SPF级雄性SD大鼠20只由湖南中医药大学动物实验室提供,在SPF条件下适应性饲养1周。将大鼠随机分为正常组、中药高剂量组、中药中剂量组和中药低剂量组4组,每组5只,其中正常组以0.9%生理盐水组灌胃8 mL/只,中药高、中、低剂量组分别按照活扶正活血解毒方12、8、4 mL/kg灌胃[中药低、中、高剂量大鼠灌胃量按照成人每日用量的1、2、3倍定为等效剂量(正常成人体质量按60 kg进行换算)],每日2次,连续灌胃7 d。大鼠末次灌胃1 h后,行心脏取血,4 ℃、1 500 r/min离心10 min,取上清56 ℃灭活30 min,将灭活后的血清通过0.22 μm滤器过滤除菌,配置成完全培养基备用[12-13]。
1.1.4 主要试剂 大鼠口腔黏膜上皮细胞完全培养液(上海赛百慷生物技术股份有限公司,批号RATiCELLM013);胰酶(美国Hyclone,批号SH30042.01);2.24 μg/mL DispaseⅡ酶(美国Gibco,批号25200-027);PBS(美国Hyclone,批号SH30256.01B);CCK8增殖检测试剂盒(日本DOJINDO,批号CK04);逆转录试剂盒(中国北京康为世纪,批号CW2569);Power SYBR Green PCR Master Mix试剂盒(日本TOYOBO,批号QPK-201);引物由Genecopoeia合成;Wnt1抗体(英国Abcam,批号ab15251);β-catenin抗体(英国Abcam,,批号ab32572);Axin2抗体(英国Abcam,批号ab32197);cylinD1抗体(英国Abcam,批号ab251892);IWR-1(美国MCE,批号HY-12238);羊抗兔二抗(英国Abcam,批号ab6747);显色液(美国Cyanagen,批号23423)。
1.1.5 主要仪器 全自动化学发光免疫分析仪(美国贝克曼库尔特有限公司,型号UniCelDxI 800);Nanno Drop 分光光度计(美国赛默飞世尔科技公司,型号NDoneC);基因扩增仪(美国MjRE-SEARCH公司,型号TTC-220);离心机(中国湖南湘仪,型号H1650R);Motic显微镜(成贯仪器上海有限公司,型号BA210T);酶标仪[美谷分子仪器(上海)有限公司,型号SpectraMax M4]。
1.2 方法
1.2.1 细胞分组及培养 分离培养的细胞增殖至对数期,将细胞分为正常组、模型组、中药高剂量组、中药中剂量组、中药低剂量组、IWR-1组6组。其中正常组以正常大鼠血清干预,模型组以正常大鼠血清+50 μg/mL ANE干预,中药高、中、低剂量组分别以高、中、低剂量含药血清+50 μg/mL ANE干预,IWR-1组以正常大鼠血清+5 μmol/L IWR-1。
1.2.2 CCK8检测EC细胞增殖 将6组细胞按105/mL浓度接种于96孔板中,每孔100 μL,共铺5板,检测时间为12、24、36、48 h 4个时间点,在检测前2 h加入CCK8 10 μL/孔,37 ℃ 5% CO2继续培养至检测时间点,取出培养板,放置于酶标仪中,450 nm和600 nm双波长检测并读数[14-15]。
1.2.3 PCR检测Wnt1、β-catenin、Axin、cylinD1基因的表达 将6组细胞按105/mL浓度接种于T25培养瓶中,培养至细胞长满培养瓶,将其消化、离心、弃上清留存细胞。以RNA提取试剂盒提取细胞RNA,具体操作步骤根据试剂盒中的使用说明进行。RNA提取后,通过逆转录试剂盒将其逆转录为cDNA,具体操作步骤根据逆转录试剂盒说明书进行。再根据反应体系将cDNA与SYBR溶液配比,进行PCR操作,并读取mean CT值和△△CT值。
1.2.4 Western blot检测Wnt1、β-catenin、Axin、cylinD1蛋白的表达 将6组细胞按105/mL浓度接种于T25培养瓶中,培养至细胞长满培养瓶,将其消化、离心、弃上清留存细胞。将细胞中加入RIPA裂解液充分裂解后离心吸取上清,以BCA蛋白浓度试剂盒测量蛋白浓度后加入蛋白上样缓冲液,100 ℃水浴加热5 min。根据蛋白分子量配置凝胶并电泳、转膜、孵抗体、显色,并读取灰度值。
1.2.5 统计学方法 采用SPSS 20.0软件进行统计分析,数据呈正态分布者采用单因素ANOVA分析,数据非正态者采用非参检验,以P<0.05为差异有统计学意义。
2 结果
2.1 CCK8检测结果
与正常组相比,模型组EC增殖被抑制,差异具有统计学意义(P<0.05);与模型组相比,中药高、中剂量组和IWR-1组均促进EC细胞增殖水平,差异均有统计学意义(P<0.05)。详见表1。
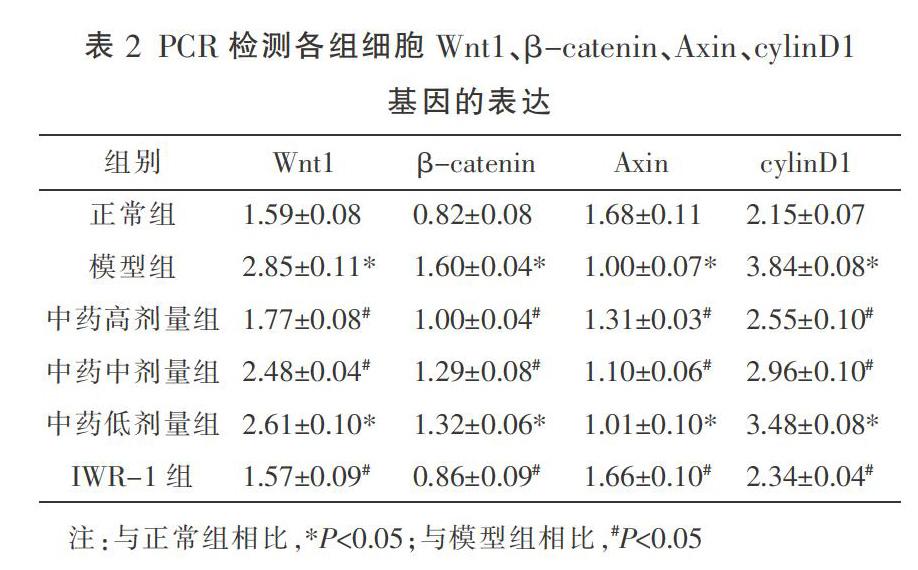
2.2 PCR检测结果
与正常组相比,模型组Wnt1、β-catenin、cylinD1基因的表达量增高,Axin基因表达量降低,差异具有统计学意义(P<0.05);与模型组相比,中药高、中剂量组和IWR-1组的Wnt1、β-catenin、cylinD1基因的表达量均降低,Axin基因表达量均升高,差异均有统计学意义(P<0.05)。详见表2。
2.3 Western blot檢测结果
与正常组相比,模型组Wnt1、β-catenin、cylinD1蛋白的表达量增高,Axin蛋白表达量降低,差异具有统计学意义(P<0.05);与模型组相比,中药高、中剂量组和IWR-1组的Wnt1、β-catenin、cylinD1蛋白的表达量均降低,Axin蛋白表达量均升高,差异均有统计学意义(P<0.05)。详见图1、表3。
3 讨论
OSF发病率高,且癌变率目前也有所增高。OSF的发病与多种因素有关,目前研究较多的是槟榔中的致癌成分槟榔碱,以及机体自身的免疫因子和通路,其中Wnt信号通路较为经典。Wnt信号传导通路有以下主要的分支:(1)Wnt/β-catenin通路;(2)WNT-Ca2+通路;(3)细胞极性通路。其中,Wnt/β-catenin通路是经典的、主要的传导通路,本文探讨的为该信号通路。
Wnt/β-catenin信号通路是一个由多种分子参与、相互影响及制约的复杂的信号转导系统,对细胞增殖和分化具有重要调节作用,Axin蛋白是Wnt信号通路中为一个重要的构形蛋白,它串联起腺瘤病大肠杆菌蛋白(adenomatosis polyposis coli, APC)、β-连环蛋白(β-catenin)、糖原合成酶激酶3β(glycogen synthase kinase-3β, GSK-3β)蛋白形成一个复合体,在正常情况下,这个复合体可使β-catenin磷酸化后被相关酶降解。但在异常情况下,Wnt配体-受体复合物抑制APC、β-catenin、GSK-3β降解复合体的稳定性,使β-catenin降解障碍,胞浆内游离的β-catenin聚集,在细胞质中达到一定浓度后进入细胞核,与转录因子相互作用,激活Wnt/β-catenin信号通路使得下游癌基因表达增加。其中cyclinD1是Wnt信号通路的一个下游基因,为细胞G1/S期的特异性周期蛋白,主要功能是刺激细胞增殖,其过度表达可以导致细胞失控,从而导致细胞癌变。
本试验通过体外培养EC细胞,以CCK8检测EC细胞的增殖,以PCR检测Wnt1、β-catenin、Axin、cylinD1基因的表达,以Western blot检测Wnt1、β-catenin、Axin、cylinD1蛋白的表达。其检测结果可见,模型组加入ANE后,EC细胞的增殖水平明显提高,且ANE促进了Wnt1、β-catenin、cylinD1基因和蛋白的表达,降低了Axin基因和蛋白的表达。中药高、中剂量组下调了EC细胞的增殖水平,且下调了Wnt1、β-catenin、cylinD1基因及蛋白的表达,上调了Axin基因和蛋白的表达,高剂量组下调水平优于中剂量组,中剂量组优于低剂量组,呈现一定的药物量效关系。IWR-1组通过阻断Wnt/β-catenin信号通路,从而降低了EC细胞的增殖水平,下调了Wnt1、β-catenin、cylinD1基因及蛋白的表达,上调了Axin基因和蛋白的表达。
中药具有疗效可靠、靶点多、无副作用而且来源广泛等优点。谭劲教授在古方桃红四物汤的基础上加减选用,由丹参、玄参、当归、红花、生地黄、白花蛇舌草、夏枯草、生黄芪、薄荷、白芍、茵陈、桔梗十二味中药制成扶正活血解毒方。方中丹参、当归、红花活血化瘀;生黄芪、白芍益气扶正;生地黄、玄参、茵陈、薄荷养阴清热;白花蛇舌草、夏枯草解毒散瘀;桔梗化痰散结。现代药理研究也表明,白花蛇舌草、夏枯草具有抗癌、增强免疫、抑制炎症因子的作用,桔梗祛痰效果显著[16-18]。全方诸药合用,共奏扶正活血、祛痰解毒之功。
从本实验结果可以看出,ANE能够促进EC细胞的增殖,也可以激活Wnt/β-catenin信号通路,促进相关基因及蛋白的表达,说明咀嚼槟榔可能是通过激活Wnt/β-catenin信号通路进而促进了OSF的发生。扶正活血解毒方能够抑制Wnt/β-catenin信号通路,降低EC细胞的增殖。IWR-1组通过加入Wnt/β-catenin信号通路抑制剂IWR-1抑制了该信号通路,降低了Wnt1、β-catenin、cylinD1基因及蛋白的表达,上调了Axin基因和蛋白的表达,中药组与IWR-1组在Wnt1、β-catenin、Axin、cylinD1基因及蛋白的表达上无明显差异。这表明中药扶正活血解毒方是通过抑制Wnt/β-catenin信号通路,从而降低EC细胞增殖产生疗效。
综上所述,本研究从Wnt/β-catenin 信号转导通路的角度探索了扶正活血解毒方的起效机制,该结果为其临床疗效提供了理论依据,同时也为临床OSF癌变的防治提供新的实验依据。然而本实验尚存在一定的不足,在探索扶正活血解毒方对OSF的影响时,未增加在体动物实验以及临床试验作为理论支持,这也是我们课题组后期的研究方向。
参考文献
[1] 黄 琰,高义军,尹晓敏.口腔黏膜下纤维性变及其癌变组织中Survivin、c-myc的表达[J].实用口腔医学杂志,2008,24(3):448-449.
[2] 邵小钧,席 庆.食用槟榔及其与口腔癌間的关系[J].国际口腔医学杂志,2015,42(6):668-672.
[3] HALLIKERI K, NAIKMASUR V, GUTTAL K, et al. Prevalence of oral mucosal lesions among smokeless tobacco usage: A cross-sectional study[J]. Indian Journal of Cancer, 2018, 55(4): 404-409.
[4] SU S C, CHANG L C, LIN C W, et al. Mutational signatures and mutagenic impacts associated with betel quid chewing in oral squamous cell carcinoma[J]. Human Genetics, 2019, 138(11/12): 1379-1389.
[5] CHATTOPADHYAY I, VERMA M, PANDA M. Role of oral
microbiome signatures in diagnosis and prognosis of oral cancer[J]. Technology in Cancer Research & Treatment, 2019, 18: 1533033819867354.
[6] NOGUTI J, DE MOURA C F, HOSSAKA T A, et al. The role of canonical WNT signaling pathway in oral carcinogenesis: A comprehensive review[J]. Anticancer Research, 2012, 32(3): 873-878.
[7] PALUSZCZAK J, SARBAK J, KOSTRZEWSKA-POCZEKAJ M, et al. The negative regulators of Wnt pathway-DACH1, DKK1, and WIF1 are methylated in oral and oropharyngeal cancer and WIF1 methylation predicts shorter survival[J]. Tumour Biology: the Journal of the International Society for Oncodevelopmental Biology and Medicine, 2015, 36(4): 2855-2861.
[8] KATASE N, LEFEUVRE M, TSUJIGIWA H, et al. Knockdown of Dkk-3 decreases cancer cell migration and invasion independently of the Wnt pathways in oral squamous cell carcinoma derived cells[J]. Oncology Reports, 2013, 29(4): 1349-1355.
[9] JI Q, LIU X, HAN Z F, et al. Resveratrol suppresses epithelial-to-mesenchymal transition in colorectal cancer through TGF-β1/Smads signaling pathway mediated Snail/E-cadherin expression[J]. BMC Cancer, 2015, 15: 97.
[10] 顾红兵,李继坤.TGF-β/Smads信号通路与胃癌关系研究进展[J]. 现代生物医学进展,2010,10(3):574-577.
[11] KI K D, TONG S Y, HUH C Y, et al. Expression and mutational analysis of TGF-beta/Smads signaling in human cervical cancers[J]. Journal of Gynecologic Oncology, 2009, 20(2): 117-121.
[12] 王者令,刘中景,宋 霆,等.扶正活血不同组方大鼠含药血清对HSC-T6增殖的影响[J].中国中医基础医学杂志,2010,16(11):1050-1051.
[13] 罗玉姣,岳金宝,吴 丹,等.扶正活血解毒方干预ANE诱导口腔黏膜成纤维细胞I型胶原表达的实验研究[J].湖南中医药大学学报,2017,37(12):1308-1311.
[14] 贾鹏宇.CCK8法检测杏丁联合吡柔比星对膀胱原代癌细胞的增值抑制作用[D].桂林:桂林医学院,2012.
[15] 刘素贞,曹晓敏,许丽娟,等.应用CCK8法检测鸡淋巴细胞活性的检测最佳条件研究[J].黑龙江畜牧兽医,2017(7):212-214.
[16] 王 静,彭解英.口腔黏膜下纤维化的易感性研究[J].口腔医学研究,2005,21(5):581-582.
[17] 谭 劲,李元聪,陈 安.丹玄口康治疗口腔粘膜下纤维化的临床研究[J].湖南中医药大学学报,2006,26(5):41-43.
[18] 冯春来,袁 颖,张海生,等.夏枯草抗肿瘤分子协同作用网络分析[J].中成药,2016,38(9):2003-2012.

