牛流行热病毒荧光定量PCR检测方法的建立
阮谦 刘应华 赵谦 王蕾 尹革芬
摘 要:鉴于牛流行热(Bovine Ephemeral Fever,BEF)对养牛行业的危害以及荧光定量PCR技术高效、快速、精准的优点,本研究针对牛流行热病毒(Bovine Ephemeral Fever Virus,BEFV)G基因建立荧光定量PCR检测方法。并用所建立的荧光定量PCR检测方法对临床采集的样本进行检测。结果显示:在GenBank数据库中对BEFV全基因组序列进行比对分析,找出保守序列,设计1对扩增BEFV G基因片段的引物,通过分子克隆构建重组质粒制备标准曲线,扩增效率是95.1%,用所建立的方法检测临床样本,阳性15份,阳性率为75%。该试验成功建立了检测BEFV的荧光定量PCR检测方法,证明云南省的牛场中广泛存在BEFV,建立的荧光定量PCR检测方法对BEFV的临床诊断和流行病学调查等具有应用价值。
关键词:牛流行热病毒;荧光定量PCR;检测方法
牛流行热(Bovine Ephemeral Fever,BEF)是由牛流行热病毒(Bovine Ephemeral Fever Virus,BEFV)引起牛機体内部温度突然升高、呼吸困难、肠胃功能异常、全身无力、不灵活和行动异常的一种传染疾病。该病传播速度极快,很多地方的牛群都难避免,并且流行具有一定的周期性。BEF可导致奶牛产奶量下降,妊娠奶牛出现流产,会给养牛业造成巨大经济损失[1-3]。该病大多发生在夏、秋蚊子活跃期,雨季或昼夜温差大容易引起流行[4]。健康牛被蚊虫叮咬后,如果该蚊虫叮咬过病牛,即会感染。目前,BEFV被归入弹状病毒科,病毒外型为子弹型,核酸为单股负链RNA,有5种结构蛋白,对脂类物质敏感[5-6]。
据近年来的相关报道,BEF对牛群的危害日趋严重,所以需要建立一种实用、敏感且快速便捷的分子检测方法,以便做到早确诊、早隔离、早治疗,最大限度地降低BEF带来的损失[7]。为了满足现今牛场对BEF的检测要求,本研究针对BEFV的G基因设计一对特异性引物,建立荧光定量PCR检测方法,为临床上BEF的诊断提供支持。
1 材料与方法
1.1 材料
1.1.1 样本采集
样本均采自云南省大理州两个规模化牛场,为疑似BEFV感染的20份新鲜血液样本,阳性对照为BEF疫苗。
1.1.2 主要仪器
移液器(KA0052521,DRAGON公司)、超净工作台(SW-CJ-1FD,苏州净化设备有限公司)、高速冷冻离心机(75005440,Thermo Fisher Scientific公司)、凝胶成像系统(Tanon-1600,天能科技有限公司)、电泳仪(DYY-7C,北京六一仪器厂)、荧光定量PCR仪(580BR 12007,BIO-RAD公司)、恒温水浴锅(HWS12,上海一恒科学仪器有限公司)。
1.1.3 主要试剂
RNAiso Plus购自宝生物工程(大连)有限公司(Cat. No.9109);DEPC购自Sigma公司(Cat. No.V900882);氯仿、异丙醇、无水乙醇等由笔者的实验室提供,均为分析纯;荧光定量PCR相关试剂:反转录试剂iScriptTM cDNA Synthesis Kit购自BIO-RAD公司(Cat. No.170-8891);荧光染料SsoFastTM EvaGreen? Supermix购自BIO-RAD公司(Cat. No.172-5201AP)。
1.1.4 引物设计
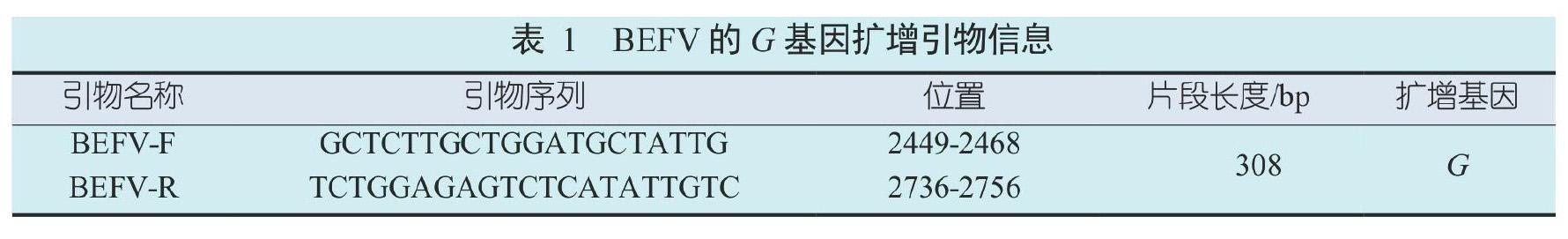
根据NCBI GenBank中公布的BEFV基因序列(MN781183.1、KY012742.1),设计一对扩增G基因片段的特异性引物(表1)用于PCR检测。设计好的引物送昆明硕擎生物公司合成。
1.2 方法
1.2.1 BEFV RNA的提取
在2 mL离心管中加入300 μL处理好的疫苗及样本,加入1 mL RNAiso Plus(TRIZOL),用力震荡,使RNAiso Plus(TRIZOL)与样本均匀混合,4 ℃静置 10 min;10 min后加入200 μL的氯仿,用力震荡,4 ℃静置10 min,12 000 r/min离心15 min;小心吸取上层无色溶液约 500 μL于无RNAase的1.5 mL新离心管中,加入等量异丙醇,4 ℃静置10 min,12 000 r/min离心10 min,使RNA沉淀于离心管底部;小心倒去上清,向离心管内加1 mL 75%乙醇清洗,7 500 r/min离心5 min;倒去上清,轻甩,用吸水纸吸干离心管壁上的液体,每管加入20 μL DEPC水溶解RNA。
1.2.2 反转录及荧光定量PCR
参考反转录试剂盒(iScriptTM cDNA Synthesis Kit)的说明书,将提取的RNA反转录为cDNA。荧光定量PCR反应体系如下:SsoFastTM EvaGreen Supermix(2×) 10 μL,上游引物(10 μM)0.8 μL,下游引物(10 μM)0.8 μL,cDNA 1.5 μL,无RNase水6.9 μL,反应总体系为20 ?L。荧光定量PCR反应程序:95 ℃预变性30 s;95 ℃变性10 s,50 ℃~ 60 ℃梯度退火20 s;循环35次;收集溶解曲线65 ℃升高到95 ℃,每5 s升高0.5 ℃。
1.2.3 荧光定量PCR标准曲线的建立
以BEF疫苗为模板进行PCR扩增。PCR产物用2.0%琼脂糖凝胶电泳检测,回收纯化后克隆于pMD18-T载体。对重组质粒进行酶切及测序鉴定。将构建成功的标准质粒按10倍梯度稀释(10-1、10-2、10-3、10-4、10-5、10-6、10-7),用不同稀释度的样本作为扩增模板;以X轴为标准质粒的起始模板量,以Y轴为荧光定量PCR获得的循环数,绘制BEFV的荧光定量PCR标准曲线。
1.2.4 临床样本的检测
用建立的荧光定量PCR检测规模化牛場送检的临床症状疑似牛流行热感染的20份牛新鲜血液样本,以了解该病在云南省牛场的感染情况。
2 结果与分析
2.1 目的片段的扩增鉴定
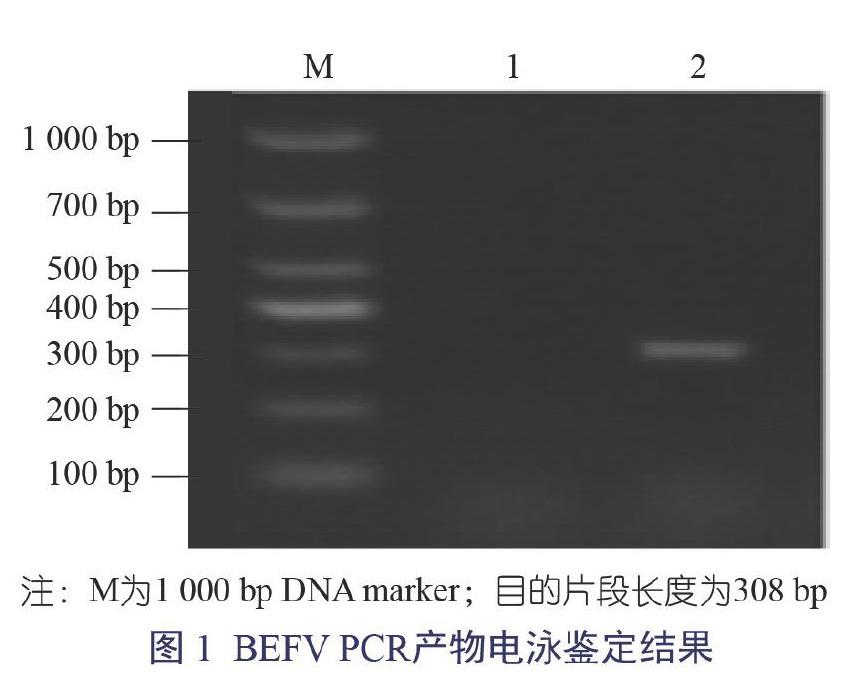
提取BEF疫苗中的疫苗毒株RNA,用所设计的特异性引物反转录后进行荧光定量PCR扩增,根据优化过的反应体系及引物的退火温度,扩增所得目的片段与预期扩增片段大小308 bp相符,图1是电泳结果。
2.2 构建BEFV 荧光定量PCR的标准曲线
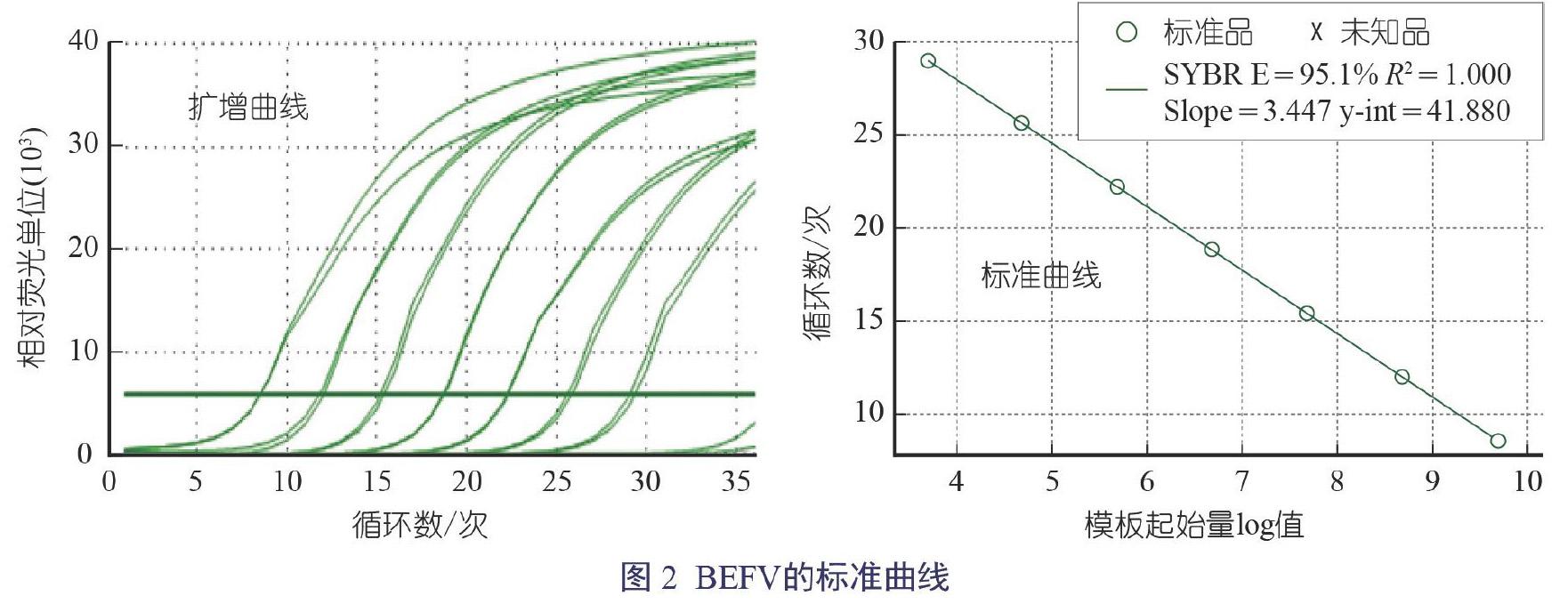
BEFV溶解曲线峰值均单一,在阴性对照中,没有发现特异性扩增,可知引物特异性良好;分析显示:R2>0.99,0.9≤E≤1.1,35个循环内既没有扩增非特异性产物,也没有产生引物二聚体,说明构建标准曲线成功。阳性质粒扩增后提取浓度为162 ng/μL,目的片段长度为308 bp,经计算得到质粒拷贝量为4.91×10-10,证明所建立的荧光定量PCR方法可进行绝对定量分析。标准曲线如图2所示。
2.3 临床样本检测
利用建立的荧光定量PCR方法检测了大理州2家规模化牛场送检的20份疑似牛流行热感染的血液样本,检测显示阳性样本15份,证明建立的荧光定量PCR检测方法可用于临床试验以及BEFV流行病学调查等。部分样本检测结果如图3所示。
3 讨论
牛流行热是牛(主要为奶牛)的一种急性、热性、病毒性传染病,在我国曾有几次波及20个以上省、直辖市和自治区的大流行。该病危害奶牛的健康,导致产奶量减少,还会导致牛不能正常走动,从而损失经济价值,牛群一旦感染会快速大范围发病,造成巨大损失[8-9]。疾病的诊断要早和快,防治该病的前提条件是能否对该病建立快速、准确的检测。我国目前对该病的各种检测方法研究不足,且操作麻烦,既耗费时间又浪费精力。因此,建立一种快速准确且经济实惠的实验室诊断方法尤为迫切[10]。
本文通过反应条件优化、特异性检测和灵敏度检测,成功建立了BEFV 荧光定量PCR检测方法。应用建立的荧光定量PCR方法对云南部分地区送检病料进行检测分析,20份样本中阳性样本有15份,阳性率达75%,说明当前牛流行热在牛场广泛流行,我们应对该病给予一定的关注。本次试验建立的牛流行热检测方法可以为该病的实验室检测提供技术支持和参考。
参考文献:
[1] 岳瑞超. 牛流行热病例的综合诊断[D].济南:山东农业大学,2014.
[2] 刘雨田,孙军峰,郭安玉. 牛流行热研究进展[J]. 中国动物检疫,2010,27(6):67-69.
[3] 李成,谷守林,姜绍德,等. 应用电镜技术对牛流行热病毒形态学的研究[J]. 电子显微学报,1993(1):35.
[4] Bovine diseases and conditions - bovine ephemeral fever yirus; studies from shandong normal university in the area of bovine ephemeral fever virus reported (Annexin A2 gene interacting with viral matrix protein to promote bovine ephemeral fever virus release)[J]. Agriculture Week,2020,
[5] 沈加丽,龚祖埙. 弹状病毒研究的新进展Ⅱ.病毒的结构蛋白、转录、复制和核衣壳化的研究[J]. 中国病毒学,1998(4):3-5.
[6] 金红,李媛,于康震,等. 牛流行热病毒JB76H株G蛋白基因核苷酸序列分析[J]. 中国预防兽医学报,2000(1):44-48.
[7] 金红,李媛,宋晓华,等. 牛流行热病毒人工感染牛外周血淋巴细胞T淋巴细胞亚类的分布研究[J]. 中国预防兽医学报,2002(5):12-14.
[8] 金红. 牛流行热病毒外膜糖蛋白G基因在重组病毒中的表达研究[D]. 哈尔滨:东北农业大学,2000.
[9] 朱庆虎,陈弘,刘兰刚,等. 牛流行热免疫学浅析[J]. 畜牧兽医科技信息,2011(1):1-3.
[10] 邹莉萝,刘耳,梁开烈. 牛流行热流行病学调查、诊断及防制[A]. 重庆市工程师协会.重庆工程师论文集[C].重庆:重庆市科学技术协会,2014:8.

