萜类化合物在酿酒酵母中的合成生物学研究进展
李佳秀 蔡倩茹 吴杰群
(浙江工业大学绿色制药协同创新中心,杭州 310014)
萜类化合物(Terpenoids)是自然界中普遍存在的最大类的天然产物,目前已鉴定得到的种类超过55 000多个,占所有天然化合物的60%[1]。萜类化合物多样性丰富,具有广泛的生物学功能,作为代谢产物在细胞层面影响其组成和能量供应,作为激素等媒介因子影响生物体之间的拮抗和互生共生关系[2]。萜类化合物可以保护多种植物、动物和微生物免受捕食者、病原体和竞争者的攻击,并参与生物种群中关于食物、配偶和敌人的信息传达[3]。在过去几十年中,由于其多样的生物活性和极高的生物利用价值,萜类化合物已被广泛用于医药和工业应用领域,市场需求巨大[4-5]。
目前,萜类化合物有以下3种生产方式:传统提取法、化学合成法以及微生物合成法。由于大多数产业应用规模化的萜类化合物为次级代谢产物,含量较低且分离过程复杂,从天然原料中提取的萜类化合物的产量难以满足市场需求,且会消耗大量生物资源,对生态环境造成不可逆的影响[6]。例如,人参干燥根中人参皂苷的含量仅为其干重的0.01%[7]。提取1 kg的紫杉醇需要砍伐数千株成熟红豆杉,为提供一个癌症病人所需的治疗剂量需要牺牲2-4株成年树[8]。同时,由于萜类化合物本身结构复杂,通过化学方法全合成复杂萜类化合物的路线繁琐,反应条件、原料较为苛刻,得率极低,同样不能满足工业生产需要。例如,紫杉醇的全合成需要35-51个步骤,最高产率仅0.4%[9]。微生物发酵生产萜类化合物具有成本低廉、绿色环保、生产效率高等优势,近年来合成生物学的兴起也使真核来源的复杂萜类化合物的微生物合成得以实现。
合成生物学是一门综合学科,它将工程方法与化学、生物学、数学和物理学等基础科学方法相结合[10],在非自然化学系统中重现了生命系统遗传和进化的特性[11]。依托合成生物学技术平台,科学家们在复杂萜类化合物来源生物(微生物、植物和真菌)中收集与其生化途径相关编码酶的基因,对其修饰和改良后引入经工程改造、适合生产的底盘细胞中,从而实现高价值萜类化合物的生物合成[6]。抗疟疾药物青蒿素前体青蒿酸在酿酒酵母中的高效异源表达就是合成生物学研究的标志性成果[12-13]。目前,通过合成生物学与后续化学修饰工艺耦合,青蒿素的工业生产成本已与植物提取相当。自此,关于微生物合成复杂萜类化合物研究的创新成果层出不穷。人参皂苷Rh2来源于人参属植物,是一种癌症预防及治疗的候选药物。Wang等[7]通过模块化工程设计优化了甲羟戊酸途径以及人参皂苷P450酶的表达水平,构建了高产人参皂苷糖苷配糖原二醇(Protopanaxadiol,PPD)的底盘细胞,从而提高了人参皂苷Rh2的产量(10 L发酵罐分批补料发酵产量为2.25 g/L)。青蒿素和人参皂苷仅是数以千计潜在的高价值萜类化合物中的两种,合成生物学方法为合成多元化高价值萜类化合物提供了可持续的生产途径,并为新化合物的发现开辟了新的可能性。
酿酒酵母由于其遗传操作便捷、培养成本低、抗噬菌体感染、具有真核表达修饰系统等特点,被广泛用于生产各种小分子和大分子化合物,是许多生物过程的首选底盘细胞[14-15]。近年来,基因合成成本大幅降低[16],基因编辑技术不断革新(如CRISPR/Cas系统的应用[17]),合成生物学在生物技术工业中的应用正在加速发展[18-19]。越来越多基于酿酒酵母底盘细胞的合成生物学策略应用于高价值萜类化合物的生物合成。因此,本文将从优化异戊二烯前体途径酶、改造中央碳代谢、平衡竞争途径、异源表达细胞色素P450酶4个方面阐述在酿酒酵母底盘细胞中高价值萜类化合物的合成生物学的最新策略与进展。
1 优化异戊二烯前体途径相关酶
萜类化合物定义为以2-甲基丁-1,3-二烯(又名异戊二烯,Isoprene)碳骨架为基本单元的碳氢化合物及其衍生物,其起源于前体物质异戊烯基焦磷酸(Isopentenyl diphosphate,IPP)和二甲基烯丙基焦磷酸(Dimethylallyl diphosphate,DMAPP)[20]。IPP和DMAPP在不同生物体内涉及两种不同的途径:在大多数原核生物和植物细胞质体中,这些化合物通过甲基-D-赤藓糖醇-4-磷酸(2-C-methyl-Derythritol 4-phosphate,MEP)途径产生(图1-A),而在大多数真核生物、古细菌和某些原核生物(具有核心类异戊二烯途径模块)中,其通过甲羟戊酸(Mevalonate,MVA)途径产生(图1-B)[21]。
前体在代谢工程中是一个关键的限制因素,增加异戊二烯的前体供应可以提高萜类化合物的产量。基于酿酒酵母内源的甲羟戊酸途径,增加前体DMAPP和IPP供应的传统策略是优化MVA途径相关酶(图1-B)[22]。早期研究表明,MVA途径中大多数结构基因(ERG10、ERG13、HMGR、ERG12、ERG8、IDI1和ERG20)的过度表达,都可以增加萜类化合物的产量[23]。此外,HMG1的N端截短版本(tHMG1)的过表达可催化其蛋白C端定位于细胞质,从而解除法尼基焦磷酸(Farnesyl pyrophosphate,FPP)的反馈抑制,可显著增加角鲨烯的生产[24-25]。这种截短修饰被广泛应用于萜类化合物的生产,例如檀香烯的生产[26]。组合设计是求解复杂代谢途径最优解的有效策略。Song等[27]结合启动子、整合拷贝数、染色体整合位点等因素,对于MVA途径关键酶进行组合洗牌优化,可使香叶基香叶醇的产量提高至1 315.44 mg/L。
除了内源的MVA途径,也有研究将异源的异戊二烯前体途径引入酿酒酵母基因组中[28]。由于NADH需要氧气氧化来维持氧化还原状态,而MEP途径不会产生额外的NADH,因此导入异源MEP途径相关酶(DXS、IspC~H等基因)的工程酵母能够在低曝气条件下仅依靠MEP途径而不是MVA途径来合成萜类化合物(图1-A)[29]。将带有线粒体靶向信号序列的MVA途径基因整合到酿酒酵母基因组中,构建得到具有天然的胞质MVA途径和工程的外源线粒体MVA途径的酿酒酵母底盘细胞,其可以同时利用胞质和线粒体乙酰辅酶A,可使工程酵母中异戊二烯的产量提升至2.5 g/L(图1-C)[30]。
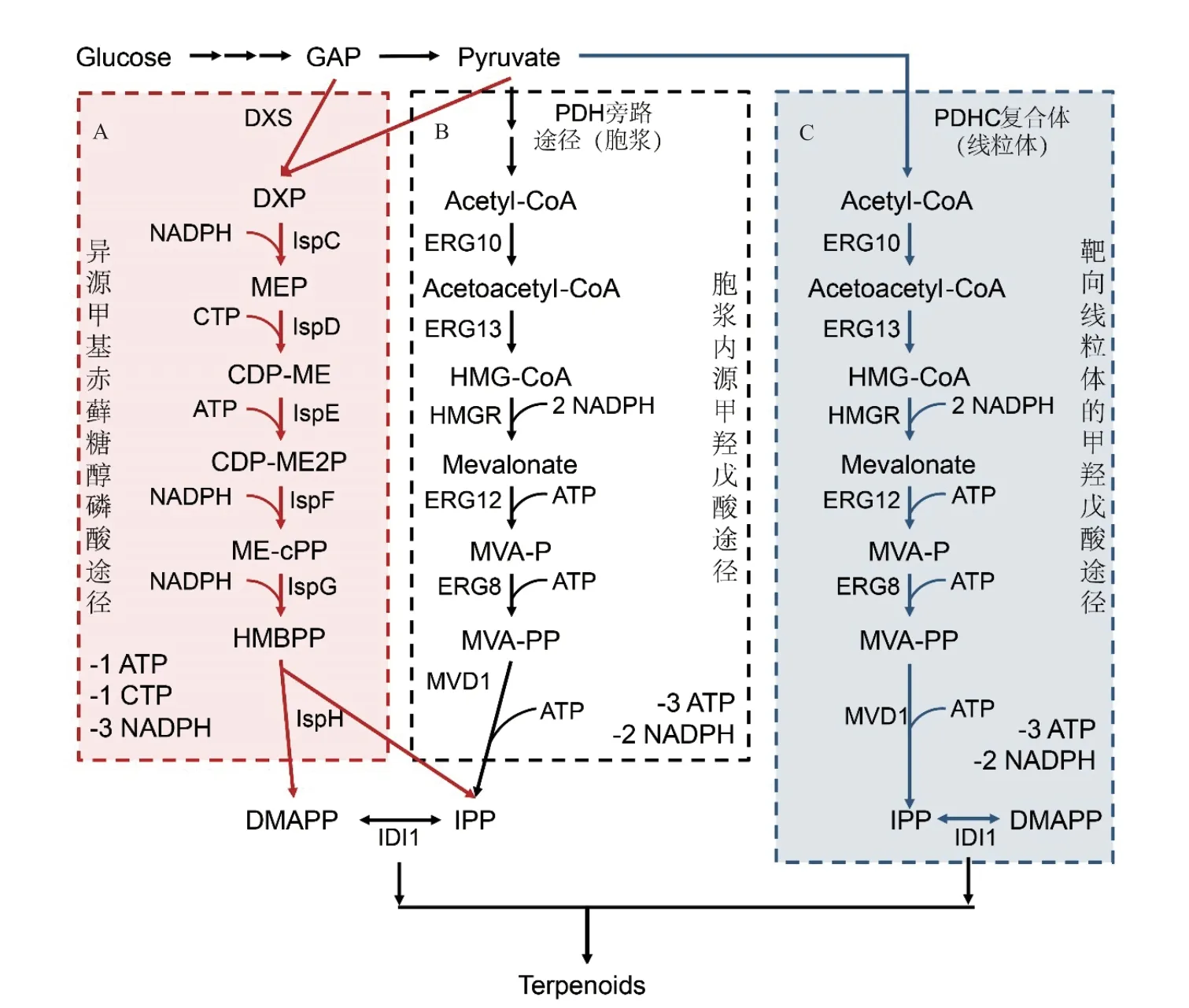
图1 萜类化合物的生物合成的前体途径优化策略
2 提高乙酰辅酶A利用率的中心碳代谢研究进展
在酵母中,乙酰辅酶A(Acetyl-CoA)连接了中心碳代谢与甲羟戊酸途径,是萜类化合物合成的重要代谢节点。酵母中的乙酰辅酶A合成途径较为复杂,主要分为两个部分:细胞质中的乙酰辅酶A通过糖的分解代谢生成,其中涉及的酶为PDH旁路中的乙醛脱氢酶(ALD6)、乙酰辅酶A合成酶(ACS)及丙酮酸脱氢酶(PDC);线粒体中的乙酰辅酶A通过丙酮酸脱氢酶复合体(PDHC)产生,该途径为细胞内乙酰辅酶A的主要合成途径。不同细胞器间生成的乙酰辅酶A没有直接转运[31]。针对PDH旁路,过量表达乙醛脱氢酶(ALD6)、乙酰辅酶A合成酶(ACS)以及丙酮酸脱羧酶(PDC)是在酵母中增加乙酰辅酶A供应的传统策略(图2-A),通过此策略可显著提高紫穗槐二烯的产量[32]。
真核细胞的代谢被划分在不同的亚细胞器中,不同细胞器合成的乙酰辅酶A不能透膜,乙酰辅酶A主要在线粒体中通过PDHC复合体产生,但目标代谢产物的生物合成通常在细胞溶胶中进行。因此将线粒体中的PDHC复合体重建至胞浆具有重要意义(图1-B),可以在不积累副产物乙醇、不依赖ATP的情况下增加胞内乙酰辅酶A的供应[33]。然而,由于PDHC复合体亚单位活化辅因子硫辛酸的生物合成定位于线粒体,PDHC复合体在胞浆中的重建具有挑战性[34]。

图2 乙酰辅酶A的中央碳代谢优化策略
研究表明,天然乙酰辅酶A合成酶(ACS1、ACS2)对ATP的需求限制了MVA途径下游产物的产量[33]。一项对途径化学计量、自由能供应和氧化还原平衡的研究发现,当含有ATP依赖与ATP不依赖相关酶的乙酰辅酶A合成路线耦合时,法尼烯的理论产率最高[35]。然而,要实现乙酰辅酶A合成在这两条途径之间的精确分布,需要先进的合成生物学工具来平衡酶的相对表达水平和代谢通量。回顾近年的合成生物学进展,该设想已经实现。Meadows等[36]结合几种策略来提高MVA途径的能量效率并降低细胞需氧量,最终使酿酒酵母发酵产生了体积分数为15%的法尼烯。这些策略(图1-C)包括异源表达5-磷酸木酮糖(X5P)特异性磷酸酮醇酶(xPK)和磷酸转乙酰化酶(PTA),打通从X5P到乙酰辅酶A的通路,减少糖酵解带来的碳损失;异源表达乙醛脱氢酶(ADA),降低ATP需求;通过敲除内源RHR2等基因,下调细胞原有PDH旁路流量。这种人工构建的非天然途径将碳利用率(葡萄糖转化为萜烯的比例)提高了20%,氧气利用率提高至惊人的280%,使萜烯的工业生产成本大大降低,商业化规模生产变得可能。这也预示着中央碳代谢工程正处于一个高度活跃的领域,仍有许多针对于此的遗传修饰可以尝试,增加MVA途径通量的潜力巨大。
3 平衡竞争途径
3.1 在C15节点上控制MVA路径竞争
酵母MVA途径提供了几种重要代谢物质,例如麦角固醇、泛醌、法尼醇、血红素A、多氢酚等[37]。其中麦角固醇由鲨烯合酶(ERG9)将两个C15法尼基焦磷酸(FPP)分子缩合得到。由于青蒿素和法尼烯等C15类异戊二烯产品也需要FPP作为前体,目标C15代谢产物合成与细胞自身生长所需代谢产物合成之间存在直接竞争关系[38]。通过更换启动子(替换为MET3p或CRT3p启动子)下调鲨烯合酶的表达,可以减少FPP向甾醇路径的通量(图3-A)[39];通过将蛋白质降解标签附着到角鲨烯合酶的C端,也可以成功地下调甾醇表达,该方法使奈洛哌啶醇的滴度提高86%,产量达100 mg/L[40]。通过dCas9靶向MVA途径的启动子来调控相关途径酶的活化或抑制,实现转录水平的精细调节,从而控制通量流向,使得目标产物胡萝卜素的产量得到提升[41]。其他基因表达的动态调控方法也已证明可用于控制酵母生长与生产之间的竞争,但尚未应用于类异戊二烯合成。例如,合成群体感应[42]、RNA干扰[43]、合成杂交启动子[44]、合成应激反应启动子[45]、合成mRNA茎环结构和核糖开关[46],以上策略都具有MVA途径中的通量重定向潜力。
3.2 C10和C20的异戊二烯磷酸代谢
C10单萜具有多种用途,可作为香料和高级生物燃料。由于MVA途径中没有专用的C10前体合酶,天然通量都被“聚集”到C15的生产中。天然酵母FPP合酶(ERG20)是一个双功能酶,它催化C5异构体IPP和DMAPP缩合产生C10前体牻牛儿基焦磷酸(Geranyl diphosphate,GPP),同时GPP与IPP缩合生成C15前体FPP。ERG20的催化作用不会在GPP生成之后停止,导致GPP无法积累;同时FPP又是生物体内必不可少的前体物质,因此传统的通量重定向技术(例如基因敲除)是不可行的。为克服该问题,Ignea等[47]使用各种蛋白质工程技术成功地将天然FPP合酶(Erg20p)转化为GPP合酶(Erg20pF96W-N127W),使桧萜的产量增加了340倍(图3-B)。重要的是,工程改造的FPP合酶保留了低水平的FPP合成能力,使其具备麦角甾醇合成能力以支持细胞生长。将蛋白质降解标签K3K15与ERG20蛋白融合,同时结合甾醇应答启动子进行动态反馈调节,可使芳樟醇的产量提高27倍(图3-C)[48]。通过引入异源橙花基焦磷酸(Neryl diphosphate,NPP)合成酶,构建单萜化合物正交合成途径,可以在不阻碍细胞生长的情况下高水平生产单萜(图3-D)[34]。Cheng等[49]提出了工程化正交柠檬烯生物合成(OLB)途径的策略,该策略组合NPP合成酶、以NPP为底物的柠檬烯合成酶,在酵母中实现了柠檬烯的高效合成。Ignea等[50]在酿酒酵母中引入西红柿来源的橙花基二磷酸合酶(NPPS)合成NPP,替换原始前体GPP,构建酵母萜类化合物正交网络,并通过鉴定决定单萜合酶中的异构底物选择性的单一残基F571,对5种不同的单萜合酶进行改造,以更高的速率与特异性接受替代底物NPP,实现了单萜化合物的高效合成。
C20二萜可形成结构复杂的分子,例如抗癌药前体紫杉二烯[51]和香紫苏醇等[52]。尽管酵母中有内源性香叶基焦磷酸(Geranylgeranyl diphosphate,GGPP)合酶(BTS1)生成C20前体,但它不能与ERG9和ERG20蛋白的催化作用进行有效竞争,这意味着GGPP库的通量相对较小。Ignea等[52]通过氨基酸替换的方法对ERG20中同源区域的活性位点进行逆向进化,从而将FPP合酶(Erg20p)转化为GGPP合酶(Erg20pF96C),实现了二萜化合物的工业化生产(图3-E)。
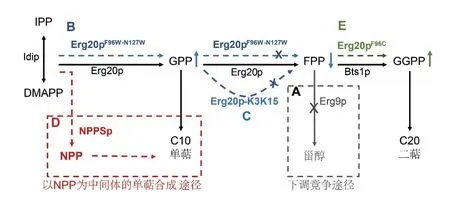
图3 竞争路径平衡策略
4 细胞色素P450酶介导的萜类合成
类异戊二烯的合成生物学的另一个新兴领域是通过细胞色素P450介导的氧化修饰反应生产复杂萜类化合物(例如抗疟药青蒿素、抗癌药紫杉醇和抗癌/抗炎化合物丹参酮等)[53-54]。P450可催化多种氧化反应,包括向sp3杂化的碳原子引入氧原子、C=C双键的环氧化、氮氧化、脱胺、脱卤和脱烷基化。此外,P450还可以催化特殊的重排反应以及C-C键的断裂等其他反应[55]。
与大肠杆菌相比,酵母作为萜类化合物的合成生物学“底盘细胞”,具有独特的优势,因为它兼顾了真核系统的功能性表达体系(可以表达复杂的真核蛋白,如细胞色素P450)和大规模微生物发酵的固有优势。目前,酿酒酵母已经成功表达多种具有功能活性的植物来源的P450[56]。青蒿素在酿酒酵母中的半合成可以追溯到2006年[57],首先通过导入黄花苜蓿中的紫穗槐二烯合酶(ADS)、紫穗槐二烯氧化酶(细胞色素P450酶,CYP71AV1)及其同源还原酶(CPR1)至酿酒酵母中,合成得到高达100 mg/mL青蒿酸[58]。然而。前体紫穗槐二烯在酵母中的表达量(150 mg/L)与大肠杆菌(25 g/L)相比很低[13],紫穗槐二烯转化为青蒿酸的能力也很差[53]。研究表明,高水平的青蒿酸生产与CYP71AV1及其同源还原酶的表达并非显著相关,而是需要另外3种植物酶CYB5、ADH1和ALDH1的联合表达来提高产率。此外,CYP71AV1:CPR1的表达比例也很关键,通过降低CPR1的表达,优化CYP71AV1:CPR1的表达比例,可实现青蒿酸的高水平生产(图4-A),其在2 L发酵罐中产量高达25 g/L[12]。
实验室规模的紫穗槐二烯和青蒿酸生物合成的工作在2008年完成[12,23],而随着青蒿酸转化为青蒿素的化学工艺开发,青蒿素的商业化生产也于2013年实现[13,59]。合成生物学技术的发展使得研究者对P450酶的酶学信息的理解更加深入,打破了P450酶在微生物宿主中催化效率低、专一性差等困境,使得微生物高效合成复杂萜类化合物成为可能。此外,应用其他来源细胞色素P450合成高价值萜类化合物也是该领域研究的热点。例如,在酵母中引入大戟和麻疯树来源基因ElC9OX1和JcC5OX2与ADH共表达,可促进千金二萜烷重要前体Jolkinol C的生物合成(图4-C)[60]。通过进化树分析,鉴定得到缬草中缬草酸合成所需P450酶VoCYP71DJ1,将其引入甲羟戊酸高表达的酵母菌株中,同时异源表达黄花蒿来源的脱氢酶AaADH1和AaALDH1,可成功合成倍半萜缬草酸(图4-B)[61]。Grewal等[62]通过在酵母中异源表达P450酶CYP76AD1W13L、MjDOD、Mj-cDOPA5GT构建得到甜菜碱生物全合成通路,效价为17 mg/ L(显色强度与10 g/L甜菜根提取物相对应),并可通过喂养不同的氨基酸使其呈现不同颜色。Sun等[63]通过计算机建模识别分析以及实验改造来源于植物的P450单加氧酶CYP72A63中影响其化学和区域选择性的关键残基,从而改变其催化特性,实现了4种稀有甘草三萜化合物的特异性合成。Dai等[64]通过转录组分析以及酵母代谢工程平台筛选得到了一种来源于植物山楂果实的P450氧化酶CYP716C49,通过实验证明了酶具有广泛的底物特异性,可用于五环三萜类化合物的C-2α位氧化。在迷迭香和一些鼠尾草物种的研究中,Bathe等[65]发现了两组主要的细胞色素P450加氧酶,它们与松香烷二萜前体的氧化有关,其中CYP76AHs产生铁锈醇和11-羟基铁锈醇,而CYP76AKs在其C20位催化氧化;通过使用模块化的Golden-Gate酵母表达组装系统,系统地对这些酶进行了单独或组合的催化测试,共检测到其催化产生了14种松香烷二萜,其中8种是目前为止尚未报道的新化合物。
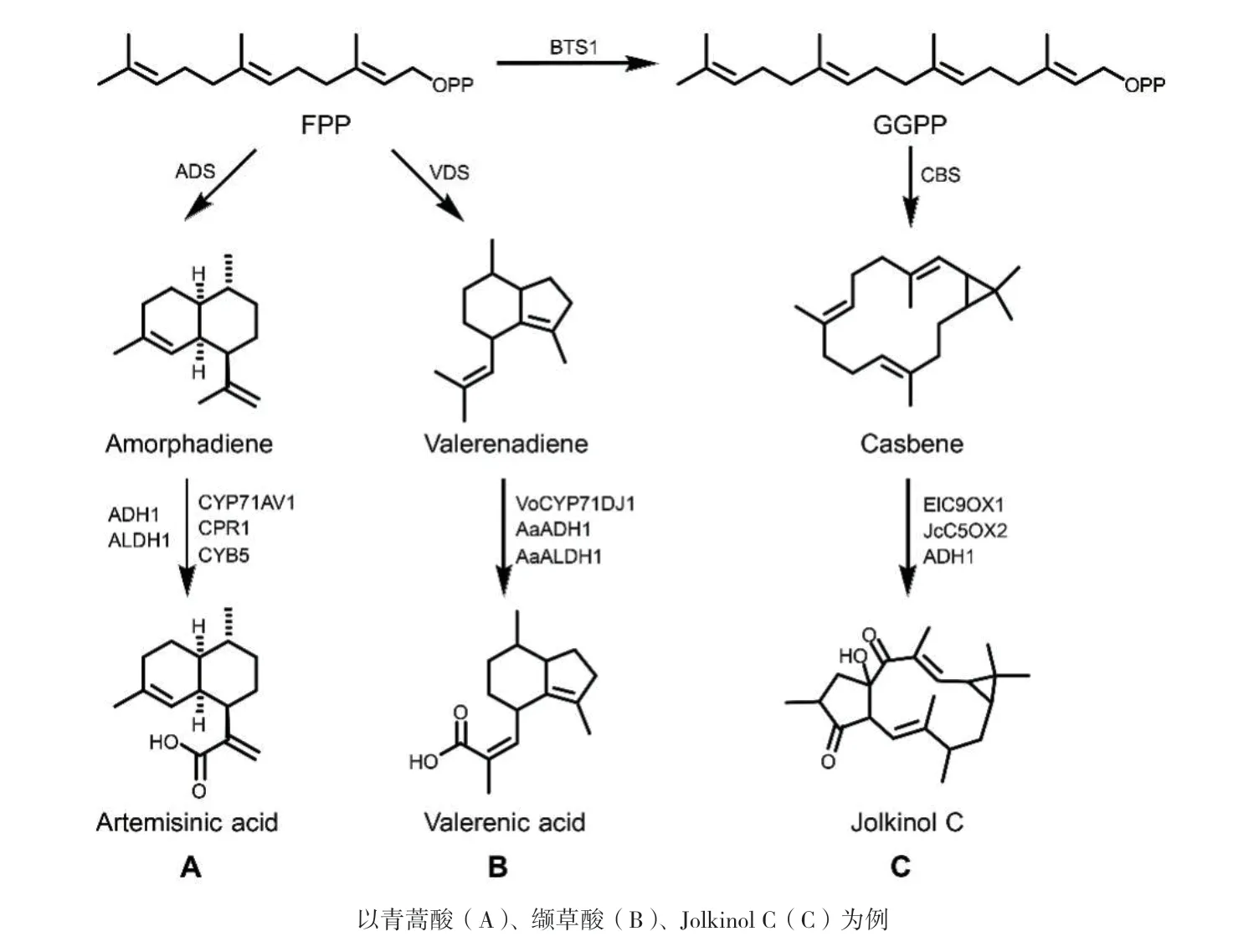
图4 细胞色素P450酶介导的复杂萜类化合物的生物合成
5 展望
近年来,合成生物学的迅猛发展为微生物工厂生产高效、可持续的高价值萜类化合物开辟了新的机遇。合成生物学结合多个科学学科知识与工程学原理,将不同功能模块引入适合大规模生产的微生物底盘细胞,扩展了原有生物系统生产高价值萜类化合物的可能性。应用合成生物学新工具与新方法,使得萜类化合物微生物合成的传统策略重放异彩,创新成果也层出不穷:如异戊二烯前体途径的优化不再每次只针对一种酶,而是通过合成生物学手段对其进行组合优化;细胞原有中央碳代谢的能量利用效率不高,则引入异源途径进行精密耦合;酶的定向进化与修饰方法的成熟也显著改善了目标萜类化合物合成酶催化效率不高、专一性低等问题,单萜二萜化合物的富集得以实现,复杂萜类化合物的异源细胞色素P450酶也得以高效表达。
尽管合成生物学还是一门年轻的学科,但随着基因组装、基因组编辑和数学建模技术的迅速发展,该领域正在迎来巨大的发展。这些进展加速了天然产物复杂的代谢途径在底盘细胞中的装配过程,也缩短了合成生物学研究的设计-建造-测试周期。同时,酿酒酵母作为常用的微生物工业生产菌株,在高价值萜类化合物的生物合成上显现出了巨大的潜力。在可预见的将来,酿酒酵母作为底盘细胞在高价值萜类化合物的生物合成工业上仍将保持其最前沿的位置。

