紫草素对肝损伤的保护作用
马芳芳,王 萌,覃 圣,胡慧楠,阿依木古丽·阿不都热依木,王明明
(1.西北民族大学 生命科学与工程学院, 甘肃 兰州 730030;2.甘肃农业大学 动物医学院,甘肃 兰州 730070)
肝脏是人和动物最重要的内脏器官之一,引起肝损伤的原因很多,常见的有药物、酒精、饮食、年龄、射线以及不同病原等.肝脏疾病是医学上面临的主要问题,因急性肝损伤引起的死亡率依然在上升.因此,对肝损伤保护性药物的研发显得尤为重要.已有研究表明,紫草素具有良好的抗炎[1]、抗氧化[2]、保肝[3]和护肝[4]等作用.
1 紫草素的生理功能
紫草素(Shikonin),又称紫草红或紫草宁,分子式如图1所示,是紫草科植物紫草中提取的一类萘醌类化合物,具有较强的脂溶性,是紫草生物活性成分中作用最广泛的一种[5].β,β-丙乙烯酰阿卡宁、乙酰紫草素是紫草素的主要有效成分,都属于紫草宁衍生物,常以酯形式存在.紫草素具有传递电子和质子的作用,所以通过对一些生化反应的影响,来调节生物机体的药物代谢过程,表现出多种生物活性[6].
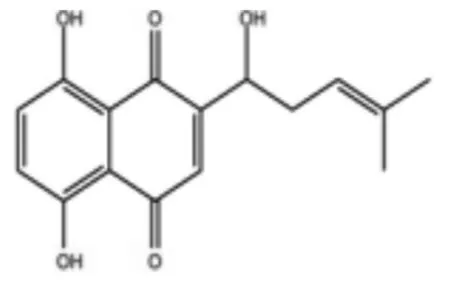
图1 紫草素分子式[7]
紫草素有较强的抗炎药理活性,王文杰等[1]161研究表明紫草素对小鼠巴豆油耳炎和大鼠酵母性足趾肿有明显抑制作用.紫草素对超氧自由基和1,1-二苯基-2-苦苯肼自由基均有较强的清除能力,并对β-胡萝卜素自氧化体系有明显的抑制作用,表明紫草素具有抗氧化活性[7].张萍等[8]研究发现经紫草素治疗可明显改善荷肝癌裸鼠饮食状况和精神状态,加快肿瘤细胞凋亡,可使移植瘤瘤体减小,肿瘤活动度降低,具有较强的抗肿瘤作用.刘彤等[3]7研究发现紫草素通过激活PI3K/Akt通路可对肝脏缺血及再灌注引起的损伤起到保护作用.于明欣等[9]研究发现紫草素可直接作用于内皮细胞,通过抑制其增殖、迁移及管腔形成而发挥其抗血管新生作用.紫草素同时具有降血糖[10]、杀菌[11]等作用.
2 肝损伤机制
肝损伤是指由多种致病因素引起肝细胞受到破坏,进而影响肝脏的正常功能,引起机体一系列不适症状及肝功能指标异常[12].常见致病原因主要包括以下几种:药物性肝损伤,常由西药、传统中药、保健品、生物制剂、减肥药、膳食补充剂及其代谢产物等引起[13];病毒性肝损伤,如嗜肝病毒引起的甲肝、乙肝等肝损伤[14];酒精性肝损伤,主要是指乙醇对肝脏的直接毒性及其代谢产物对肝细胞功能的影响[15];自身免疫性肝损伤,主要是遗传因素及自身免疫性疾病,如类风湿性关节炎、甲状腺炎、溃疡性结肠炎、1型糖尿病等破坏肝细胞导致肝损伤[16];非酒精性脂肪性肝损伤,多伴有肥胖、高血压、糖尿病等代谢综合征,发病与脂质代谢异常相关[17].
随着新药的不断研发和药品使用种类的增加,药物性肝损伤有逐年上升的趋势.有些地方由药物引起的急性肝功能衰竭占肝衰竭发生总量的10%~52%,病死率为11.9%[18],肝脏很容易受到药物和药物代谢产物的损害.已明确有1000多种药物引起肝脏的损伤.因此,药物性肝损伤是目前面临的主要问题.药物性肝损伤或称药物性肝病[19]是指中药或西药本身或着它们的活性代谢产物所导致的肝功能不全,严重时可导致死亡.药物性肝损伤的发生是多重因素综合作用的结果,发生机制涉及药物的直接肝毒性、特异质肝毒性、线粒体功能损伤、氧化应激和炎症反应等多个方面[20~21].
2.1 药物的直接肝毒性
药物本身或其代谢产物直接引起肝细胞的损伤,最常见的就是对乙酰氨基酚的肝毒性[22],其代谢产物N-乙酰醌亚胺就是毒性产物.药物在肝脏中通过两步反应完成代谢,即Ⅰ相和Ⅱ相反应.Ⅰ相反应:将药物进行水解、氧化、还原,产生代谢产物,主要的代谢酶是细胞色素P450(Cytochrome p450,CYP450).另外,CYP1A2、CYP2A6、CYP2D6及CYP2E1等都是和药物性肝损伤相关的关键氧化酶,而CYP2E1不仅参与药物的代谢,也是毒物前体成分的催化剂.Ⅱ相反应:代谢产物与转移酶结合成新的化合物,通过尿液或胆汁排出体外,而当药物摄入过多时,转移酶数量供给不足,代谢产物开始在体内蓄积,对肝细胞直接造成损伤,这样形成的肝毒素通常呈剂量及时间依赖性,且易受外界环境因素影响,这样循环往复,对肝脏造成严重损伤.
2.2 药物的特异质肝毒性与炎症反应
特异质肝毒性主要与不同个体有关,与药物代谢酶缺损、活性低及免疫应答异常等有关[23].药物性肝损伤不仅是肝细胞损伤的过程,同时也是炎症反应过程,该过程与先天性免疫和获得性免疫有关[24].肝脏的先天性免疫系统主要由巨噬细胞、中性粒细胞、自然杀伤细胞或自然杀伤T细胞构成.当发生药物性肝损伤时,受损伤的肝细胞周围有大量巨噬细胞浸润,吞噬已受损的肝细胞并释放多种细胞因子.另外,高迁移率族蛋白-1(High mobility group protein box,HMGB-1)是一种损伤相关分子模式(Damage associated molecular pattern,DAMP),HMGB-1可诱导中性粒细胞浸润.HMGB-1还可与Toll样受体结合并促进细胞因子释放,如肿瘤坏死因子-α(Tumor necrosis factor alpha,TNF-α),干扰素-1(Interferon,IFN-1)及白介素-6(interleukin-6,IL-6)等,使药物性肝损伤加重.此外,某些药物如环孢素可通过抑制获得性免疫系统,降低T淋巴细胞活化,抑制肝细胞表达一氧化氮合酶(Nducible nitric oxide synthase,NOS),使一氧化氮(Nitric oxide,NO)合成减少,而NO是一个多功能的分子,在炎症性损伤中具有重要的作用,是各种类型的肝损伤炎症的重要促进和效应分子[25-26],导致肝细胞缺血缺氧而损伤肝细胞.
药物性肝损伤诱发的炎症被称为无菌炎症[21]884,外环境中的相关损伤分子在组织损伤时释放并激活免疫细胞上的受体,机体处于免疫应答状态,产生大量促炎因子.已有研究显示[27],发生炎症时机体对药物的敏感性增强,药物自身或其产生的代谢产物可直接启动细胞凋亡系统,使肝细胞凋亡.
2.3 药物导致线粒体损伤与氧化应激
线粒体是细胞能量代谢,是抗肿瘤药物、抗病毒药物等的重要靶标[24]850.线粒体损伤是药物所致肝损伤的主要原因.其机制主要包括:1)抑制线粒体呼吸链中酶的活性;2)干扰细胞能量代谢及对线粒体膜产生攻击,最终导致线粒体损伤,进而启动细胞凋亡程序;3)药物及其毒性产物可通过破坏抗氧化防御系统,引起氧化应激反应,诱导大量的氧自由基产生,导致线粒体DNA氧化损伤,严重时可降解线粒体DNA[28].
在生物氧化过程中,产生大量氧自由基,具有高度活性,称为活性氧基团(Reactive oxygen species,ROS)[29].正常肝脏有活性氧产生系统和消除系统,二者以动态平衡维持肝细胞的正常代谢.若抗氧化系统受到某些药物破坏,肝细胞内产生大量ROS,导致细胞内各种成分如多聚不饱和脂肪酸、蛋白质、氨基酸和核酸等发生过氧化损伤.
3 紫草素对肝损伤保护作用的研究进展
3.1 紫草素对特异质肝毒性的保护作用
抗炎性是紫草素的主要药理作用之一,而药物引起的特异质肝毒性的主要表现是炎症反应.研究发现,紫草素可通过其抗炎作用对一些致炎因子引起的肝损伤起到保护作用.如刀豆蛋白A(Concanavalin A,Con A)诱导的急性肝损伤[30]和四氯化碳诱导的肝纤维化[31].Con A是一种特异性T细胞分裂原,能够使T细胞增殖分化速度加快,造成免疫调节功能障碍,引发机体无法控制的免疫反应,同时活化免疫细胞,如巨噬细胞、中性粒细胞和自然杀伤细胞等.免疫细胞作用于肝脏,释放促炎因子及活性氧等分子,导致炎性损伤.而巨噬细胞和中性粒细胞等免疫细胞引发的肝脏炎症是Con A诱导的自身免疫性肝炎的基本特征.TNF-α和IL-6是免疫细胞分泌的效应分子,对肝损伤进展有重要作用[32].IL-6能够与细胞表面IL-6受体结合,使信号转导蛋白GPL30聚合并活化,进而激活JAK2/STAT-3信号轴,STAT-3磷酸化后进入细胞核,促进TNF-α和IL-6等炎症介质的合成与释放,加强炎症反应[33],且TNF-α作用于肝细胞表面TNF-α受体,诱导细胞凋亡,加剧肝脏损伤.沈淼[34]研究发现,Con A诱导的小鼠肝损伤模型组与正常对照组相比较,谷草转氨酶(Aspartate Aminotransferase,AST)和谷丙转氨酶(Alanine Aminotransferase,ALT)及诱生型NOS活性显著升高.肝损伤小鼠肝细胞严重肿胀,散乱排布,大量炎性细胞浸润,肝小叶大面积坏死.给予紫草素治疗后,ALT和AST活性显著降低,诱生型NOS、NO和IL-6都有所下降,肝脏病变得以改善.
肝脏对慢性肝损伤的修复过程中容易出现肝纤维化(Hepatic fibrosis,HF)[35-36],该过程受多种细胞因子尤其是肿瘤坏死因子-β1(Transforming growth factor-β1,TGF-β1)的影响[37].TGF-β1调节肝星状细胞(Hepatic stellate cell,HSC)中Ⅰ、Ⅲ和Ⅳ型胶原、纤连蛋白和层粘连蛋白的表达,增加纤连蛋白与蛋白多糖的合成,促进纤连蛋白和胶原在细胞外基质中的沉积[38].龙大碧等[39]研究发现,紫草素对四氯化碳所致大鼠肝纤维化具有保护作用.另有研究表明[40],紫草素能降低HF大鼠血清中层粘连蛋白及Ⅲ型胶原含量.
综上所述,紫草素能够抑制IL-6/STAT-3炎症通路,减轻炎症反应,并且通过降低TGF-β1表达,减少纤连蛋白和胶原在肝细胞外基质中的沉积,从而发挥抗HF的作用.
3.2 紫草素对线粒体损伤导致肝损伤的保护作用
抗氧化作用是紫草素的另一主要药理作用,而氧化应激是引起肝损伤的又一常见因素,紫草素通过抗氧化对肝脏具有一定的保护作用.研究表明,人和动物在高强度运动后机体会产生大量自由基破坏肝细胞生物膜系统,产生脂质过氧化物,导致蛋白质变性、线粒体功能障碍,进而导致肝损伤[41].
生物机体中超氧化物歧化酶(Superoxide dismutase,SOD)和谷胱甘肽(Glutathione,GSH)是主要的抗氧化酶.通过清除体内自由基,发挥抗氧化作用.巯基(-SH)作为维持机体功能的重要活性基团,对代谢过程中产生的氧自由基具有清除作用,有效防止其对组织细胞的损伤.脂质过氧化产物(Lipid peroxide,LPO)是机体脂质在自由基的作用下发生过氧化的终产物,LPO含量高低是判断机体脂质过氧化水平和细胞损伤程度的主要依据[42].徐小仙等[43]研究表明,疲劳大鼠肝组织中SOD和GSH活性显著降低而LPO含量升高,紫草素治疗逆转这一变化.表明,紫草素能显著减少高强度运动产生的自由基,从而修复肝氧化损伤.
机体处于氧化应激状态时,产生大量自由基,线粒体膜破坏,引起细胞能量代谢障碍,甚至细胞凋亡.Na+/K+-ATP酶和Ca2+/Mg2+-ATP酶是维持线粒体膜正常流动性的关键酶[44].这两种酶的活性降低,会影响线粒体Na+/K+-ATP酶的正常功能,发生水肿,线粒体膜流动性减弱,从而影响线粒体氧化磷酸化功能,使三磷酸腺苷合成严重不足,从而降低ATP酶活性[45].徐小仙等[43]242研究发现,强力运动显著降低大鼠肝细胞线粒体中这两种ATP酶活性,细胞膜发生脂质过氧化.紫草素治疗能显著增加肝线粒体Na+/K+-ATP和Ca2+/Mg2+-ATP酶活性.
综上所述,随着新药的不断研发和使用,药物性肝损伤逐年增加,药物所致的肝损伤主要有:药物的直接肝毒性、特异质肝毒性、炎症反应、线粒体功能损伤和氧化应激,其中炎症反应和氧化应激是药物所致肝损伤的主要表现.紫草素具有多种药理作用,包括抗炎、抗氧化、抗肿瘤、抗菌等.已有研究证实紫草素通过抗炎和抗氧化对不同因素所致肝损伤的保护作用,但是,紫草素抗药物性肝损伤机制仍不明确,需要进一步研究.

