番石榴叶总三萜改善糖尿病大鼠视网膜损伤的作用机制研究
张俏,罗影,刘学政
糖尿病病程延长可导致视网膜神经节细胞(retinal ganglion cell,RGC)凋亡甚至死亡,RGC 数量随之减少[1-2]。RGC轴突形成视神经,RGC损伤会影响患者的视力[3]。因此,保护RGC 免受损伤对防治糖尿病视网膜损伤尤为重要。近年来中医药在防治糖尿病中具有较好的效果[4-5]。番石榴叶总三萜(total triterpenoids in guava leaves,TTPGL)为番石榴叶的提取物,具有明显的降低血糖及抑制炎症反应的作用,对糖尿病的防治具有较好的疗效[6-7]。但TTPGL 对糖尿病视网膜损伤的影响目前尚不清楚。因此,本研究拟应用TTPGL 对糖尿病大鼠进行灌胃治疗,探讨TTPGL 对糖尿病视网膜损伤的影响及相关机制。
1 材料与方法
1.1 材料 SPF 级雄性SD 大鼠60 只,体质量200~240 g,购自锦州医科大学实验动物中心(动物编号:0000455),常规饲养,环境温度20~25 ℃,湿度50%~70%。链脲佐菌素(streptozotocin,STZ,Sigma);TTPGL 粉末(纯度为98%,大连美伦公司);HE 染色试剂盒(碧云天生物技术有限公司);兔源神经胶质酸性蛋白(GFAP)、核转录因子(NF)-κB、肿瘤坏死因子(TNF)-α抗体(英国Abcam公司);免疫荧光染色试剂盒、Western blot 二抗(PTG 公司)。荧光倒置显微镜(日本Olympus 公司);冰冻切片机(德国SLEE 公司);水平电泳仪(美国Bio-Rad公司)。
1.2 方法
1.2.1 动物分组及模型制备 50 只大鼠按55 mg/kg 腹腔一次性注射STZ,72 h 后采尾静脉血测血糖,将血糖>16.7 mmol/L的大鼠定为糖尿病模型[8-9],建模成功率为100%。模型诱导成功后,大鼠编号并按照随机数字表法分成5组:糖尿病组(DM 组)、TTPGL 低剂量组(TTPGL-L 组,50 mg/kg)、TTPGL中剂量组(TTPGL-M组,100 mg/kg)、TTPGL高剂量组(TTPGL-H组,200 mg/kg)及二甲双胍组(Met组,10 mg/kg,阳性对照),另取10 只正常大鼠作为对照(CON)组。动物成模1 周后,每天上午8:00—10:00 以2 mL 无菌生理盐水溶解TTPGL后灌胃给药,每日1次,灌胃剂量依据文献[6-7]及预实验。CON组及DM组给予2 mL生理盐水,12周后进行各项指标检测。整个实验过程遵循国家《实验动物管理条例》相关规定。
1.2.2 样本制备 12周后,采集尾静脉血检测血糖水平。每组按随机数字表法取5只大鼠,以10%水合氯醛腹腔注射麻醉(3.5 mL/kg)。4%多聚甲醛灌注固定后取出眼球,石蜡包埋切片,厚度为5 μm,常温保存,用于免疫荧光及HE 染色。每组另取5 只大鼠,以10%水合氯醛深度麻醉(7.0 mL/kg)处死后取视网膜,冰上剪碎裂解后静置30 min,4 ℃、12 000 r/min离心25 min,留上清。BCA法测蛋白浓度并制样,-20 ℃保存用于Western blot实验。
1.2.3 免疫荧光染色检测大鼠视网膜GFAP 表达 经1.2.2制备的切片脱蜡后浸于PBS洗涤3次,每次3 min;3%山羊血清+0.3%Triton-100室温孵育1 h;不洗,滴加兔抗大鼠GFAP一抗(1∶300),4 ℃过夜;次日PBS 洗涤4 次,每次3 min;滴加荧光二抗,室温避光1 h;PBS洗涤4次,每次3 min;封片后荧光显微镜观察GFAP表达情况。
1.2.4 Western blot 检测NF-κB、TNF-α 蛋白表达 取1.2.2制备的上清,每孔上样50 μg 进行十二烷基磺酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳后半干法转膜(恒压20 V,18 min),1%BSA 室温封闭2 h。TBST 洗膜后NF-κB(1∶8 000)、TNF-α(1∶5 00)和内参β-actin(1∶20 000)一抗4 ℃杂交过夜。二抗室温摇床孵育2 h。ECL 试剂盒显色,Image J软件分析目的蛋白和内参灰度值并计算相对表达量。
1.2.5 HE染色检测RGC密度 经1.2.2制备的切片浸于PBS洗涤3次,每次3 min;滴加苏木素染色2 min;PBS浸泡1 min,自来水冲洗;95%乙醇1 min,伊红浸染2 min,自来水冲洗;脱水透明后封片,拍照后应用Image J 软件计数RGC 数量并转化成密度。
1.3 统计学方法 所有数据采用SPSS 20.0 统计软件进行分析,符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,方差齐时采用SNK-q检验进行多重比较,方差不齐时采用Games-Howell 法,以P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠空腹血糖水平检测结果 分组干预12 周后,与CON 组相比,DM 组血糖明显升高(P<0.05);与DM组相比,TTPGL-M组、TTPGL-H组、Met组血糖依次降低(均P<0.05),而DM组与TTPGL-L组差异无统计学意义(P>0.05)。见图1。
2.2 各组大鼠视网膜GFAP表达水平比较 将CON组GFAP 蛋白荧光强度设定为100%,与CON 组相比,DM 组GFAP 荧光强度明显升高(P<0.05);与DM 组相比,TTPGL-M 组、TTPGL-H 组、Met 组治疗后GFAP 表达依次降低(均P<0.05),DM 组与TTPGL-L 组相比差异无统计学意义(P>0.05),见图2、3。
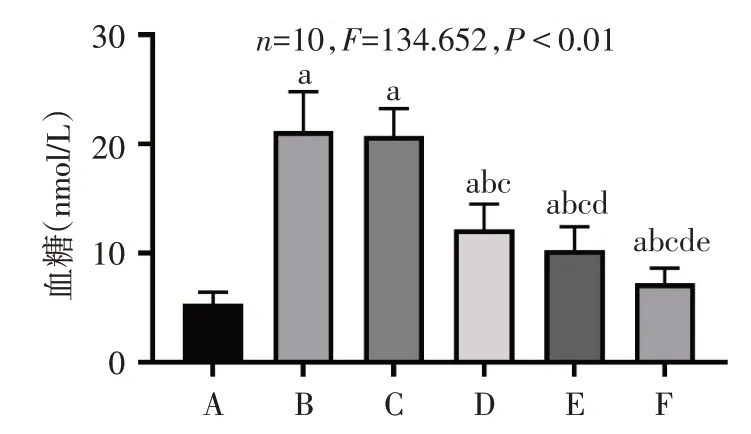
Fig.1 Comparison of fasting blood glucose levels between six groups of rats图1 6组大鼠空腹血糖水平比较
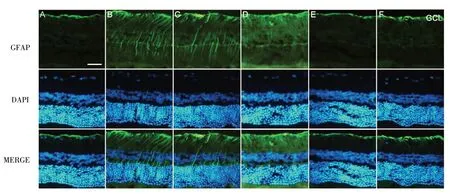
Fig.2 The expression of GFAP in retina between the six groups of rats(immunofluorescent staining,×400)图2 6组大鼠视网膜GFAP的表达(免疫荧光染色,×400)
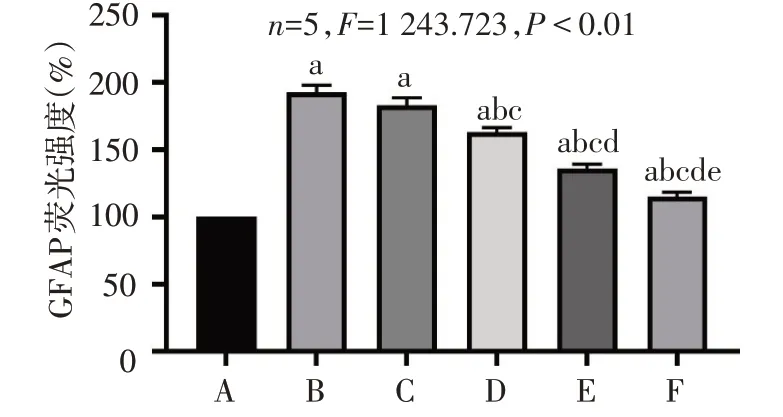
Fig.3 Comparison of GFAP expression in retina between six groups of rats图3 6组大鼠视网膜GFAP表达水平比较
2.3 各组大鼠视网膜NF-κB、TNF-α蛋白表达水平比较 与CON组相比,DM组NF-κB、TNF-α表达明显升高(P<0.05);与DM 组相比,TTPGL-M 组、TTPGL-H 组、Met 组NF-κB、TNF-α 表达依次降低(均P<0.05),而DM组与TTPGL-L组相比差异无统计学意义(P>0.05),见图4、表1。
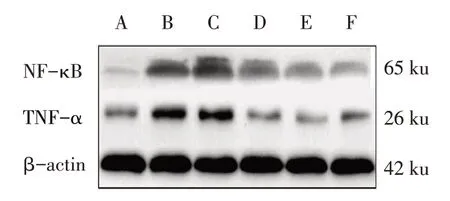
Fig.4 The relative expressions of NF-κB and TNF-α in retina between six groups图4 6组大鼠视网膜NF-κB、TNF-α蛋白表达水平
2.4 各组大鼠视网膜RGC 密度比较 与CON 组相比,DM组RGC密度明显下降(P<0.05);与DM组相比,TTPGL-M组、TTPGL-H组、Met组治疗后RGC密度依次增加(均P<0.05),而DM组与TTPGL-L组相比差异无统计学意义(P>0.05),见表1、图5。
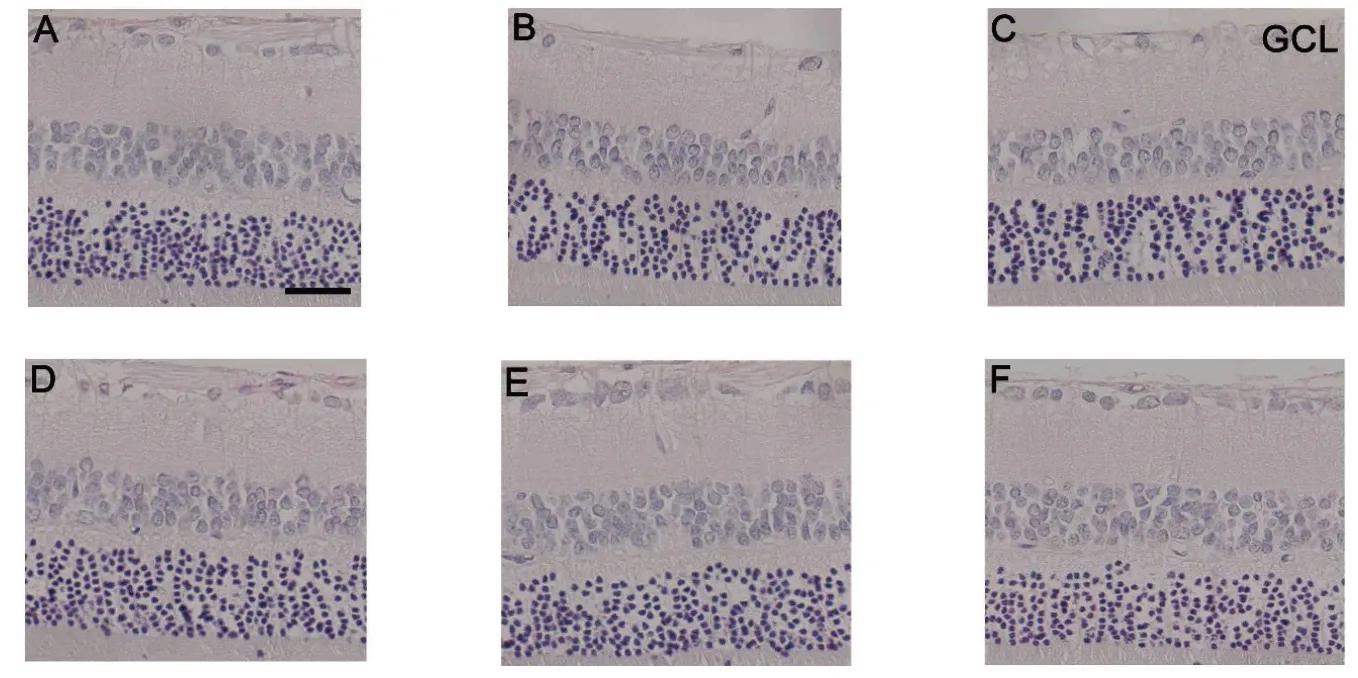
Fig.5 Comparison of retinal RGC density between six groups of rats(HE staining,×400,bar=25 μm)图5 6组大鼠视网膜RGC密度比较(HE染色,×400,标尺=25 μm)
Tab.1 Comparison of relative expressions of NF-κB,TNF-α and RGC density of retina between six groups表1 6组大鼠视网膜NF-κB、TNF-α蛋白相对表达及RGC密度比较(n=5,±s)
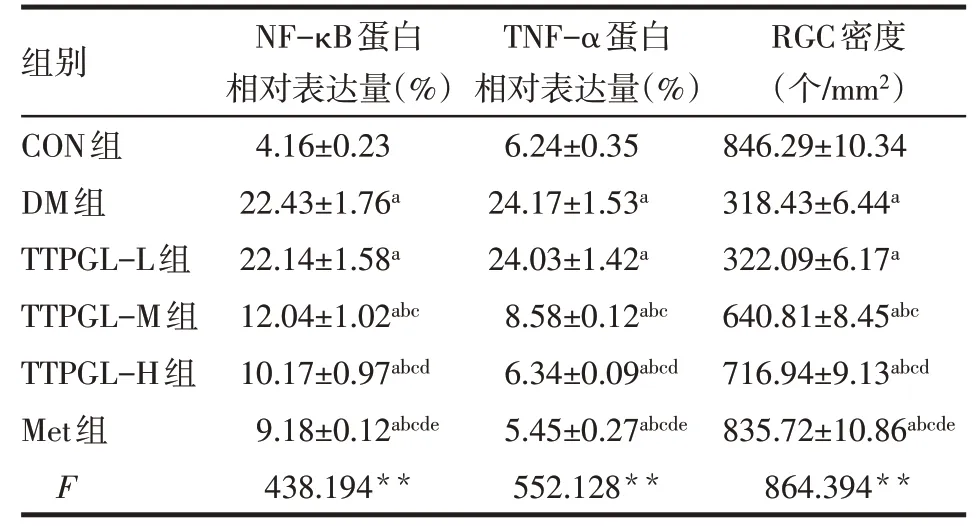
Tab.1 Comparison of relative expressions of NF-κB,TNF-α and RGC density of retina between six groups表1 6组大鼠视网膜NF-κB、TNF-α蛋白相对表达及RGC密度比较(n=5,±s)
**P<0.01;a与CON 组比较,b与DM 组比较,c与TTPGL-L 组比较,d与TTPGL-M组比较,e与TTPGL-H组比较,P<0.05
组别CON组DM组TTPGL-L组TTPGL-M组TTPGL-H组Met组F NF-κB蛋白相对表达量(%)4.16±0.23 22.43±1.76a 22.14±1.58a 12.04±1.02abc 10.17±0.97abcd 9.18±0.12abcde 438.194**TNF-α蛋白相对表达量(%)6.24±0.35 24.17±1.53a 24.03±1.42a 8.58±0.12abc 6.34±0.09abcd 5.45±0.27abcde 552.128**RGC密度(个/mm2)846.29±10.34 318.43±6.44a 322.09±6.17a 640.81±8.45abc 716.94±9.13abcd 835.72±10.86abcde 864.394**
3 讨论
糖尿病视网膜损伤长期以来被认为是一种血管疾病,但针对血管病变的治疗并未取得满意效果。目前研究证实,DM患者的视觉功能障碍与神经病变损伤关系密切[10]。RGC 是目前研究最多的视网膜损伤的靶点,DM 状态下RGC 的丢失或损害是患者视力下降的重要原因[11-12]。本研究也证实,DM大鼠RGC密度明显降低。因此,有效抑制RGC损伤是防治DM视网膜损伤的重要靶点。
有文献报道TTPGL 可通过激活大鼠骨骼肌中的PI3K/AKT 信号传导及调节氧化应激水平,对STZ诱导的DM 大鼠产生保护作用[13];同时TTPGL 还具有抗炎作用[7]。本实验采用低、中、高3 种剂量的TTPGL 对STZ 诱导的DM 大鼠进行灌胃治疗,发现中、高剂量的TTPGL 可有效降低大鼠的血糖,且RGC密度也随之增加,这说明TTPGL可能通过降低血糖保护受损的RGC。
GFAP为一种中间丝结构蛋白,在Müller细胞内的过度表达可损伤视网膜结构及功能[14]。本课题组前期研究发现,抑制DM状态下GFAP的表达可增加RGC 密度,保护受损的神经元[15]。本研究发现,正常大鼠GFAP少量表达于视网膜GCL层,但在DM组GFAP 表达明显上调,贯穿视网膜全层。中、高剂量的TTPGL 可明显抑制GFAP 的表达,进而保护受损的RGC。Liu 等[14]研究发现,DM 时,不仅会引起视网膜GFAP 表达的增加,同时也会诱发视网膜炎症反应,中药柚皮苷可有效抑制GFAP的表达,进而抑制NF-κB炎症通路,保护损伤的视网膜Müller细胞;而GFAP 也是炎症反应活动的标志物[16]。因此,本研究进一步对炎性指标进行了检测。
炎症反应是机体消除损伤因子或修复组织损伤的免疫防御过程,其与DM 的关系尤为密切。越来越多的证据表明DM状态下视网膜或玻璃体中多种神经炎性因子,包括NF-κB、TNF-α、白细胞介素(IL)-6等表达明显增加[17]。NF-κB、TNF-α、IL-6等细胞因子表达上调可启动炎性级联反应,进一步激活核转录因子,最终诱导视网膜神经细胞凋亡。本研究发现,DM 组NF-κB、TNF-α 表达明显上调,而中、高剂量的TTPGL 可明显下调NF-κB、TNF-α 的表达,这与以往的研究相一致[18],提示TTPGL 可能通过抑制炎症反应进而增加RGC密度。
综上所述,DM状态下会引起RGC密度的降低,而应用TTPGL 治疗后,可明显增加RGC 密度,这可能与TTPGL降低血糖,下调视网膜GFAP的表达,抑制炎症反应有关。当然,DM视网膜损伤发病机制复杂,TTPGL对其治疗作用的相关机制仍需深入探讨。

