白藜芦醇减轻脑创伤大鼠炎性反应及神经元凋亡
简 宇,代凌云,吴丰学
(荆州市中心医院 急诊科, 湖北 荆州 443000)
脑创伤(traumatic brain injury,TBI)是一种致残率及致死率极高的脑部疾病,患者常会出现非血肿性、迁延性昏迷或重度神经功能损伤,同时TBI往往还伴随继发性损伤,如神经炎性反应、线粒体功能障碍、DNA氧化损伤、DNA自身修复功能障碍及神经细胞凋亡等,进一步加重脑部组织损伤[1]。TBI患者治疗后仍有不同程度的后遗症,如运动障碍、偏瘫及认知下降等[2],严重影响患者生活质量。白藜芦醇(resveratrol,RV)又称芪三酚,是多酚类化合物,其在脑缺血再灌注损伤中有一定的神经保护作用[3]。 RV还可调控Notch信号通路作用于宫颈癌[4]和肝损伤[5]等,但其是否可通过Notch信号通路保护TBI还不清楚。本文旨在研究RV对TBI大鼠神经的保护作用,并从Notch信号通路分析其作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物:SPF级、成年、雄性SD大鼠,6月龄,体质量180~220 g[北京信生元生物医学科技有限公司,许可证号:SCXK(京)2019-0027]。
1.1.2 试剂与仪器:白藜芦醇(Sigma Aidrich公司);ELISA试剂盒(YAD公司);Notch1、Hes1、含半胱氨酸的天冬氨酸水解酶-3(cysteinyl aspartate specific proteinase 3,caspase-3)、B细胞淋巴瘤蛋白 2(B cell lymphoma 2,Bcl-2)及Bcl-2 相关蛋白(Bcl-2 assaciated X protein,Bax)一抗(Abcam公司)。
1.2 方法
1.2.1 大鼠的分组及处理:采用液压打击法[6]构建颅脑创伤大鼠模型,将大鼠分为对照组、模型组、白藜芦醇低、中和高剂量组(舌下静脉分别注射5、10和20 mg/kg RV[7]),每组8只。
1.2.2 Morris水迷宫检测大鼠学习和记忆能力:待大鼠适应环境并学习游泳后,进行Morris水迷宫测试;将安全岛依次放入水迷宫内,再加入混有牛奶的水(牛奶∶水=2∶1,温度约22 ℃),漫过安全岛约2 cm;随机从4个象限中放入大鼠,记录大鼠搜索安全岛潜伏期和游泳轨迹。
1.2.3 HE染色病理检测:取出脑组织(切除额叶、小脑部分,保留中间组织)固定于多聚甲醛过夜,进行常规石蜡包埋切片操作及苏木精-伊红(HE)染色,显微镜下观察大鼠海马区神经元形态。
1.2.4 TUNEL染色检测神经元凋亡:参照上述方法制备脑组织切片,滴加3% H2O2反应10 min;加入蛋白酶,37 ℃孵育10 min,再加入标记液,37 ℃孵育2 h;加入封闭液,室温下反应30 min;加入生物素化抗地高辛抗体,37 ℃反应30 min;滴加链酶亲和素-过氧化物酶(SABC)液,37 ℃反应30 min;添加二氨基苯联安(DAB)显色,经苏木精复染,脱水、透明、封片,显微镜观察神经元凋亡数(细胞核中有棕黄色颗粒),计算凋亡指数(凋亡细胞数/细胞总数×100%)。
1.2.5 ELISA检测炎性因子的含量:大鼠脑组织加入0.9%氯化钠溶液冰上匀浆,按ELISA试剂盒说明书,检测脑组织中炎性因子白介素6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白介素1β(interleukin-1β,IL-1β)的含量。
1.2.6 Western blot检测脑组织中相关蛋白的表达:在液氮中研磨脑组织成粉末,添加RIPA裂解液提取样本中总蛋白,检测蛋白浓度;取50 μg左右蛋白进行凝胶电泳,SDS-PAGE凝胶浓度为10%;待溴酚蓝达到分离胶底部时,切割凝胶至合适大小,进行电转;90 min后取出PVDF膜,孵育封闭液、一抗及二抗,进行免疫反应;最后采用全自动凝胶成像仪检测蛋白条带,并计算Notch1、Hes1、caspase-3、Bcl-2及Bax等蛋白的相对表达量。
1.3 统计学分析

2 结果
2.1 白藜芦醇对脑创伤大鼠学习和记忆力的影响
与对照组相比,TBI组大鼠运动轨迹、搜索安全岛潜伏期明显增加(P<0.05);与模型组相比,RV 3个剂量组运动轨迹、搜索安全岛潜伏期呈浓度依赖性明显缩短(P<0.05)(图1)。
2.2 白藜芦醇对脑创伤大鼠海马区损伤的影响
TBI模型大鼠海马CA1区表现为神经元数量减少,细胞排列紊乱,且出现明显的皱缩,胞质染色增强;与模型组相比,RV 3个剂量组CA1区明显减轻(图2)。
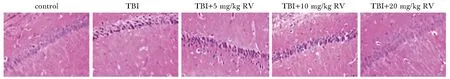
图2 白藜芦醇对脑创伤大鼠海马区(CA1)损伤的影响Fig 2 Effects of RV on hippocampus (CA1) injury in TBI rats(×40)
2.3 白藜芦醇对脑创伤大鼠神经细胞凋亡的影响
与对照组相比,TBI组神经元凋亡指数、脑组织中caspase-3的表达显著上调,Bcl-2/Bax水平显著下调(P<0.05);与TBI组相比,RV 3个剂量组细胞凋亡指数、脑组织中caspase-3的表达显著下调,Bcl-2/Bax水平呈剂量依赖显著上调(P<0.05)(图3)。
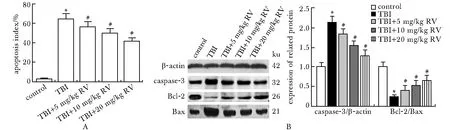
A.effects of resveratrol on neuron apoptosis index in TBI rats; B.effects of resveratrol on the expression of apoptosis proteins in brain tissues of TBI rats; *P<0.05 compared with control; #P<0.05 compared with TBI
2.4 白藜芦醇对脑创伤大鼠脑组织炎性因子水平的影响
与对照组相比,TBI组脑组织中IL-6、TNF-α及IL-1β水平显著上调(P<0.05);与TBI组相比,RV低、中、高剂量组IL-6、TNF-α及IL-1β水平呈剂量依赖性显著下调(P<0.05)(图4)。

*P<0.05 compared with control; #P<0.05 compared with TBI图4 白藜芦醇对脑创伤大鼠脑组织炎性因子水平的影响Fig 4 Effects of RV onlevels of inflammatory factors inbrain tissue of TBI
2.5 白藜芦醇对脑创伤大鼠脑组织Notch及Hes1蛋白表达的影响
与对照组相比,TBI组脑组织中Notch1和Hes1水平显著上调(P<0.05);与TBI组相比,RV低、中、高剂量组Notch1和Hes1水平呈剂量依赖性显著下调(P<0.05)(图5)。

*P<0.05 compared with control; #P<0.05 compared with TBI图5 白藜芦醇对脑创伤大鼠脑组织Notch及Hes1蛋白表达的影响Fig 5 Effects of RV on expression of Notch and Hes1 protein inbrain tissue of TBI
3 讨论
常见的TBI动物模型大多为闭合性脑创伤[8],本研究采用液压打击法处理大鼠,导致TBI大鼠海马CA1区出现明显的损伤,表现为神经元数量减少,细胞排列紊乱,明显皱缩及胞质染色增强;且TBI组大鼠运动轨迹及搜索安全岛潜伏期明显延长,表明成功复制TBI模型。RV广泛存在于花生、葡萄和桑椹等植物中,具有抗肿瘤、抗感染和抗氧化等作用,可保护心血管系统及神经系统等[9]。本研究发现RV可明显减轻大鼠海马CA1区损伤,神经细胞量增多,明显恢复胞核固缩;RV组大鼠运动轨迹及搜索安全岛潜伏期较TBI组明显缩短,提示RV对于TBI大鼠神经损伤具有一定的保护作用,与文献报道[10]相似。
Caspase-3、Bcl-2及Bax是细胞凋亡途径中的关键蛋白,caspase-3是凋亡的主要执行者,其激活后将直接切割细胞中的生命大分子;而Bcl-2可减少氧自由基、脂质过氧化物及多种细胞毒性因子的形成,而具有抗凋亡作用,Bax具有促凋亡作用,细胞内Bcl-2/Bax水平可以反映凋亡情况[11-12]。本实验结果显示,TBI可诱导大鼠神经元的凋亡,而RV可以抑制caspase-3的表达,并上调Bcl-2/Bax水平,抑制TBI大鼠神经元的凋亡。
神经炎性反应是TBI继发性损伤的重要病理基础之一,脑外伤后,小胶质细胞会募集白细胞,释放多种炎性因子,如IL-6、TNF-α及IL-1β等,产生级联反应放大炎症信号,破坏血脑屏障和线粒体功能,进而产生氧化损伤,加剧神经的坏死和功能障碍[13]。本研究发现,RV组大鼠脑组织中IL-6、TNF-α及IL-1β水平显著下调,表明RV可能通过减轻TBI大鼠神经炎性反应,发挥神经保护作用。
Notch信号通路在细胞结构和功能的发育中具有重要作用,而且参与调控组织和器官受损后的修复[14]。Notch信号通路的激活会增加神经细胞的易损性,引起脑功能障碍[15]。本研究发现,RV预处理后,脑组织中Notch1和Hes1的表达呈剂量依赖性下调,提示RV可能通过抑制Notch信号通路,而保护TBI大鼠脑损伤。
综上所述,白藜芦醇可保护大鼠神经损伤,改善其学习和记忆功能,抑制神经元的凋亡,并减轻大鼠炎性反应,可能与下调Notch1和Hes1的表达有关。

