小麦耐冷相关基因TaCTR的克隆及其表达特性分析
刘 焕,杨 卓,张丽丽,郑 琪,张小红,闵东红
(1.西北农林科技大学农学院/生命学院,旱区作物逆境生物学国家重点实验室,陕西杨凌 712100; 2.陕西省农牧良种场,陕西宝鸡 722203)
异三聚体G蛋白(Gα,Gβ/Gγ)偶联受体简称G蛋白偶联受体(G-protein coupled receptors,GPCRs),是数量最大的一类膜蛋白受体,广泛存在于动物、真菌与植物中[1-3]。近年来在植物中,研究者主要在拟南芥[4-5]、水稻[6]、豌豆[7]、杨树[8]、大豆[9]、苹果[10]以及玉米[11]中发现GPCRs,并对其功能进行了研究。前人研究结果表明,GPCRs参与植物的信号转导过程并影响植物的生长发育,主要包括调控ABA信号通路[12]、参与CK信号转导[13-14]、调节细胞周期蛋白、DNA合成[15]、磷脂酰肌醇[16]、蓝光信号转导[17]以及细菌信号交流[18]。GPCRs除了介导植物信号分子影响植物的生长发育之外,还参与植物逆境胁迫反应。苹果G蛋白偶联受体基因MdGCR1在响应植物抗旱胁迫中发挥重要作用[9];拟南芥GCR1参与多种生物和非生物胁迫响应,在磷酸盐饥饿响应中发挥作用[19],并会影响植物体内胁迫基因的表达[17];水稻G蛋白偶联受体基因OsGPCR1,可以提高植株的耐冷性、耐盐性以及抗旱性[20],与其氨基酸序列同源性高达99.79%的同源基因COLD1,可以明显的提高水稻的耐冷性[21]。目前,小麦GPCRs的研究主要集中在植株矮化[22]、禾谷镰刀菌生长发育、毒性产生以及赤霉病菌致病等方面[23-24],而对该类基因能否提高小麦耐冷性尚未见报道。同时,关于小麦G蛋白偶联受体的作用机制亦不清楚,有待进一步研究。
作物在生长过程中会受到生物胁迫和非生物胁迫,其中温度、干旱以及盐害等非生物胁迫是影响作物生产最为重要的因素[25]。近年来,由低温引起的小麦倒春寒频发,对小麦生产造成严重的威胁,已成为小麦产量损失的主要灾害之一。因此,挖掘小麦耐冷基因,研究小麦耐冷的分子机制,对于合理利用小麦耐冷基因,开展小麦耐冷基因工程改良,确保小麦稳产、高产具有重要现实 意义。
本研究采用同源克隆的方法得到水稻耐冷基因COLD1的同源基因TaCTR,利用生物信息学的方法对基因结构、蛋白质特性以及进化关系进行初步分析,通过亚细胞定位技术对该基因表达的蛋白进行定位,利用qRT-PCR技术分析TaCTR在不同处理下的表达特性以及组织特异性等,以期为探究TaCTR的功能机制奠定基础。
1 材料与方法
1.1 供试材料
供试普通小麦品种小偃22、周麦18、西农979、13(36)0-7、西农626、西农611均由本实验室保存,其中,小偃22是本研究的主要材料,其具有耐冷性突出、高产稳产和适应性广等优良性状。
1.2 方法
1.2.1 材料处理
将饱满的小偃22种子于2017年10月播种于田间,待发育至拔节期,选择发育正常的植株移栽至室内花盆,缓苗一周,待幼穗发育进入药隔形成期至雌雄蕊分化时期,将其放入4 ℃春化培养间,分别在4 ℃冷处理0、0.5、1、2、5、8、12和24 h后,取根、茎、叶、幼穗等组织材料。将所取样品迅速收集于2 mL离心管内并置于液氮中,然后保存于-80 ℃冰箱中,用于后续荧光定量以及基因克隆。小麦拔节期取其雌雄蕊用于后续的组织 定量。
1.2.2 总RNA提取及cDNA第一链的合成
小麦组织的总RNA提取采用TRNzol Universal总RNA提取法,具体提取步骤参照TRNzol Universal总RNA提取试剂(DP424)(天根,北京)说明书。用1.2%的琼脂糖凝胶电泳(200 V,10 min)检测提取总RNA的完整性,用NanoDropTMOne/OneC 超微量紫外分光光度计(赛默飞,美国)测定RNA的浓度和纯度。按照反转录试剂盒FastKing RT Kit(With gDNase)(KR116)(天根,北京)说明书将RNA 反转录合成cDNA,于-20 ℃保存备用。
1.2.3 小麦TaCTR基因克隆
以水稻COLD1基因的cDNA序列为探针在 NCBI(https://blast.ncbi.nlm.nih.gov/Blast.cgi)与六倍体小麦进行比对,得到开放阅读框长度为 1 407 bp的序列,利用Primer 5.0设计引物TaCTR-F(5′-CGAGAAGCGAAGGGGGAGA-3′)/ TaCTR-R(5′-AACCCCCTTTGTGAACT GACTTTA-3′)。以小麦幼穗cDNA为模板,利用PrimeSTAR○RHS DNA Polymerase with GC Buffer(R044A)(TaKaRa,日本)进行PCR扩增。扩增体系及其操作步骤详见说明书,其中循环数为35,退火温度为59.5 ℃,延伸时间为1 min 45 s。PCR扩增产物经1.0%琼脂糖凝胶电泳检测后,利用琼脂糖凝胶回收试剂盒 (DP219)(天根,北京)纯化回收。利用PLB零背景快速连接试剂盒(VT205)(天根,北京)将目的基因连接到载体PLB载体上,转化DH5a感受态细胞(天根,北京),挑取单克隆进行阳性检测并测序。引物合成及测序均在奥科鼎盛生物科技有限公司完成。
1.2.4 生物信息学分析
以小麦TaCTR的氨基酸序列为探针,在NCBI数据库 BLAST,下载与其相似度>85%的其他物种的同源蛋白序列,用MEGA 7.0构建系统进化树;用MEME 5.1.0(http://meme-suite.org/tools/meme )分析氨基酸保守序列,并用evolview-v2(https://evolgenius.info//evolview-v2)整合进化树与氨基酸保守序列;用SwissProt(https://swissmodel.expasy.org/)和ExPASy(https://web.expasy.org/cgi-bin/compute_pi/pi_tool )在线分析TaCTR蛋白的理化性质;用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html )工具预测TaCTR蛋白的二级结构;用WoLF PSORT(https://wolfpsort.hgc.jp/)进行亚细胞定位;用TMHMM Server v.2.0 (http://www.cbs.dtu.dk/services/TMHMM/)和NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)预测跨膜结构域和磷酸化位点分析;用SMART(http://smart.embl-hei-delberg.de/)在线分析TaCTR蛋白的功能域。
1.2.5TaCTR基因的亚细胞定位
对亚细胞定位载体pCAMBIA1302-EGFP进行BstBI单酶切,酶切产物回收,利用引物TaCTR-GFP-F(5′-CGAGCTCAAGCTTCGAA ATGGGGTGGGGCGTGGTG-3′)/TaCTR-GFP-R(5′-CGTCGACTGCAGAATTCGAAATCAATT GGATGCTT-3′)扩增目的基因。按照ClonExpressTMOne Step Cloning Kit试剂盒说明书(诺唯赞,南京)将酶切产物与TaCTR目的片段连接,转化于DH5α感受态细胞,挑取单克隆进行阳性检测并测序。将重组质粒转至农杆菌GV3101,挑取单克隆,取1 mL菌液置于50 mL含相应抗生素的LB液体培养基中,28 ℃、220 r·min-1振荡培养 16~18 h,使OD600=1.0; 5 000 r·min-1离心5 min;用悬浮缓冲液分别悬浮pCAMBIA1302-EGFP-TaCTR和pCAMBIA 1302-EGFP菌液沉淀,使OD600=0.6~0.8,室温静置3 h,对生长4周的本氏烟草进行全叶片注射; 60 h后制备已注射菌液烟草的原生质体,观察蛋白表达。
1.2.6TaCTR基因的表达模式分析
根据TaCTR基因cDNA序列,避开TaCTR的保守区,利用Primer 5.0设计引物RT-TaCTR-F(5′-CCTCCCCTACTACCACTGCT-3′)/RT-TaCTR-R(5′-CGCCAATCCTACTAA CCAAC-3′),用于检测TaCTR的表达;以β-Actin(AB181991)为内参基因,所用引物为Actin-F(5′-CGATTCAGAGCAGCGTATTGTTG-3′)/Actin-R(5′-AGTTGGTCGGGTCTCTTCTAA ATG-3′)。将反转录得到的cDNA模板浓度均稀释到200 ng·μL-1,利用SuperReal荧光定量预混试剂彩色版(SYBR Green)(FP215)试剂盒进行定量分析,在荧光定量PCR仪(ABI7500)上进行实时荧光定量PCR 反应。反应体系及程序参见说明书。每个反应3次重复,采用2-ΔΔCT方法分析TaCTR在不同小麦品种中的表达、组织表达特异性以及胁迫和激素处理后的相对表达量。
2 结果与分析
2.1 小麦耐冷基因TaCTR的克隆结果
对4 ℃冷处理小偃22幼穗组织进行荧光定量分析发现,在冷处理5 h内,TaCTR基因的表达量处于上升趋势,5 h时表达量达到最大,大约是0 h的11.16倍,存在显著性差异,之后逐渐下降(图1)。以冷处理5 h的小偃22幼穗的cDNA为模板,利用引物TaCTR-F/TaCTR-R进行扩增,扩增产物用1.0%的琼脂糖凝胶电泳检测,得到一个片段大小为1 407 bp的特异性条带(图2)。将目的片段回收后,连接至PLB零背景克隆载体,转化于大肠杆菌后挑取单克隆进行菌液检测,并对阳性单克隆进行测序分析。测序结果经BLAST分析表明,TaCTR分别位于小麦2A、2B和2D染色体上,并且与2D染色体上的序列完全相同。TaCTR基因序列全长2 192 bp,开放阅读框长1 407 bp,共编码468个氨基酸残基,分子量为53.43 kDa。DNAMAN序列比对分析(图3)发现,TaCTR在2A、2B和2D染色体间具有高度保守性,且功能域相同,三者所编码的氨基酸序列同源性高达99.64%,仅在第5、92位存在差异,在第5位(红色边框),2A染色体上对应的为苏氨酸,2B和2D染色体上为缬氨酸;第92位(蓝色边框),2B染色体上对应的为缬氨酸,2A和2D染色体上为亮氨酸。因此,推断该基因在2A、2B和2D染色体上具有相似的功能,本研究以2D染色体上的基因进行后续试验。
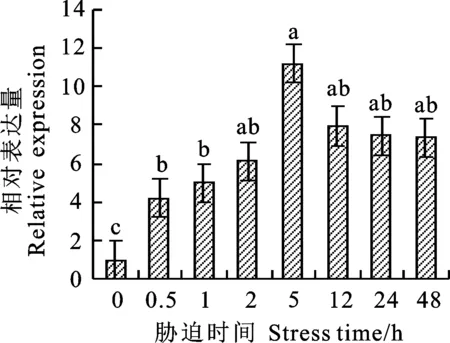
图柱上不同小写字母表示不同胁迫时间之间存在显著性差异(P<0.05)。
2.2 TaCTR基因的生物信息学分析
2.2.1TaCTR基因编码蛋白的系统发育进化分析
蛋白系统进化分析结果(图4)表明,单子叶植物与双子叶植物分别聚为一类,小麦TaCTR蛋白与单子叶植物处于同一进化分支,且与粗山羊草的亲缘关系最近,这可能是由于小麦的2D染色体来自于粗山羊草的缘故。分析不同物种间CTR蛋白的氨基酸保守序列发现,无论双子叶还是单子叶植物,CTR蛋白均含有motif 1、2、3、4和5,而且这5个motif的大小和位置接近,这说明TaCTR基因在不同物种间具有较好的保 守性。
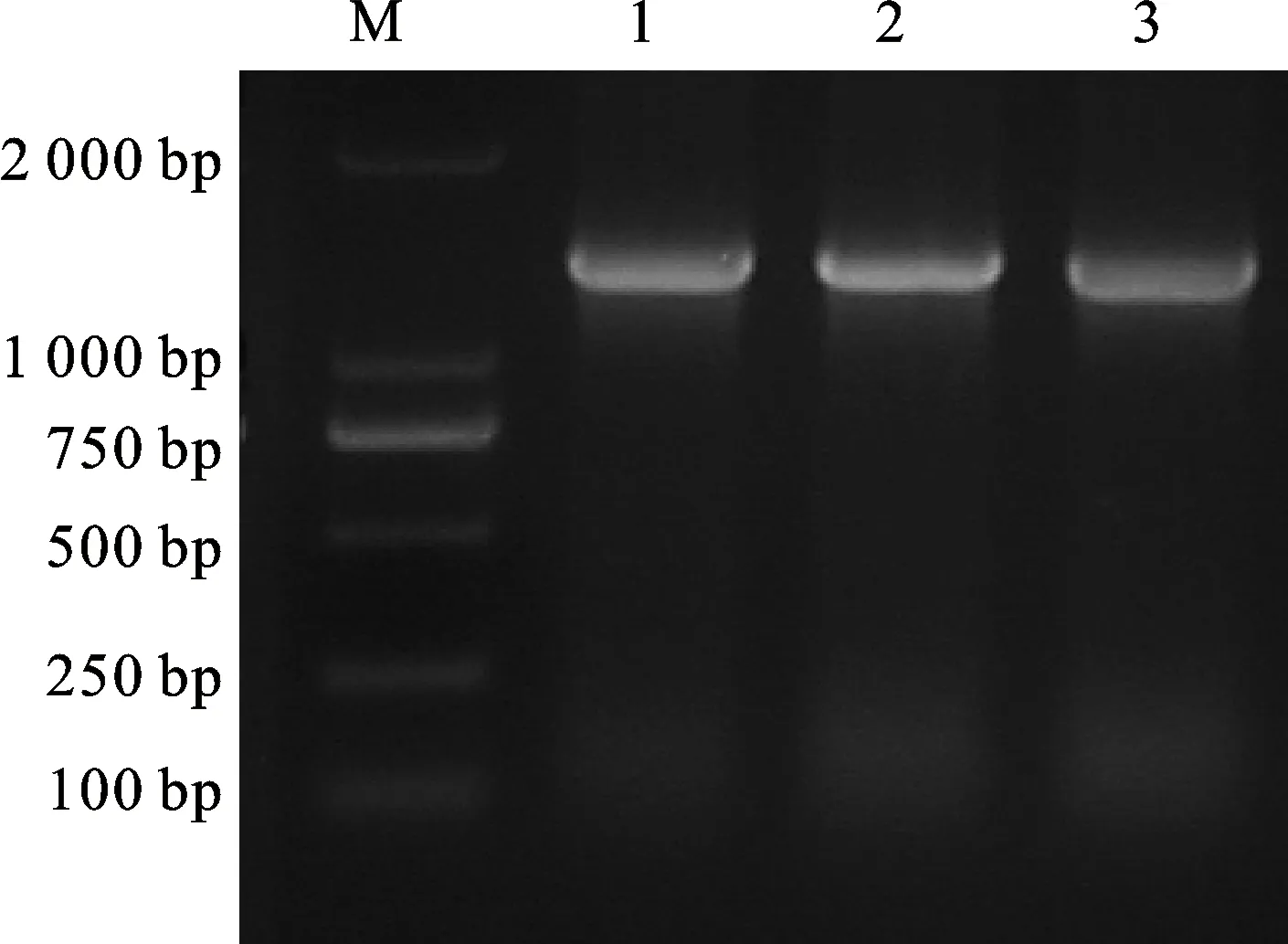
M:DL2000;1~3:TaCTR PCR产物。

红色边框:第5位氨基酸;蓝色边框:第92位氨基酸;红线:GPHR_N功能域;蓝色:ABA_GPCR功能域。
2.2.2TaCTR基因编码蛋白的理化性质及二级结构分析
TaCTR蛋白分子式为C2488H3886N622O643S21,分子量为53.43 kDa,理论等电点PI为9.23,属于碱性蛋白。总平均亲水性值为 0.462,表明该蛋白属于疏水性蛋白;不稳定系数为40.54,说明该蛋白为不稳定蛋白。通过SOPMA在线预测分析TaCTR的二级结构,发现该蛋白主要包括α螺旋(alpha helix),无规则卷曲(random coil)、延伸直链(extended strand)和β折叠(beta turn)四种结构,其所占比例分别为66.88%、20.09%、 9.62%和3.42%。
2.2.3TaCTR基因编码蛋白的跨膜区、结构域及磷酸化位点分析
通过TMHMM Server V.20在线预测,发现TaCTR蛋白存在9个跨膜区,属于膜蛋白,每个跨膜区含20~23个氨基酸,对应位置分别为6~28 aa、41~63 aa、78~100 aa、113~132 aa、152~174 aa、297~319 aa、347~369 aa、390~409 aa、433~455 aa。通过SMART在线分析,发现TaCTR蛋白主要包括GPHR_N和ABA_GPCR两个功能域,位置分别在143~210 aa和285~458 aa之间,长度为68 bp和174 bp。通过NetPhos 3.1 Server数据库分析,发现TaCTR蛋白含有16个丝氨酸、6个苏氨酸和1个酪氨酸磷酸化位点。
2.3 TaCTR蛋白的亚细胞定位
通过WoLF PSORT对TaCTR蛋白进行定位预测,发现其主要存在于细胞膜上。将含有重组载体pCAMBIA 1302-EGFP-TaCTR和空载体pCAMBIA 1302-EGFP的菌液同时注射烟草,并制备烟草原生质体进行观察。结果(图5)表明,阳性对照pCAMBIA 1302-EGFP在细胞膜、细胞质和细胞核均能观察到荧光信号,含有目的基因TaCTR的重组载体pCAMBIA 1302-EGFP-TaCTR仅在细胞膜上具有较强的荧光信号,进一步证明TaCTR编码的蛋白为膜蛋白。
2.4 TaCTR基因在不同小麦品种中的表达及组织特异性分析
分别取生长至三叶期的13(36)0-7、西农626、西农611、小偃22、周麦18、西农979的幼苗叶片,对TaCTR的相对表达量进行分析,结果发现,其相对表达量依次分别为1.00、1.56、1.64、3.71、5.19、 1.61, 说明在小偃22和周麦18中TaCTR表达水平较高,这也进一步说明了小偃22具有较好的耐冷性,与多年的田间观察结果相吻合。组织特异性表达水平(表1)显示,TaCTR基因在小偃22的根、茎、叶、小穗以及雌雄蕊中均有表达,但在小穗和雌蕊中表达量较高,这与小麦表达网站Wheat Expression Browser(http://www.wheat-expression.com/)预测结果一致。

图4 TaCTR蛋白的系统进化树(A)及氨基酸保守基序分析(B)Fig.4 Phylogenetic tree(A) and amino acid conserved motifs(B) analysis of TaCTR protein

Bar=50 μm图5 TaCTR蛋白亚细胞定位Fig.5 Subcellular localization of TaCTR
2.5 非生物胁迫及激素处理对TaCTR基因表达量的影响
由表2可以看出,在NaCl胁迫处理下,TaCTR的表达量在0~4 h间随时间推移呈上升趋势,在处理4 h时表达量达到最大水平,为0 h的3.42倍,二者差异达到显著水平(P<0.05);4 h后,其表达量逐渐下降。在干旱处理下,TaCTR的相对表达量在处理48 h时最高,约是0 h的 2.05倍,二者差异达到显著水平。在GA处理下,TaCTR的表达量在1 h时达到最高水平,为0 h的3.13倍,二者差异达到显著性差异。以上结果说明,TaCTR的表达受干旱以及盐胁迫的诱导,并且可能参与GA信号通路,因此,推测TaCTR参与植物的抗逆信号转导。

表1 小偃22中TaCTR基因的组织特异性分析Table 1 Tissue-specific expression analysis of TaCTR in Xiaoyan 22
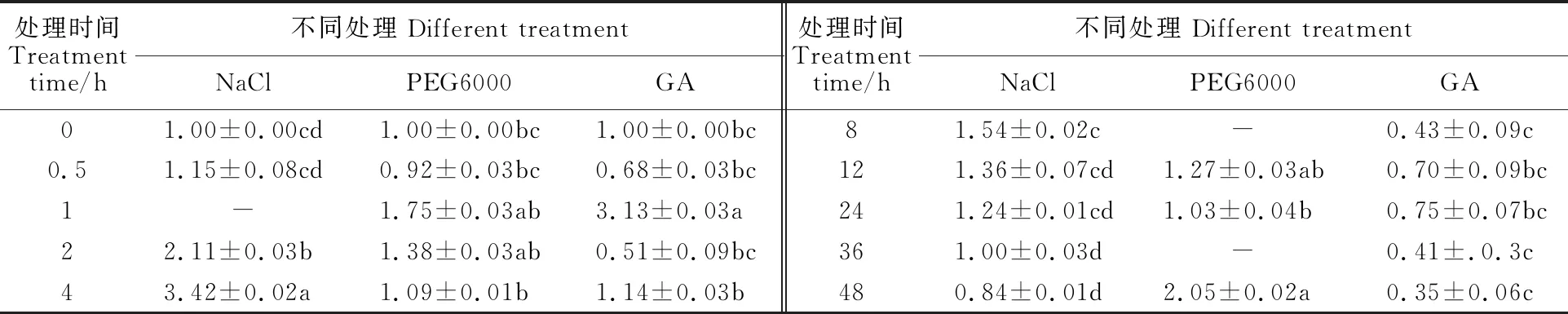
表2 不同处理对小偃22叶片中TaCTR基因表达量的影响Table 2 The effect of TaCTR expression in leaf of Xiaoyan 22 under different treatments
3 讨 论
低温、高温、干旱以及盐害是限制小麦生产的几个主要非生物胁迫因子。其中,低温冷害(春季倒春寒)已成为中国黄淮麦区影响小麦生产的重要灾害之一。春季倒春寒常发生在2月下旬至4月上旬,大田小麦正处于拔节期,其穗分化进程正处于雌雄蕊分化期和药隔发育时期,此时正是小麦幼穗对低温较为敏感的时期[26],也是小麦产量形成的关键时期。倒春寒的发生会导致小花停止发育、幼穗冻死,或麦穗上部和下部受冻严重,因而结实率明显降低,造成小麦减产10%~50%左右[27]。
研究发现,受到低温胁迫时,水稻COLD1基因与G蛋白α亚基相互作用,激活Ca2+通道,并增强G蛋白GTPase的活性,从而保护水稻避免低温胁迫[21]。本研究利用同源克隆方法从小偃22中分离到水稻耐冷基因COLD1的同源基因TaCTR,两者高度同源,均具有9个典型的跨膜结构域。TaCTR基因序列与中国春序列比对结果发现,两者相似度达到100%,说明该基因在不同的小麦品种之间具有很高的保守性,而且该基因在2A、2B和2D三个染色体组之间编码蛋白的同源性达到99.64%,说明该基因在不同染色体组间也具有高度保守性。由于异源六倍体小麦的三个染色体组的部分同源基因可能是通过表达的差异来调控小麦的生长发育,其调控网络复杂[28-29],加之小麦基因可变剪切较为普遍,且涉及小麦发育、生理生化代谢和逆境胁迫响应等多个过程,导致异源六倍体小麦存在多个等位基因位点,致使小麦基因表达调控十分复杂[30-31],关于TaCTR基因在普通小麦的具体表达模式与调控机制还有待进一步深入探讨。
进化树分析结果显示,小麦TaCTR基因在单双子叶中都存在同源基因,暗示了该基因在单双子叶分化之前就已存在。该基因与粗山羊草之间的遗传关系最近,表明该基因在小麦进化过程中由粗山羊草提供。至于该基因在单、双子叶植物基因组中保守域无明显差异,说明该基因在单、双子叶分化演变中仍具有较高的保守性,但是具体的机制还需进一步探究。
组织特异性表达结果发现,TaCTR基因在小麦的各个部位均有不同程度的表达,这与水稻G蛋白偶联受体基因OsGPCR的表达模式[20]以及拟南芥中基因GTG1/2的GUS染色结果一致[32]。TaCTR基因在小麦的小穗以及雌雄蕊中表达量较高,说明小麦在遭受春季低温胁迫时,其小穗对低温的反应最为敏感,最先做出相应的应激反应。亚细胞定位结果表明,该蛋白主要在细胞膜上,这与生物信息学分析结果以及水稻G蛋白偶联受体基因OsGPCR的定位结果一致[20],推测该基因编码的蛋白与水稻OsGPCR编码的蛋白在功能上具有相似性。而植物受到低温胁迫时,细胞膜最先受到伤害,该基因定位于细胞质膜上,这对其感受冷害信号具有重要意义。
Assman等[5]研究结果显示,G蛋白偶联受体是植物中存在的可能感受环境胁迫的受体分子。而TaCTR基因与水稻中编码G蛋白偶联受体的基因OsGPCR1具有高度同源性,并且与人体内的G蛋白偶联受体HsGCR68以及拟南芥中的GPCR型G蛋白有着共同的GPHR_N和ABA_GPCR结构域,并且均含有9个典型跨膜结构域。因此,推测TaCTR基因为小麦中一个潜在的G蛋白偶联受体基因,在小麦的低温信号转导以及逆境胁迫中发挥着极其重要的作用。
在本研究中,对处于三叶期的小麦幼苗进行非生物胁迫以及激素处理后进行荧光定量试验,结果显示,TaCTR的表达在低温、干旱以及高盐胁迫时均上调表达,这与水稻基因OsGPCR1研究结果一致[20]。在GA处理下,TaCTR的表达量明显上调,在水稻中发现COLD1与GA信号的关键元件D1/RGA1在功能上是相互关联的[21],而TaCTR与COLD1有着高度的同源性,这也暗示着小麦TaCTR与水稻COLD1有着相似的调控机制。

