不同人工促进天然更新关键技术对金线莲品质影响的研究
张付远 李丹丹 宋墩福
(江西环境工程职业学院,江西 赣州 341000)
金线莲(Anoectochilusroxburghii),是兰科花叶开唇兰属的多年生草本药用植物,可全草入药,具有增强人体免疫及抗衰老的作用,在治疗高血压、糖尿病、癌症和肿瘤等方面具有显著药用价值[1]。
金线莲为典型的阴生药用植物,喜阴凉、潮湿环境,对生长环境要求较严苛。野生环境下,金线莲种子发芽率低,需从枝真菌根真菌侵入将种子胚细胞中的淀粉转化为糖才可促使种子萌发生长[2,3],而以分根法或扦插方式繁殖所需时间长。野生金线莲由于人为采摘,导致其生存环境恶劣,现已濒临灭绝,因此发展金线莲人工育苗,实现其种苗产业化生产势在必行。目前,有很多研究者对金线莲组培过程中不同培养基、外植体、取材部位及添加物等对金线莲组织培养的影响进行研究。但组培也存在污染率高、流程繁多、周期长、成本高等问题[4]。天然更新,是利用植物自身繁殖能力形成新一代的过程[5]。通过天然更新技术获得植株的方法,具有节省种苗、降低栽培成本等优势。
目前关于金线莲天然更新技术的研究还未见报道。本研究选择江西本土濒危中草药金线莲为研究对象,通过对其成分进行分析发现,多糖、黄酮和氨基酸等为其最重要的营养和药用成分[6]。随着金线莲经济价值日益增加,加之野生资源过度采挖,造成资源短缺,形成恶性循环。因此,金线莲人工种植受到越来越多关注[7,8],但人工种植中种苗成本占据绝大部分,因此寻求适宜的方式降低种苗成本是目前金线莲产业的主要问题。本研究通过对种植6个月组培苗,剪去地上部分留地下根部进行天然更新的方式,研究不同种植时间药用成分变化,以期了解金线莲天然更新的可能性,为金线莲植被恢复、生物多样性保护提供科学依据,同时降低金线莲生产成本,旨在为金线莲资源保护、开发利用及产业化发展奠定基础。
1 材料与方法
1.1 种植材料
供试金线莲品种“江西金线莲”,无菌繁殖苗由江西环境工程职业学院提供。于2017年10月1日,选取生长周期为5个月、形态一致的组培苗200瓶,每瓶约30株。在种植基地大棚内炼苗30d,使组培苗逐渐适应外界环境。将组培苗取出,用清水洗净根部,并用质量分数0.3%KMnO4溶液对根部及扦插部位进行消毒处理。
1.2 研究地概况
研究时间为2018年3月—2019年5月,种植地点为在江西省赣州市信丰县金盆山林场,地理位置坐标大致为E114°93′,N25°38′。
1.3 试验设计
采用单因素随机区组设计,重复3次,每个重复3m2,设置组培苗直接种植和人工促进更新2种方式。种植密度为10cm×10cm,100株·m-2。灌水方式为人工喷洒,水源为地山泉水,各处理基施进口草炭0.4m3·3m-2。选择阴凉、潮湿、通风的林下,整理宽1m、长4m的苗床,苗床起垄高度30cm,苗床最好有一定坡度,一头高一头低便于排水。插穗处理,用75%酒精消毒的剪刀修剪插穗,而后用800倍液多菌灵消毒,消毒后置于阴凉处4h。
1.4 指标测定
1.4.1 多糖含量测定
参照陶子曦[9]的方法进行。
1.4.1.1 供试材料及样品处理
瓶苗直接种植和对种植6个月的金线莲剪去地上部分人工促进更新,两者的生长时间均为6个月。取地上部分植株,洗净后装于牛皮袋中,而后放入烘箱105℃杀青15~20min,45℃烘干至恒重。使用JXFSTPRP-24全自动样品快速研磨仪粉碎(60Hz,30s),粉末装于密封袋中置于干燥皿中保存。
1.4.1.2 供试仪器
EYELA N-1001型旋转蒸发仪(东京理化器械株式会社);SHZ-IIIA型循环水式多用真空泵(西安波意尔精密仪器有限公司);98-1-B型智能恒温电热套(天津市泰斯特仪器有限公司);WSTO-1型远红外快速干燥器(郑州杜甫仪器厂);UV-6100PCS型紫外可见分光光度计(上海美谱达仪器有限公司);AB135-S型电子分析天平(瑞士梅特勒-托利多集团);WF-4000C型常压微波快速反应系统(上海屹尧分析仪器有限公司)。
1.4.1.3 多糖样品的制备
称取金线莲粉末0.2g(精确到0.0001),加80%乙醇4mL浸泡过夜,8000rpm离心10min后弃上清液留沉淀,加入4mL蒸馏水超声提取(40℃,30min),重复3次,收集3次离心后的上清液于一管中,置于冷冻真空干燥机中将溶液体积浓缩至2mL,不足2mL的用蒸馏水补足。加入无水乙醇使其含量达到80%,在4℃冰箱中放置过夜使多糖沉淀析出。使用高速离心机8000rpm×15min离心,得到多糖沉淀。使用无水乙醇洗涤沉淀2~3遍,以去除杂质,将乙醇挥发至干,蒸馏水溶解沉淀后容量瓶定容,即得多糖样品待测液。
1.4.1.4 标准曲线制作
称取葡萄糖标准品20mg,加水定容至100mL,得0.2mg·mL-1的葡萄糖母液,加水稀释成一系列梯度的葡萄糖标准溶液。依次加入6%苯酚溶液1mL,浓硫酸5mL,摇匀后静置5min,置沸水中水浴15min,冷却至室温后在490nm处测定吸光度,根据所得数据绘制标准曲线。
1.4.1.5 多糖样品的测定
取上述制得的多糖样品溶液1mL,加入1mL的蒸馏水,按照文中葡萄糖标准品的显色方法,在490nm处测定吸光度,带入标准曲线中算得样品中多糖含量。
1.4.2 总黄酮含量测定
参照李丹丹等[10]方法进行。
1.4.2.1 供试材料、样品处理及供试仪器同1.3.1。
1.4.2.2 样品溶液制备
分别精密称取金线莲组培叶与全株粉末1.0000g,置于微波提取灌中,加95%乙醇50mL,调节温度为80℃,功率为600W,提取30min,提取2次,合并滤液,转移至小烧瓶,水浴加热至烧瓶内的液体少于100mL,转入100mL容量瓶,加95%乙醇定容至刻度。
1.4.2.3 对照品溶液制备
精密称取芦丁对照品10.00mg,置于100mL容量瓶中,用95%乙醇溶解定容,配成0.1mg·mL-1芦丁标准溶液。
1.4.2.4 标准曲线制作
取0.0mL、1.0mL、2.0mL、3.0mL、4.0mL、5.0mL芦丁对照品至10mL具塞试管中,先加入5%亚硝酸钠溶液0.6mL,摇匀。放置6min,加10%亚硝酸铝溶液0.6mL,摇匀;放置6min,加入4%的氢氧化钠溶液3mL,再用蒸馏水稀释至刻度,摇匀。以第1支试管做空白,在500nm波长处测吸光度。以吸光度A为纵坐标,浓度C(ug·mL-1)为横坐标,求得回归方程A=0.0113C-0.0233,R2=0.9948。在0.00~0.05mg·mL-1的范围内,浓度与吸光度有良好的线性关系。
1.4.2.5 样品总黄酮含量测定
取各样品1mL置10mL具塞试管中,再分别加入5%亚硝酸钠溶液0.6mL,摇匀;放置6min,加入10%硝酸铝溶液0.6mL,摇匀;放置6min,加入4%NaOH溶液3mL,再用蒸馏水稀释至刻度,摇匀;放置15min,以芦丁为对照品,在500nm下测定其吸光度。
1.5 数据处理与统计
数据分析采用Excel 2010、Origin 2018进行数据处理及做图分析,采用DPS V7.05数据处理系统,在完全随机设计下采取单因素实验统计分析中LSD多重比较法进行统计学分析。
2 结果与分析
2.1 多糖含量的动态变化
金线莲中的多糖是抑制糖尿病血管病变的物质,是金线莲中治疗有关糖尿病的重要活性化合物[11]。从表1可知,人工更新方式金线莲多糖含量高于金线莲组培苗直接种植方式,取样的每个月,多糖含量是组培苗直接种植1.1~1.7倍;就种植时间变化分析认为,随着种植时间的延长,其多糖含量逐渐增加,在种植1~4个月,总黄酮含量达到差异水平(P﹤0.01),但在种植5个月和6个月后,其黄酮含量虽有增加,但未达到差异水平,2种种植方式趋势一致,可能是由于金线莲经过长时间生长后,可溶性多糖转化为纤维素等非可溶性多糖。由此可见,种植4个月以上金线莲可获得较高的多糖,这为金线莲的采收提供科学依据。

表1 试验处理
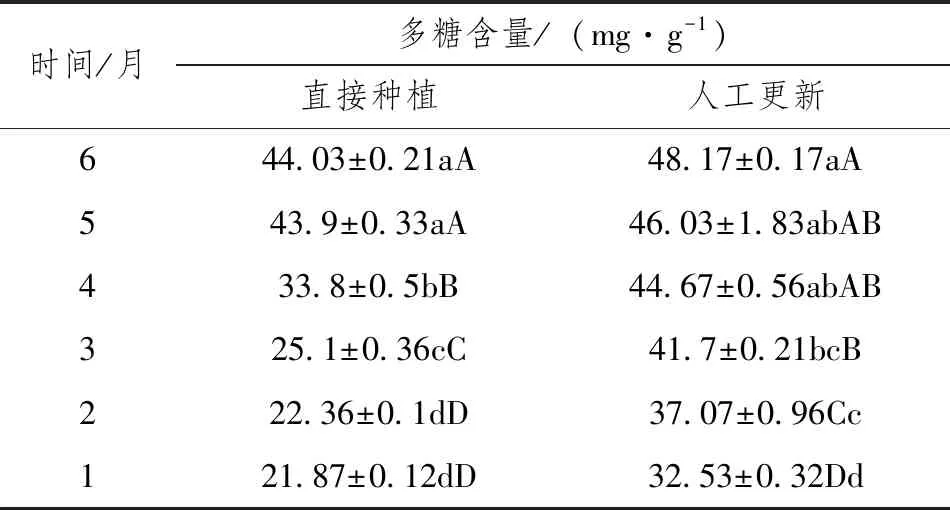
表2 金线莲直接种植和人工更新后多糖含量动态变化
2.2 总黄酮含量的动态变化
黄酮是次级代谢产物中的一种,产生于植物生长发育的过程中。金线莲中主要的黄酮化合物有芦丁、槲皮素、山奈酚等,具有抗氧化性,可以降血糖、降固醇、促进伤口愈合等[12]。2种方式金线莲叶片中黄酮含量的变化见表3。结果显示:直接种植和留地下部分萌芽更新方式,金线莲叶片中总黄酮含量均随处理时间的延长,总黄酮含量呈上升趋势,萌新6个月与其它月份达到显著差(P<0.01)。而种植6个月后萌新与组培苗直接种植相比,取样的每个月,总黄酮含量是组培苗直接种植1.2~1.3倍。随着种植时间增加,金线莲药用成分的含量也在增加,这与之前很多研究结果相一致[7]。
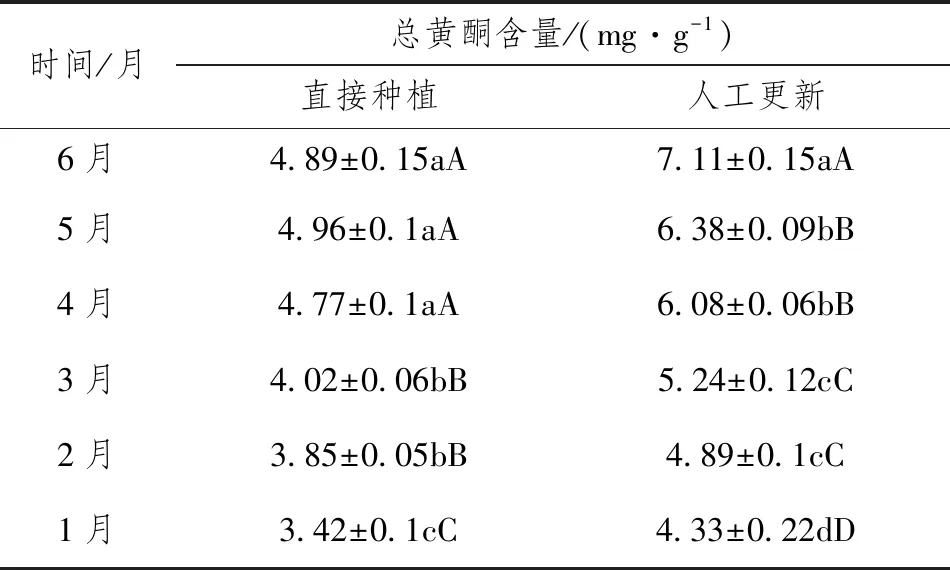
表3 金线莲直接种植和人工更新后总黄酮含量动态变化
3 结论与讨论
植苗造林及更新是在造林中比较常用的方法,该方法是将将植株直接种植[13],等生长到一定程度后砍伐,抚育让其自然更新,可减少人力、物力等的消耗,并能有较高的成活率。而作为林下经济植物的金线莲,其种苗费用在整个种植成本中占比较大,通过人工更新模拟野生金线莲繁殖方式是值得探索的途径。因此,本研究对不同更新技术对金线莲品质的影响进行研究。
综上可知,不同土质、不同栽培时间,金线莲中多糖和黄酮成分变化较大。人工促进金线莲天然更新方式中金线莲叶片中多糖和黄酮含量显著高于组培苗直接种植方式,且在栽培5~6月时药用价值含量增加缓慢,这对栽培和采收金线莲具有重要指导意义。

