Vishniacozyma carnescens PGLY-1的分离、鉴定及对梨青霉病的抑制作用评价*
马 强,石雅君,李正男,王文辉,孙平平
(1内蒙古农业大学园艺与植物保护学院,呼和浩特010018)(2中国农业科学院果树研究所)
我国是世界上最大的梨生产国[1],由扩展青霉Penicillium expansum引起的梨青霉病是发生最普遍、危害最严重的梨采后真菌病害,给果农和经销商造成了严重的经济损失。该病害在梨果运输、贮藏过程中均可发生,病原菌可经伤口侵入,病果与健康果实也可通过接触传播,感病梨果肉由外向内腐烂,果肉凹陷,在果实表面先产生白色菌丝,随后产生青绿色、堆粉状病菌孢子霉斑,且伴有强烈的发霉气味[2]。另外,P.expansum产生的展青霉素具有致畸、致癌和免疫毒性,危害人体健康[3]。目前,针对青霉菌主要利用多菌灵、甲基硫菌灵、苯来特、噻苯咪唑等化学药剂进行防治,但长期使用化学杀菌剂会对人类健康和环境造成危害,且易导致病原菌产生抗药性,从而降低防效[4],因此对青霉病的绿色防控成为替代化学防控的主要措施。
利用拮抗微生物防治果蔬采后病害是近年来的研究热点[5],其中酵母菌作为安全、无毒、不污染环境、抗病强、繁殖快的有益微生物受到广泛的关注。目前,在果蔬采后病害控制中效果较好的酵母菌主要有假丝酵母属Candida、隐球酵母属Cryptococcus、梅奇酵母属Metschnikowia、毕赤酵母属Pichia、红酵母属Rhodotorula和丝孢酵母属Trichosporon等[5-8]。然而,这些生防菌株远不能满足我国农业生产的需求,筛选出更多具有较好防治效果的酵母菌仍然是当务之急。内蒙古地区气候条件多样、微生物资源丰富[9],从该地区筛选出对病害具有抑制活性的酵母菌,将为植物病害的绿色防控提供更多的资源。目前,对从内蒙古地区分离酵母菌的研究主要集中在奶制品、饲料、酿酒以及重金属降解上[10-13],利用酵母菌对植物病害进行防治,仅见宋娟[14]筛选出Pichia anomalax6和Rhodotorula glutinisp2用于厚皮甜瓜采后病害防治的研究。由于研究者更容易从某一发病区域内长势良好的植物根基、叶表、体内分离出具有很好生防效果的生防菌[15],因此,本研究从内蒙古地区废弃果园中长势良好的‘苹果梨’叶片上分离筛选到1株酵母菌,探究了该菌株对梨青霉病的防控效果,并确定了其分类地位。
1 材料与方法
1.1 试验材料
选择大小一致、无可见机械损伤的‘黄冠’梨果实30个左右,5 ℃贮藏备用。
马铃薯葡萄糖琼脂(PDA)培养基、酵母膏蛋白胨葡萄糖(YPD)培养基、孟加拉红培养基均购自青岛高科园海博生物技术有限公司;Ezup柱式酵母菌基因组DNA提取试剂盒、Sanprep柱式DNA凝胶回收试剂盒(SK8131)购自生工生物工程(上海)有限公司;PCR扩增试剂盒、pMDTM19-T Vector克隆试剂盒,购自宝日医生物技术(北京)有限公司。
供试梨青霉菌P.expansum由作者在前期研究中分离得到[16]。将斜面保存的病原菌P.expansum转入PDA培养基上,25 ℃培养箱中恒温培养,用于后续离体及活体试验。
1.2 试验方法
1.2.1酵母菌分离及形态学鉴定
2018年5月,在内蒙古巴彦淖尔市废弃的病害严重的‘苹果梨’园内,选取长势旺盛的‘苹果梨’树,采集4片叶片,装入自封袋中运至实验室4 ℃保存。参照Janisiewicz等[17]的方法对叶片上的酵母菌进行分离,将叶片用无菌剪刀剪至1 cm×1 cm左右,置于25 mL含有0.05 mol/L、pH值6.8的磷酸缓冲液中,100 r/min摇床振荡10 min,在超净工作台将洗液梯度稀释10、100倍后,各取100 μL涂布于孟加拉红培养基上,28 ℃培养2~3 d,挑取单个酵母菌落转入YPD平板上,28 ℃培养3 d,用光学显微镜(LEICA ICC50W)观察其细胞形态及无性繁殖方式,结合菌落形态对分离菌株进行初步鉴定。
1.2.2分离酵母菌对梨青霉病的活体抑制活性
在显微镜下用血球计数板计数、配制酵母菌悬液和青霉菌孢子悬浮液。具体操作如下:用无菌水将YPD培养液中培养5 d的酵母菌液稀释至浓度为106个/mL,制成酵母菌悬液;用无菌刀片刮取在PDA培养基上培养5 d的青霉菌孢子,再用无菌水稀释至孢子浓度为108个/mL。参照Sadeghian等[18]的方法,用‘黄冠’梨测定分离酵母菌对梨青霉病的活体抑制活性,每个处理重复3次,每处理4个果实。将‘黄冠’梨果实于2%次氯酸钠溶液中浸泡3 min,无菌水冲洗后晾干。用无菌打孔器在‘黄冠’梨果实赤道部位打5 mm(深)×3 mm(宽)的伤口,用移液器向伤口内注入100 μL酵母菌悬液,放入铺有滤纸的保鲜盒中,保鲜膜封口,20 ℃下保湿培养。以致伤后注入100 μL YPD培养液为对照。处理2 d后,在伤口处接种10 μL梨青霉菌孢子悬浮液,继续保湿培养,分别在接种病原菌后第5、10、15、20、25 d观察发病情况,采用十字交叉法测量病斑直径,并计算PGLY-1对梨青霉病的抑制活性。
抑制活性(%)=(1-处理病斑直径/对照病斑直径)×100
1.2.3分离酵母菌对梨青霉病的离体抑制活性
利用平板对峙法测定酵母菌对梨青霉菌的离体抑制活性。挑取培养5 d直径为6 mm的青霉菌菌饼,置于直径9 cm的PDA平板中央,并在距离青霉菌菌饼3 cm的2个相对方向,分别接种YPD平板上生长3 d的待测酵母菌菌饼,然后置于25 ℃恒温培养箱中黑暗培养。每个处理重复3次,以不接种酵母菌的平皿为对照。待对照菌落长满平板时,观察并记录抑菌圈直径。
同时测定PGLY-1无细胞发酵液对青霉菌的离体抑制活性。将在YPD平板上培养3 d的PGLY-1菌株转入YPD培养液中,在28 ℃、180 r/min条件下培养5 d后,发酵液8 000 r/min离心10 min,取上清液。待融化的PDA温度降至约50 ℃时,将100 mL PDA与10 mL PGLY-1发酵上清液混匀,倒入直径9 cm的平板中,于平板中央接种青霉菌菌饼,然后在25 ℃恒温培养箱中黑暗培养。以不加酵母菌发酵液的PDA为对照,观察并记录青霉菌的菌落生长情况。
1.2.4ALY-1的分子鉴定
利用Ezup柱式酵母菌基因组DNA提取试剂盒提取ALY-1总DNA,采用通用引物NL1(GCATAT CAATAAGCGGAGGAAAAG)/NL4(GGTCCGTGTT TCAAGACGG)[19]对其26S rDNA D1/D2区片段进行扩增。PCR反应体系为:10×buffer 2.5 μL、dNTP(2.5 mmol/L)1 μL、上下游引物(10 μmol/L)各0.5 μL、Taq酶(5 U/μL)0.5 μL、DNA(100 ng/μL)1 μL,灭菌双蒸水补平至25 μL。PCR反应条件为:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min。取5 μL PCR产物经1%琼脂糖凝胶电泳检测后,利用Sanprep柱式DNA凝胶回收试剂盒(SK8131)回收纯化,连接pMD19-T载体,转化到Escherichia coli菌株DH5α 感受态细胞,涂布于含Amp的LB平板上,37 ℃培养过夜,挑选单菌落,将PCR扩增鉴定阳性的单克隆送至生工生物工程(上海)股份有限公司进行测序。
1.3 数据分析
采用SPSS统计软件中的 T-test比较分析ALY-1对青霉病的活体抑制活性。使用Vector NTI Advance 11软件将测序结果进行校正,提交到GenBank数据库(登录号:MN483179);用BLASTn程序对序列进行同源序列搜索;应用MEGA 6.0软件,采用ClustalW算法对序列进行比对,用比邻法(neighbor-joining,NJ),校正值设定为1 000,并以50%为阈值构建系统发育进化树。
2 结果与分析
2.1 活性酵母菌的分离及形态学鉴定
从采集的‘苹果梨’树叶片上分离得到1株酵母菌株,编号为PGLY-1。PGLY-1菌落在YPD培养基上呈乳白色,菌落光滑、湿润、黏稠、容易挑起,颜色均匀一致。在40倍光学显微镜下,观察到PGLY-1细胞呈卵圆形,无性繁殖方式为单边出芽,具有典型酵母菌的菌落及细胞形态特征(图版4)。
2.2 分离酵母菌对梨青霉病的抑制活性
离体结合活体测定PGLY-1对梨青霉病的抑制活性,结果显示,PGLY-1菌株及其无细胞发酵液在离体条件下均对梨青霉菌无显著抑制活性,但其菌悬液在活体条件下对梨青霉病的病斑直径扩展具有显著的抑制作用。活体条件下,经PGLY-1菌悬液处理的‘黄冠’梨在接种青霉菌后的病斑直径均显著小于对照,在测定的25 d内PGLY-1对青霉病的活体抑制活性均在50%以上。接种5 d后PGLY-1处理的梨青霉病斑直径为1.21 mm,显著小于对照的 2.79 mm,对梨青霉病的抑制活性为56.63%;接种25 d后,PGLY-1处理的梨青霉病斑直径为12.54 mm,极显著小于对照的28.03 mm,对梨青霉病的抑制活性为55.26%(表1,图1)。
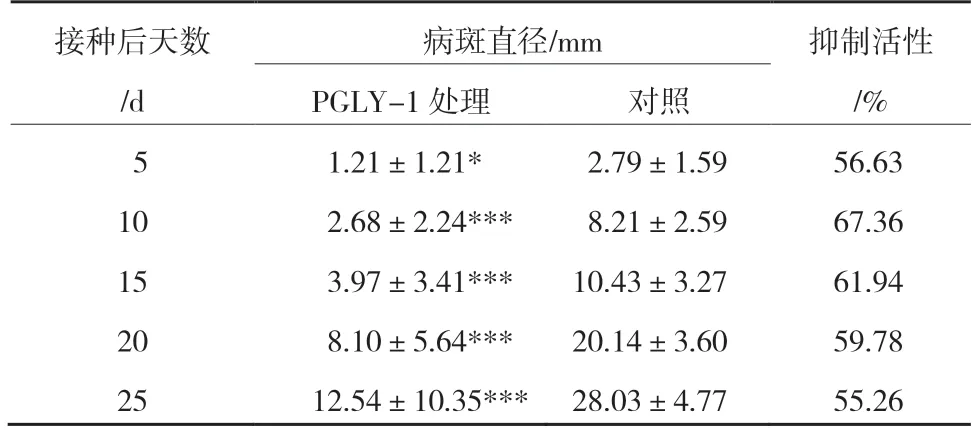
表1 PGLY-1处理‘黄冠’梨青霉病斑直径及抑制活性
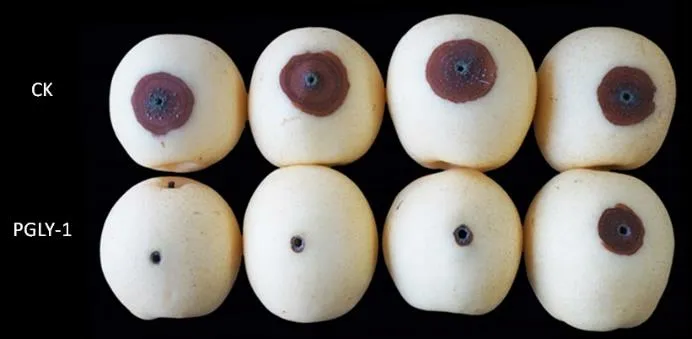
图1 酵母菌PGLY-1处理25 d后对青霉病的抑制情况
2.3 分离酵母菌的分子生物学鉴定
以菌株PGLY-1的DNA为模板,对其26S rDNA基因片段进行扩增,得到长度为616 bp的目标片段。采用Vector NTI Advance 11(Thermo Fisher Scientific,USA)软件对测序结果进行校正,并将校正后的结果提交到GenBank数据库(登录号:MN483179)。利用BLASTn进行同源性序列搜索,选取相似性较高的Vishniacozyma属的V.carnescens(EU194464、KT933344、AB035054)、V.tephrensis(DQ000318、KX507032 )、V.heimaeyensis(DQ000317、JQ768868)、V.psychrotolerans(JN193444、JN193445)、V.taibaiensis(KP263768、AY557601)共11个代表菌株序列,并以隐球酵母属的Cryptococcus diffluens(AF181543、KM085333)为外参序列构建系统发育进化树。结果显示,菌株PGLY-1与V.carnescens种的3个菌株聚集在同一支上(图2),PGLY-1与V.carnescens代表菌株CBS973(AB035054)的26S rDNA基因的序列一致性达到100%,因此确定PGLY-1为Vishniacozyma carnescens。
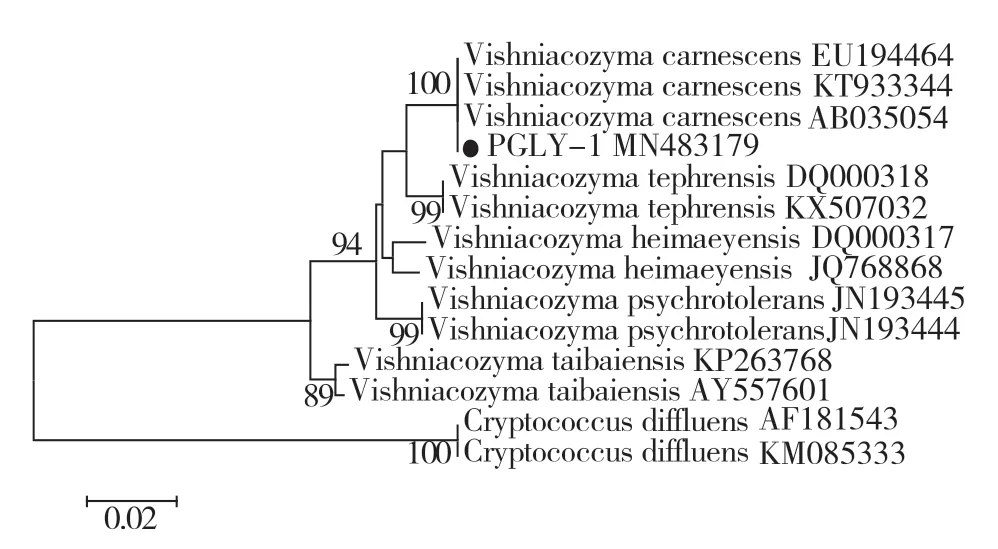
图2 基于26S rDNA序列构建菌株PGLY-1的系统发育树
3 讨论与结论
本研究从内蒙古巴彦淖尔市废弃的‘苹果梨’园内长势好的梨树叶片上,分离到1株可显著抑制梨青霉菌扩展的酵母菌V.carnescens,该发现为内蒙古地区酵母菌资源的利用提供了更多的基础。V.carnescens原被归为Cryptococcus属,Liu等[20]于2015年对其进行重新分类,将其归为Vishniacozyma属。Vishniacozyma属酵母菌多在植物中被检测到[21],目前有从酿酒葡萄、落叶、果树、土壤以及湖水中分离或鉴定到V.carnescens菌株的报道[22-27],但是对其功能、应用,尤其是病害防治等均未见报道。本研究发现的V.carnescensPGLY-1能显著抑制青霉病在梨果上的扩展,该发现补充了用于青霉病生物防治的微生物资源,同时也是对V.carnescens应用的进一步扩展。
拮抗酵母菌主要通过营养物质与空间竞争、对病原菌直接寄生、产生抑菌物质直接作用于病原菌、诱导寄主抗性等多个方面对病原菌进行防控[5]。目前,已经报道的对果蔬贮运过程中的青霉病具有抑制活性的酵母菌有:浅白隐球酵母C.albidus、黏红酵母R.glutinis、橄榄假丝酵母C.oleophila、膜醭毕赤酵母P.membranaefaciens、季也蒙迈耶氏酵母Meyerozyma guilliermondii、葡萄汁有孢汉逊酵母Hanseniaspora uvarum、拟粉红锁掷孢酵母Sporidiobolus pararoseus、解脂耶罗威亚酵母Yarrowia lipolytica[28-36]等。其中,浅白隐球酵母和黏红酵母可以通过在果实表面快速定殖与病原菌进行营养物质和空间竞争来抑制病原菌的扩展[28-29]。橄榄假丝酵母、膜醭毕赤酵母与季也蒙迈耶氏酵母通过与病原菌的营养物质和空间竞争,以及诱导寄主抗性来抑制青霉菌[30-33]。葡萄汁有孢汉逊酵母、拟粉红锁掷孢酵母和解脂耶罗威亚酵母,除了通过与病原菌的营养物质和空间竞争、诱导寄主产生抗性等方式外,还可以通过产生抗菌物质直接作用于致病菌[34-36]。本研究分离得到的V.carnescensPGLY-1的菌悬液,在活体条件下能够显著抑制梨青霉病的扩展,但是菌株及其发酵液在离体条件下对青霉菌无显著抑制作用。当植物受到外源物质诱导或者病原菌侵染时,体内抗性相关酶及其基因的表达增强,这些抗性相关酶的表达在果实抗真菌病害的过程中具有十分重要的作用[37-38]。因此,V.carnescensPGLY-1在果实表面的定殖,对果实抗性相关酶以及相关基因表达的影响等抗病机制值得进一步研究。

