小豆蔻明对宫颈癌HeLa 细胞增殖的影响及其机制
崔银峰, 柴梦钰, 杨万山, 潘 颖
(1.延边大学附属医院口腔科,吉林 延吉 133000;2.延边大学医学院病理学教研室,吉林 延吉 133002;3.吉林大学中日联谊医院妇产科,吉林 长春 130033)
宫颈癌是全球第四大最常见的女性恶性肿瘤,每年约有53 万新发病例,27 万例死亡,是妇女癌症死亡的主要原因之一[1]。目前,化疗和放疗是人类宫颈癌常见的治疗干预手段,可作为初级治疗、辅助治疗或新辅助治疗。然而宫颈癌晚期患者的预后仍然很差,采用常规治疗后患者5 年总生存率约为40%[2]。因此,迫切需要开发更有效的、不良反应少的新型宫颈癌治疗药物。 小豆蔻明(cardamonin, CAR) 是从高良姜中分离出来的查尔酮。既往研究[3-7]表明:CAR 在结肠癌、乳腺癌和胶质母细胞瘤组织中具有明显的抗肿瘤活性;此外CAR 还能抑制具有化疗耐药特性的胃癌细胞生长。目前有关CAR 对宫颈癌细胞增殖的影响及其相关机制尚未见报道。 本文作者观察不同浓度CAR 对宫颈癌HeLa 细胞增殖的影响,并探讨其可能的作用机制,为CAR 的临床应用和宫颈癌的新药开发提供新的理论依据。
1 材料与方法
1.1细胞、主要试剂和仪器人宫颈癌HeLa 细胞(美国ATCC 细胞库)。CAR (中国惠科植物开发有限公司),CCK-8 试剂盒和hoechst33258 凋亡检测试剂盒(中国碧云天生物技术有限公司),B 细胞淋巴瘤2 (B-cell lymphoma-2,Bcl-2)、Bcl-2 相关X 蛋白(Bcl-2 associated X protein,Bax)、磷酸化 磷 脂 酰 肌 醇 3 激 酶 (phosphorylated phosphatidylinositol 3-kinase, p-PI3K)、 磷 酸 化蛋 白 激 酶 B (phosphorylated protein kinase B ,p-AKT) 和β-actin 抗体购自美国CST 公司。全波长酶标仪、细胞成像多功能酶标仪和凝胶成像仪购自美国Bio-Rad 公司, 流式细胞仪购自美国Beckman Coulter 公司。
1.2 CCK-8法检测各组宫颈癌HeLa细胞活性取对数生长期的宫颈癌HeLa 细胞,接种于96 孔板中(5×103个细胞/孔),贴壁后以不同浓度CAR 处理24~72 h 作为不同浓度CAR 组,对照组不加入任何试剂。加入CCK-8 溶液(每孔20 μL) 孵育1 h,采用酶标仪于450 nm 处检测各孔吸光度(A) 值,计算各组宫颈癌HeLa 细胞活性。细胞活性= (药物处理样品孔A 值/对照样品孔A 值) ×100%。
1.3菌落形成实验检测各组宫颈癌HeLa细胞克隆形成能力不 同 浓 度(10、 20 和40 μmol · L-1)CAR 处理24 h 后,将对数生长期宫颈癌HeLa 细胞以每孔100 个细胞的密度接种于6 孔板中培养10 d,对照组不给予CAR (0 μmol·L-1CAR 组),结晶紫染色后,计数细胞菌落数,以细胞菌落数代表宫颈癌HeLa 细胞的克隆形成能力。
1.4 Hoechst33258染色检测各组宫颈癌HeLa细胞凋亡形态表现将对数生长期HeLa 细胞接种于6 孔板中,待细胞密度生长至70%, 给予CAR 处理24 h后,每孔加入1 mL Hoechst33258 (10 mg·L-1),室温孵育10 min; 抗荧光淬灭封片剂封片, 采用Cytation 5 多功能检测系统进行荧光拍照,观察各组宫颈癌HeLa 细胞凋亡形态表现。
1.5 Western blotting法检测各组宫颈癌HeLa细胞中Bcl-2、Bax、p-PI3K和p-AKT蛋白表达水平收集并裂解经CAR 处理后的细胞,取30 μg 蛋白经10%SDS-PAGE 电泳、转膜,5% 脱脂奶粉TBST缓冲液室温封闭1 h,加入一抗4℃过夜,采用HRP标记的二抗杂交,1 h 后采用Gel Doc 凝胶成像仪成像,以β-actin 作为内参对照,计算目的蛋白表达水平。 目的蛋白表达水平= 目的蛋白条带灰度值/β-actin 条带灰度值。
1.6统计学分析采用Prism 7.0 统计软件进行统计学分析。各组宫颈癌HeLa 细胞活性、细胞克隆形成数和细胞中p-PI3K 和p-AKT 蛋白表达水平及Bcl-2/Bax 比值经正态性检验呈正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1各组HeLa细胞活性采用不同浓度CAR 分别处理24、48 和72 h 后,采用CCK-8 法检测HeLa 细胞活性。CAR 以浓度依赖性方式降低宫颈癌HeLa细胞活性,并且随着时间的增加,CAR 浓度越高时,HeLa 细胞活性越低(24 h:F=69.75,P=0.011 8; 48 h:F=222.6,P=0.000 4; 72 h:F=145.4,P=0.002 2)。见图1。
2.2不同浓度CAR作用后各组宫颈癌HeLa细胞克隆形成数分别以10、20 和40 μmol·L-1CAR 处理HeLa 细胞24 h, 采用菌落形成实验检测CAR 对HeLa 细 胞 增 殖 的 影 响。 与 对 照 组(0 μmol · L-1CAR 组) 比较,随着CAR 药物浓度的增加,不同浓度CAR 组HeLa 细胞菌落形成数逐渐减少(P<0.01)。见图2 (插页四) 和图3。
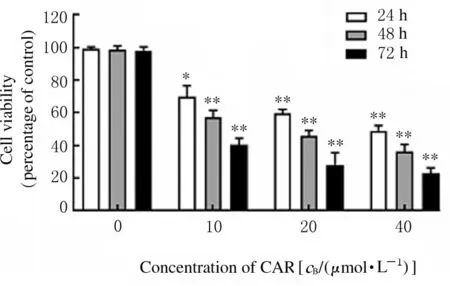
图1 各组宫颈癌HeLa 细胞活性Fig.1 Cell viabilities of cervical cancer HeLa cells in various groups
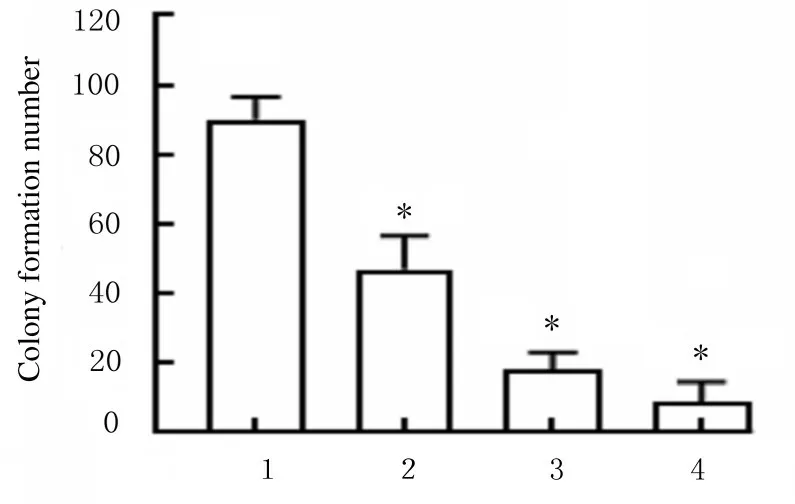
图3 各组宫颈癌HeLa 细胞克隆形成数Fig.3 Clone formation number of cervical cancer HeLa cells in various groups
2.3各组HeLa细胞凋亡形态表现Hoechst33258染色结果表明: 对照组细胞核呈蓝色且染色均匀; CAR 作用24 h 后,随着CAR 浓度的增加,细胞核数量逐渐减少,出现明显聚集、皱缩或碎裂的凋亡形态,且出现高度浓缩或破碎的亮蓝色荧光染色。见图4 (插页四)。
2.4各组HeLa细胞中Bcl-2和Bax蛋白表达水平与对照组比较,不同浓度CAR 组HeLa 细胞中抗凋亡蛋白Bcl-2 表达水平降低,而促凋亡蛋白Bax 表达水平明显升高, Bcl-2/Bax 比值降低(P<0.01)。见图5。
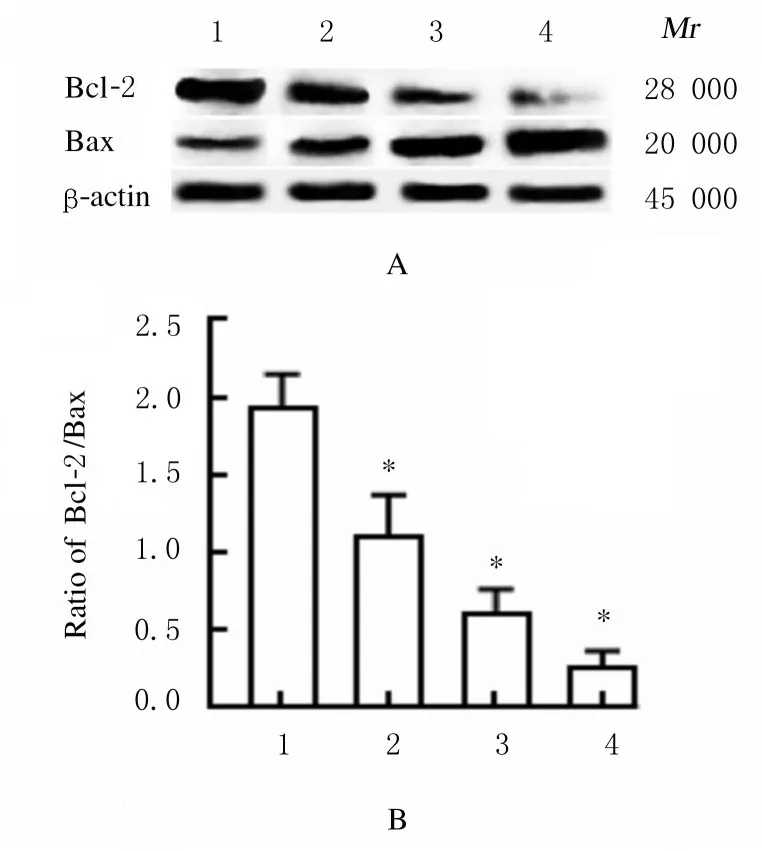
图5 各组宫颈癌HeLa 细胞中Bcl-2 和Bax 蛋白表达情况Fig.5 Expressions of Bcl-2 and Bax proteins in cervical cancer HeLa cells in various groups
2.5各组HeLa细胞中PI3K和AKT表达水平与对照组比较,不同浓度CAR 组HeLa 细胞中p-PI3K和p-AKT 蛋白表达水平均升高(p-PI3K:F=68.75,P=0.011 8; p-AKT:F=20.80,P=0.034 9)。见图6。
3 讨 论
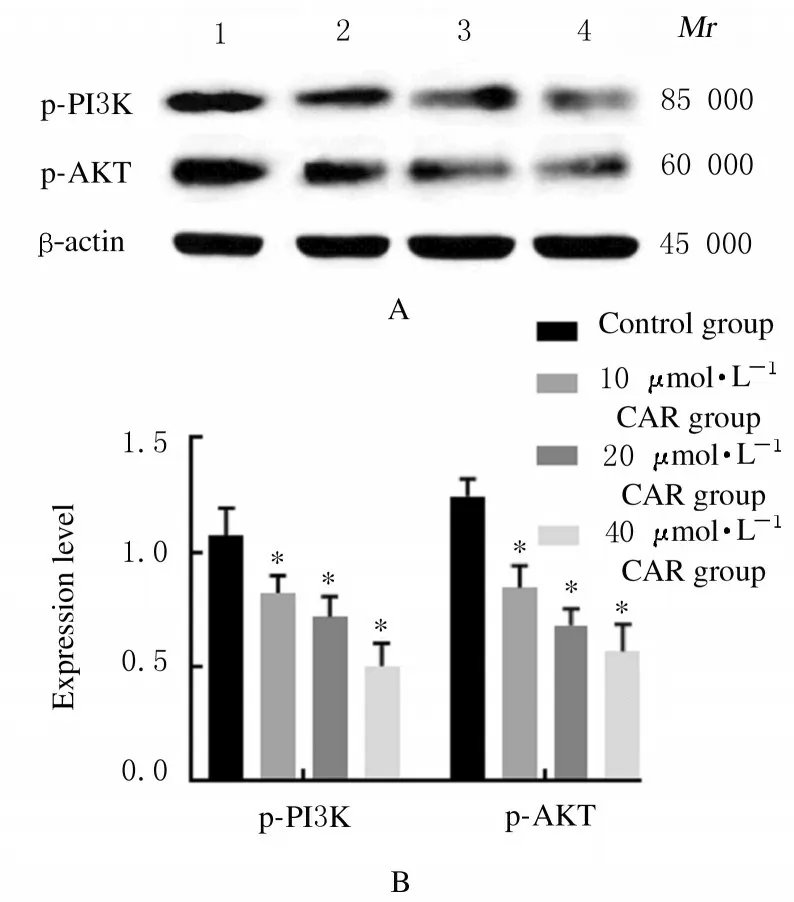
图6 各组宫颈癌HeLa 细胞中p-PI3K 和p-AKT 蛋白表达情况Fig.6 Expressions of p-PI3K and p-AKT proteins in cervical cancer HeLa cells in various groups
宫颈癌是世界范围内最常见的妇科恶性肿瘤之一,已成为一个突出的公共卫生问题。据统计,宫颈癌发病率在妇科恶性肿瘤中排名第二,死亡率在女性生殖道恶性肿瘤中排名第一,是威胁女性健康的重要恶性疾病[8]。每年有50 多万名妇女被诊断患有宫颈癌,并导致全世界30 多万人死亡。宫颈癌的治疗取决于诊断时疾病程度和当地可获得的治疗资源,包括彻底的子宫切除、化疗、放疗或两者结合。放疗技术的进步,例如强度调节放疗已成为患有局部晚期疾病患者的首选治疗方法。然而对于患有转移性或复发性宫颈癌的女性,其总体预后仍然较差[9]。
CAR 为广泛存在于豆蔻香料及姜科药用植物中的主要查尔酮[10],具有抗炎、抗肿瘤、血管舒张和抗感染等特性[11]。研究[12-14]显示:CAR 可抑制多种癌细胞的增殖和转移。 本研究结果显示:CAR 以浓度依赖和时间依赖的方式抑制HeLa 细胞活性,并能够抑制HeLa 细胞的菌落形成能力,表明CAR 能够抑制HeLa 细胞增殖。
细胞死亡是控制癌症进展的有效策略,多种化疗药物均采用该作用机制治疗癌症[15]。凋亡是程序性细胞死亡的主要类型之一,是一种基因调控现象,细胞形态表现为细胞皱缩、细胞膜起泡、染色质 凝 聚、DNA 断 裂 和 核 碎 裂 等[16-17]。LIAO 等[18]研究表明:在小鼠白血病细胞中,CAR 能够诱导细胞周期阻滞、凋亡并调控凋亡相关基因表达。本文作者采用Hoechst33258 染色发现:经CAR 处理后宫颈癌HeLa 细胞核出现皱缩或破碎。Bcl-2 蛋白家族是内源性线粒体凋亡途径的重要启动因子,主要包括促凋亡蛋白Bax 和抗凋亡蛋白Bcl-2[19]。Bcl-2 蛋白是Bcl-2 家族的关键成员,是细胞程序性死亡的调节因子, 可促进细胞在许多系统中存活[20]。此外,细胞中Bax 过度表达可导致Bcl-2 蛋白表达水平降低,且调控Bax 和Bcl-2 能够抑制肿瘤细胞增殖[21]。本研究结果表明:CAR 能够促进HeLa 细胞中Bax 蛋白表达并下调Bcl-2 蛋白表达。
作为癌症中最常见的不稳定信号通路,PI3K/AKT 信号通路参与调控细胞周期、细胞存活和基因组不稳定的过程和特征,抑制PI3K/AKT 通路能够诱导细胞凋亡从而抑制肿瘤细胞生长[22]。李 翔 等[23]研 究 表 明:AKT 抑制剂MK2206 能 够 抑制舌鳞癌TCA-8113 细胞增殖并诱导凋亡。ZHOU 等[24]研究表明:CAR 能够通过抑制PI3K/AKT 信号通路抑制非小细胞肺癌的增殖和转移。这与本研究结果一致,即在HeLa 细胞中,CAR 能够下调p-PI3K 和p-AKT 表达水平,表明CAR 能够抑制HeLa 细胞中PI3K/AKT 信号通路,从而诱导细胞凋亡,发挥抑制细胞增殖的作用。
综上所述,CAR 可能通过调控PI3K/AKT 信号通路诱导HeLa 细胞凋亡,从而抑制细胞增殖,发挥抑制宫颈癌进展的作用。CAR 能够抑制HeLa细胞活性和克隆形成能力,并能够靶向凋亡相关调控基因Bcl-2 和Bax 蛋白诱导HeLa 细胞发生凋亡,其机制可能与下调PI3K 和AKT 表达有关。本研究结果为CAR 抗肿瘤作用的进一步开发和合理利用奠定了理论基础,但CAR 诱导凋亡的确切机制尚未明确,需从分子生物学水平继续探讨。

