黄芪多糖对人肺癌顺铂耐药株A549/DDP 细胞耐药性的影响及其机制
柳 叶, 陈龙云
(1.湖北中医药大学检验学院临床微生物学教研室,湖北 武汉 430065;2.湖北中医药大学基础医学院生物化学教研室,湖北 武汉 430065)
肺癌在恶性肿瘤相关死亡原因中占第一位[1]。顺铂(cisplatin, DDP) 作为肺癌的一线治疗药物,在临床实际中长期应用可引起肿瘤细胞对其产生耐药性,使其化疗效果极不理想,因此寻找肺癌细胞DDP 逆转剂非常有必要[2]。中药治疗肿瘤具有多靶点、多途径和不良反应少的优势,近年来研究其在抗肿瘤中的作用及其机制已经成为抗肿瘤药物 研 究 的 热 点。 黄 芪 多 糖 (astragalus polysacharin, APS) 是黄芪的主要活性成分之一,具有抗病毒、改善肠道菌群和调节机体免疫力等作用[3]。研究[4-6]显示:APS 可抑制乳腺癌、肺癌和肝癌等多种肿瘤的生长,诱导肿瘤细胞凋亡。目前关于APS 对肺癌DDP 耐药的研究较少, 既往研究[7-9] 表 明:APS 能 降 低 结 直 肠 癌HT-29/DDP 细胞、卵巢癌SKOV3 和食管癌EC109/DDP 细胞的DDP 耐药性。但APS 对肺癌耐药性的作用及其具体机制尚不清楚。本实验研究APS 对人肺癌DDP耐药株A549/DDP 细胞耐药性的影响及其可能的分子机制。
1 材料与方法
1.1细胞、主要试剂和仪器人肺癌DDP 耐药株A549/DDP 细胞购自武汉普诺赛公司。 APS 购自上海源叶生物公司, DDP 购自美国Sigma 公司,Transwell 小室购自美国Corning 公司,RIPA 裂解液、蛋白浓度测定试剂盒、CCK-8 检测试剂盒和JC-1 检测试剂盒购自上海碧云天生物,凋亡检测试剂盒购自上海翊圣生物, 兔抗B 细胞淋巴瘤2 (B-cell lymphoma-2,Bcl-2)、Bcl-2 相关X 蛋白(Bcl-2 related X protein, Bax )、 P 糖 蛋 白( P-glycoprotein, P-gp)、 磷 脂 酰 肌 醇3 激 酶(phasphatidy inositol-3 kinase,PI3K)、蛋白激酶B(protein kinase B, AKT) 和β 肌动蛋白(β-actin)购自武汉三鹰生物技术有限公司,兔抗磷酸化磷脂酰肌醇3 激酶(phosphated phasphatidy inositol-3 kinase, p-PI3K) 和 磷 酸 化 蛋 白 激 酶 B(phosphated protein kinase B, p-AKT) 购自美国Abcam 公司。离心机购自德国Eppendorf 公司,超低温冰箱购自青岛海尔股份有限公司,CO2恒温培养箱购自日本Sanyo 公司。
1.2细胞培养人肺癌DDP 耐药株A549/DDP 细胞置于含10%FBS、1% 青霉素和链霉素的RPMI-1640 培养基中生长,并置于37℃、5%CO2相对饱和湿度的孵育箱中培养。在细胞培养过程中,为维持细胞耐药 性 于 培 养 体 系 中 加 入 DDP(1 mg · L-1),实验前2 周撤药。
1.3实验分组和CCK-8法检测各组细胞增殖抑制率取对数生长期生长状态良好的A549/DDP 细胞,采用含10% 胎牛血清、1% 青霉素和链霉素的RPMI-1640 培养基调整细胞密度至1×105mL-1,接入96 孔板,每孔加入100 μL 细胞悬液,实验分为对照组、APS 组、DDP 组和APS+DDP 组。其中APS 组分别加入不同浓度(25、50、100、200和400 mg·L-1) APS;DDP 组分别加入不同浓度(2、 4、 8 、 16 和32 mg·L-1) DDP; APS+DDP组分别加入不同浓度(2、4、8、16 和32 mg·L-1)DDP 及100 mg·L-1APS;每组设空白对照孔,每孔重复3 次。加药后37℃培养24 h,加药培养结束后加入10 μL CCK-8 溶液,37℃孵育4 h,于酶标仪450 mm 处检测各孔吸光度(A) 值,计算细胞增 殖 抑 制 率。 细 胞 增 殖 抑 制 率=1 - [ 实 验组A 值-空白对照组A 值] /[对照组A 值-空白对照组A 值] ×100%;计算DDP 时A549/DDP 细胞的半数抑制浓度(IC50),APS 逆转耐药倍数=IC50(A549/DDP 耐药细胞+DDP) /IC50(A549/DDP 耐药细胞+DDP+APS),即APS 逆转耐药倍数为使用APS 前DDP 对细胞IC50的值与使用APS后DDP 对细胞IC50值的比值, 该比值越大说明APS 逆转耐药作用越好。
1.4 Transwell小室法检测各组细胞迁移能力实验分为对照组、APS 组、DDP 组和APS+DDP 组。选用100 mg·L-1APS 和选用11.46 mg·L-1DDP 作为实验药物浓度。药物处理细胞24 h 后收集各组细胞,采用无血清培养基稀释细胞浓度至2×105mL-1。在24 孔板中加入800 μL 10% 胎牛血清培养基,并置入Transwell 小室, 在Transwell 上室分别接种200 μL 各组细胞悬液,37 ℃、5% CO2培养箱培养24 h。取出Transwell 小室,采用PBS 清洗1 次,采用70% 冰乙醇溶液固定细胞1 h。采用0.5% 结晶紫染液染色,室温中放置20 min,PBS 清洗1 次,采用干净的棉球将上室一侧的未迁移细胞擦试干净,显微镜下拍照观察迁移细胞数,以迁移细胞数表示细胞迁移能力。
1.5流式细胞术检测各组细胞凋亡率药物处理A549/DDP 细胞24 h 后收集对照组、 APS 组、DDP 组和APS+DDP 组细胞,采用预冷的PBS 将细胞清洗2 次,1 500 r·min-1离心去上清,随后采用AnnexinⅤ-FITC/PI 细胞凋亡检测试剂盒处理细胞:加入500 μL Binding Buffer 重悬细胞;取5 μL AnnexinⅤ-FITC 与5 μL PI 混匀;室温下避光反应5 ~15 min,采用流式细胞仪进行上机检测,计算细胞凋亡率。细胞凋亡率= (早期凋亡细胞数+晚期凋亡细胞数) /细胞总数×100%。
1.6流式细胞术检测各组细胞线粒体膜电位药物处理A549/DDP 细胞24 h 后收集对照组、 APS组、 DDP 组和APS+DDP 组细胞, 采用预冷的PBS 将 细 胞 清 洗2 次,1 500 r·min-1离 心 去 上 清。随后加入1 mL JC-1 染液混合, 在培养箱孵育20 min 后吸除上清,采用1×JC-1 染色缓冲液洗涤2 次后于流式细胞仪进行上机检测。线粒体膜电位以JC-1 单体阳性细胞率(右下象限细胞百分率)表示。
1.7 Western blotting法检测各组细胞中Bcl-2、Bax、P-gp、PI3K、AKT、p-PI3K和p-AKT蛋白表达水平药物处理A549/DDP 细胞24 h 后收集对照组、APS 组、DDP 组和APS+DDP 组细胞,采用预 冷 的1×PBS 洗 涤 细 胞3 次; 1 500 r·min-1离心5 min 弃上清;加入蛋白裂解缓冲液,冰上裂解30 min;每隔10 min 将裂解液涡旋振荡1 次;1 3000 r·min-1、4 ℃离心20 min,采用BCA 法检测上清液中蛋白浓度。上样后,通过SDS-聚丙烯酰胺凝胶电泳,待目的蛋白充分分离后停止电泳,取出凝胶用蒸馏水适当漂洗后转印于PVDF 膜。转膜结束,将膜泡于含50 g·L-1脱脂奶粉的TBST 中封闭1 h,随后将PVDF 膜浸泡于用封闭液稀释的一抗孵育液中,4 ℃孵育过夜,再在室温下用二抗孵育2 h,加入ECL 化学发光显影后扫描胶片,采用Image J 6.0 软件分析蛋白条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参β-actin 条带灰度值。
1.8统计学分析采用SPSS 16.0 统计软件进行统计学分析。 各组A549/DDP 细胞增殖抑制率、细胞线粒体膜电位、 细胞凋亡率、 细胞中Bax、Bcl-2、 P-gp、 p-PI3K、 PI3K、 p-AKT 和AKT 蛋白表达水平均呈正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。 以P<0.05 为差异有统计学意义。
2 结 果
2.1各组A549/DDP细胞增殖抑制率随着APS浓度的增加,APS 对A549/DDP 细胞的抑制作用也逐渐增强。100 mg·L-1APS 对细胞无明显毒性,其细胞抑制率小于10%。为避免细胞增殖抑制作用由APS 引起,本实验选用无毒剂量100 mg·L-1作为后续联合用药实验中的药物浓度。见图1。
DDP 对A549/DDP 细胞增殖有一定的抑制作用, 其IC50值 为22.6 mg·L-1。 无 毒 剂 量APS(100 mg·L-1) 联合DDP 对A549/DDP 细胞的抑制同样呈现剂量依赖性,其IC50值为11.46 mg·L-1。无毒剂量APS (100 mg·L-1) 的逆转耐药倍数为1.97 倍。见图2。
2.2各组A549/DDP细胞迁移能力与对照组比较, APS 组A549/DDP 细胞迁移数无明显变化。与APS 组比较,DDP 组A549/DDP 细胞迁移数降低。与DDP 组比较,DDP+APS 组A549/DDP 细胞相对迁移数降低。见图3 (插页四)。
2.3各组A549/DDP细胞凋亡率与对照组比较,APS 组A549/DDP 细胞凋亡率差异无统计学意义(P>0.05); 与APS 组比较, DDP 组A549/DDP细 胞 凋 亡 率 升 高(P<0.05); 与DDP 组 比 较,APS+DDP 组A549/DDP 细胞凋亡率升高(P<0.05)。见图4 和图5。
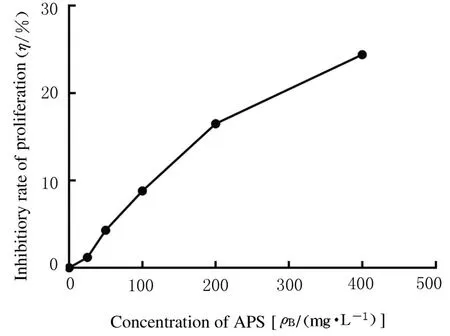
图1 CCK-8 法检测不同浓度APS 处理后各组A549/DDP细胞增殖抑制率Fig.1 Inhibitory rates of proliferation of A549/DDP cells in various groups after treated with different concentrations of APS detected by CCK-8 method
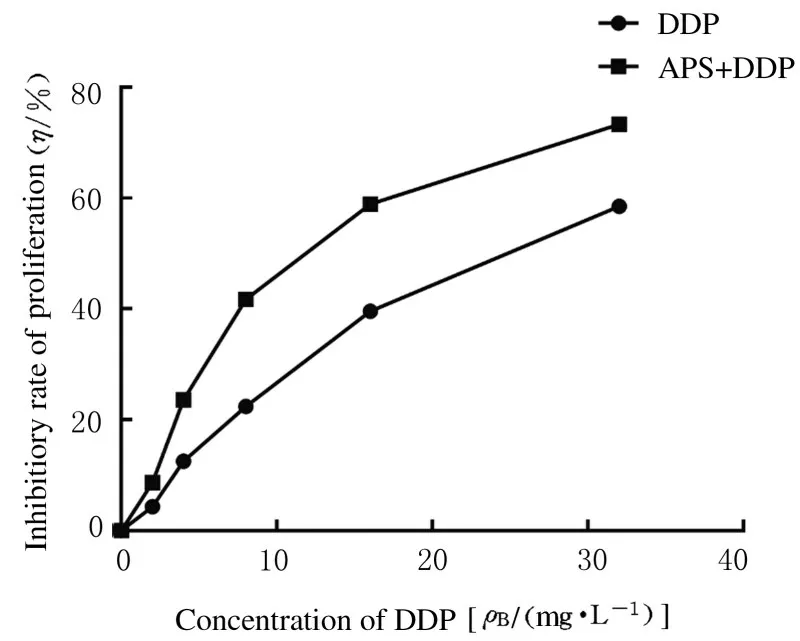
图2 CCK 8 法检测不同浓度DDP 处理后各组A549/DDP细胞增殖抑制率Fig.2 Inhibitory rates of proliferation of A549/DDP cells in various groups after treated with different concentrations of DDP detected by CCK-8 method
2.4各组A549/DDP细胞线粒体膜电位与对照组比较,APS 组A549/DDP 细胞线粒体膜电位比较差异无统计学意义(P>0.05);与APS 组比较,DDP 组A549/DDP 细胞线粒体膜电位明显降低(P<0.05);与DDP 组比较,APS+DDP 组A549/DDP 细胞线粒体膜电位明显降低(P<0.05)。见 图6 和图7。
2.5各组A549/DDP细胞中BAX、Bcl-2、P-gp、PI3K、AKT、p-PI3K和p-AKT蛋白表达水平Western blotting 检测结果显示: 与对照组比较,APS 组A549/DDP 细 胞 中Bcl-2、 P-gp、 PI3K、AKT、 p-PI3K 和p-AKT 蛋白表达水平明显降低(P<0.05),Bax 蛋白表达水平差异无统计学意义(P>0.05)。 与APS 组比较, DDP 组A549/DDP细 胞 中Bcl-2 、 P-gp 、 PI3K 、 AKT 、 p-PI3K 和p-AKT 蛋白表达水平明显降低(P<0.05), Bax蛋白表达水平升高(P<0.05)。 与DDP 组比较,DDP+APS 组A549/DDP 细 胞 中Bcl-2、 P-gp、PI3K、AKT、p-PI3K 和p-AKT 蛋白表达水平明显降低(P<0.05), Bax 蛋白表达水平升高(P<0.05)。见图8 和图9。

图4 各组A549/DDP 细胞凋亡率Fig.4 Apoptotic rates of A549/DDP cells in various groups
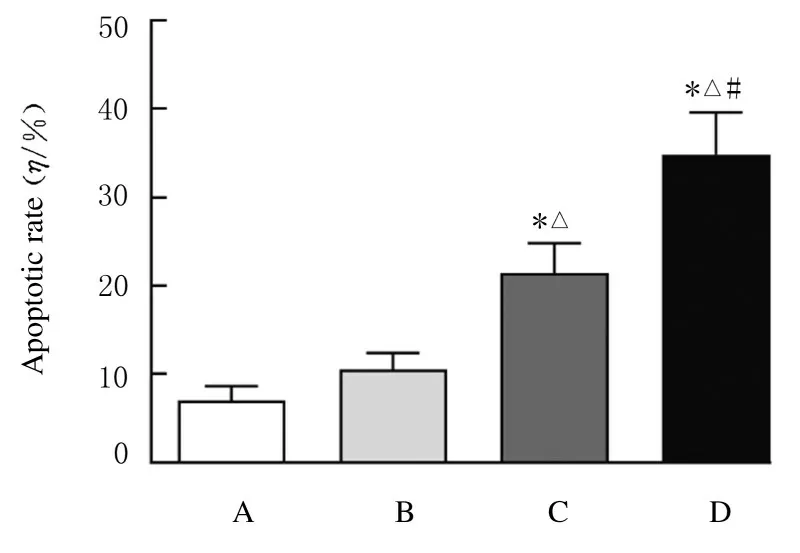
图5 各组A549/DDP 细胞凋亡率直条图Fig.5 Histogram of apoptotic rates of A549/DDP cells in various groups
3 讨 论
肺癌是呼吸系统较为常见的肿瘤,有较高的发病率和死亡率,严重威胁人们的健康。肺癌一般多见于中年以后的男性,近几年随着现代生活的发展,肺癌的发病率出现了上升和年轻化的趋势,这一趋势与不良生活习惯和环境污染有较大关系[10-11]。DDP 是世界上目前广泛使用的化疗药物之一,在肺癌的治疗过程中表现出较好的治疗效果,但长期应用可引起肿瘤细胞对其产生耐药性,而导致治疗效果不佳,因此为了提高患者的临床治疗效果, 寻找抵抗DDP 耐药性的新药十分必要[12-13]。APS 是黄芪中一种活性成分,具有抗肿瘤作用,另还具有成本低和不良反应少的优点。近年来研究[7-9]表明:APS 在对肿瘤耐药性方面也有一定作用。 本研究结果也表明: 无毒剂量APS(100 mg·L-1) 联 合DDP 对A549/ DDP 细 胞 的IC50值 为11.46 mg·L-1, 相 对 于DDP 单 药 对A549/DDP 细胞的IC50值(22.6 mg·L-1),其逆转耐药倍数为1.8 倍,说明无毒剂量APS (100 mg·L-1) 能够逆转A549/DDP 细胞的DDP 耐药性。细胞迁移检测结果亦表明:无毒的APS 与DDP 药物联用提高了DDP 药物对A549/DDP 细胞迁移的抑制作用,说明APS 能在一定程度上恢复耐药细胞A549/DDP 对DDP 的 敏 感 性。

图6 流式细胞术检测各组A549/DDP 细胞线粒体膜电位Fig.6 Mitochondrial membrane potentials of A549/DDP cells in various groups detected by flow cytometry
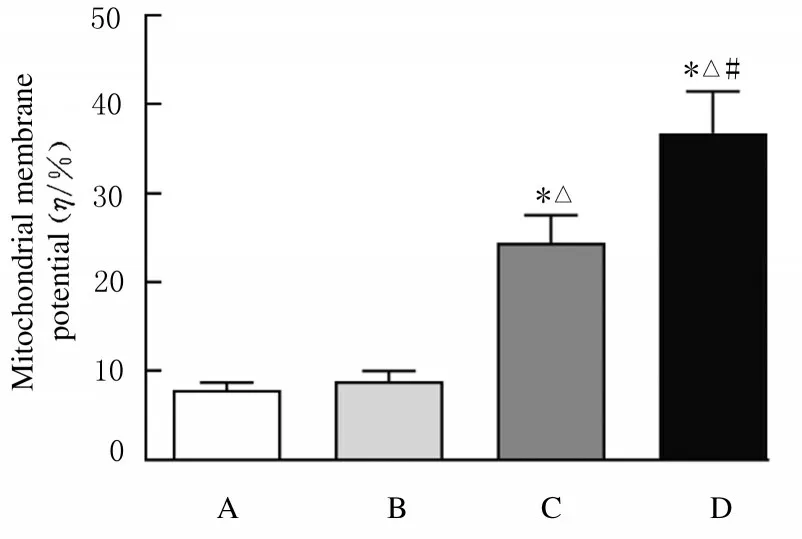
A:Control group;B:APS group;C:DDP group;D:APS+DDP group.*P<0.05 vs control group;△P<0.05 vs APS group;#P<0.05 vs DDP group.
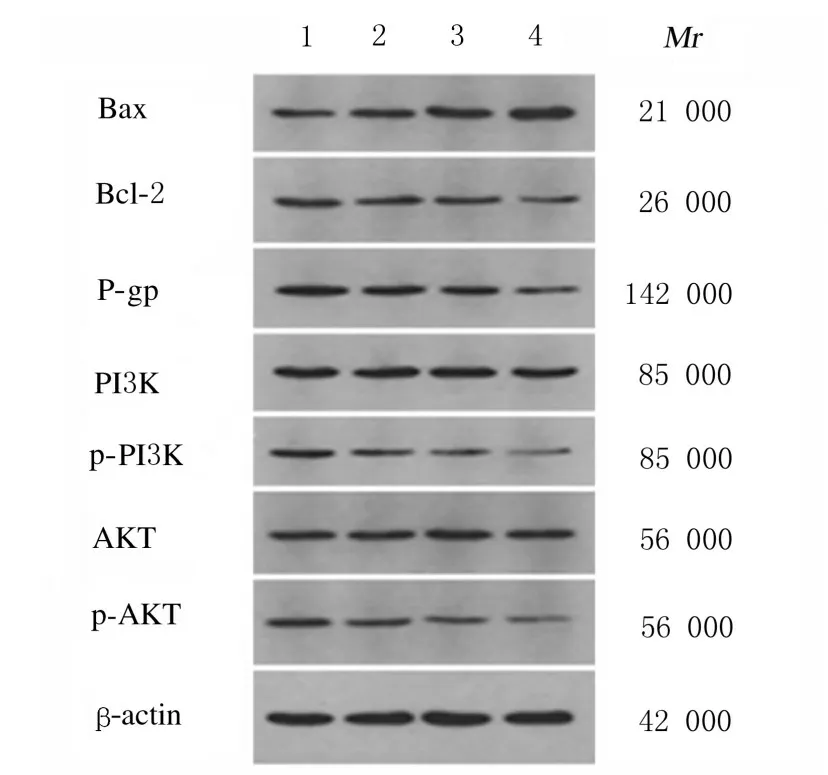
图8 各组A549/DDP 细胞中Bax、Bcl-2、P-gp、PI3K、AKT、p-PI3K 和p-AKT 蛋白表达电泳图Fig.8 Electrophoregram of expressions of Bax,Bcl-2,P -gp, PI3K, AKT, p -PI3K, and p -AKT proteins in A549/DDP cells in various groups
细胞凋亡是机体细胞在正常生理或病理状态下发生的一种由基因控制的自发的程序化死亡过程。细胞凋亡是主动过程,涉及一系列基因的激活、表达和调控等。细胞凋亡的发生受到机体的严密调控,许多抗癌药物都可以通过激活肿瘤细胞凋亡通路而达到抑制肿瘤生长的目的[14]。 近年来研究[15-16] 表明:肿瘤细胞的耐药性与肿瘤细胞的凋亡机制障碍关系密切,肿瘤细胞能通过凋亡逃逸,而介导肿瘤细胞产生耐药性。 本研究检测各组A549/DDP 细胞凋亡情况发现: 无毒浓度的APS联合DDP 作用于A549/DDP 细胞相对于DDP 单药能明显促进DDP 对A549/DDP 细胞的凋亡作用,表明APS 联合DDP 能重新激活A549/DDP 细胞凋亡通路。线粒体损伤造成线粒体膜电位下降是细胞凋亡的一个特征性的标志[17]。Bcl-2 基因家族中的促凋亡和抗凋亡分子之间的平衡性对细胞线粒体膜电位的稳定性有非常重要的作用, 其中Bcl-2 和Bax 对凋亡发生有着重要的“ 分子开关” 作用。Bax 位于细胞质中,当细胞受到凋亡信号刺激,其由细胞质转位到线粒体膜上,从而引发线粒体跨膜电位的丢失通过,开放分子通道进而使凋亡因子释放增多。Bcl-2 是线粒体上的一种跨膜蛋白,通过与Bax 结合形成二聚体,可稳定线粒体膜电位,抑制促凋亡因子释放从而起抗凋亡作用[18]。本研究结果显示:无毒浓度的APS 联合DDP 用药能明显降低细胞线粒体膜电位和Bcl-2 的表达并提高Bax表达,表明APS 逆转A549/DDP 耐药性可能与线粒体膜电位下降引起的凋亡有关联。
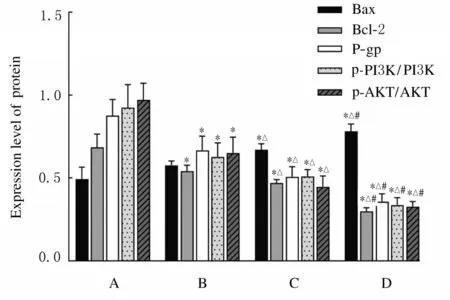
A:Control group;B:APS group;C:DDP group;D:APS+DDP group.*P<0.05 vs control group;△P<0.05 vs APS group;#P<0.05 vs DDP group.
PI3K/AKT 信号通路由PI3K 和AKT 等分子组成,与细胞的增殖、迁移和凋亡有关联[19]。PI3K/AKT 通路中PI3K 一般指Ⅰ类PI3K (PI3KC Ⅰ),其是由1 个催化亚基和调节亚基组成的异源二聚体,能够被蛋白酪氨酸激酶受体、RAS 蛋白等激活。活化后的PI3K 可产生脂质类产物磷脂酰肌醇- 3, 4, 5,三磷酸(phosphatidylinositol, 3, 4, 5 -trisphosphate,PIP3),PIP3 作 为 第 二 信 使 与AKT 蛋白的PH 结构域结合诱导其磷酸化从而活化AKT。P-gp 是一种高表达于耐药细胞膜上的跨膜转运蛋白,其能够将进入肿瘤细胞中的化疗药物转运至细胞外,从而降低细胞内化疗药物浓度,进而增加肿瘤 细 胞 耐 药 性[20]。 已 经 有 相 关 研 究[21]表 明:PI3K/AKT 信号通路与肿瘤多药耐药性的发生发展过程有密切关系,抑制PI3K/AKT 信号通路的异常激活可以降低肿瘤多药耐药性标志物P-gp 的表达从而介导肿瘤多药耐药性[22-23]。本研究结果显示:与DDP 组比较,DDP+APS 组A549/DDP 细胞中p-PI3K、p-AKT 和P-gp 蛋白表达水平明显降低, 说明APS 可能通过抑制肿瘤细胞中PI3K/AKT 信号通路而逆转P-gp 介导的DDP 耐药性。
综上所述, APS 可以降低A549/DDP 细胞耐药性,其机制可能与其阻断PI3K/AKT 信号通路和诱导线粒体凋亡途径有关联。

