氟唑菌酰胺在四川黄壤和紫色土上的吸附与解吸特性
向发椿 张清东 张思林 宁 萍 陈晓林 王立东
(1. 西南科技大学环境与资源学院 四川绵阳 621000; 2. 绵阳市农畜产品质量安全检验检测中心 四川绵阳 621000;3. 绵阳职业技术学院 四川绵阳 621000)
农药在土壤中的吸附-解吸行为被认为是农药在土壤-水环境中归宿的支配因素,而吸附容量的大小是农药在土壤中的迁移、转化及降解等环境行为的影响因素之一[1-2]。大量研究表明,土壤pH值、有机质含量、颗粒组成等土壤理化性质以及土壤类型对农药吸附、解吸均有影响[3-4]。探究农药在土壤中的吸附-解吸特性,将有助于制定科学合理的使用方法,提高使用安全性,有效预防、处理农药污染。
氟唑菌酰胺(Fluxapyroxad)由德国巴斯夫公司于2011年上市,属于琥珀酸脱氢酶抑制剂类广谱杀菌剂,并已在英国、法国、德国、美国、欧盟和中国等50个国家获得登记[5],用于70多种作物。
氟唑菌酰胺:CAS号907204-31-3;分子式C18H12F5N3O;分子量381.31 g·mol-1;溶解度(20 ℃)3.44 mg·L-1(pH=7.00);化学结构如图1所示。
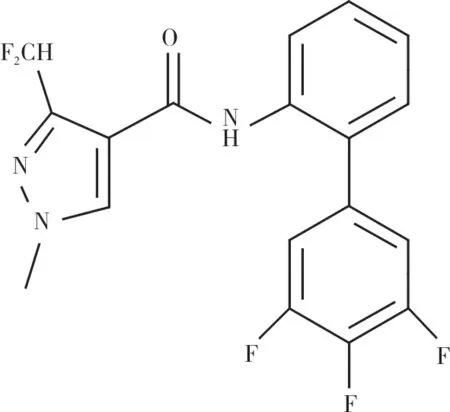
图1 氟唑菌酰胺化学结构式Fig.1 Chemical structure of fluxapyroxad
现阶段,有关氟唑菌酰胺的研究主要集中在防治效果、检测方法、消解及微生物效应[6-15]等方面,关于其环境行为方面的研究鲜有报道。在土壤上的吸附与解吸作用是氟唑菌酰胺在土壤中最重要的环境化学过程,影响其生物有效性和环境毒性。LI等[12]研究不同土壤和水/沉积物系统中氟唑菌酰胺的持久性和归趋性,结果表明有机质含量高、含氧量高、pH值中性实验条件下,氟唑菌酰胺更易消解,且具有较高的持久性。刘艳萍等[13]、路彩红等[14]、李忠华等[15]分别探究了氟唑菌酰胺在芒果、水稻和土壤、人参中的消解动态。
本文以四川常见的黄壤和紫色土为代表,研究土壤对氟唑菌酰胺的吸附-解吸过程,旨在为氟唑菌酰胺在土壤环境中的安全风险评价提供基础数据。
1 实验
1.1 仪器与试剂
LC-16高效液相色谱仪,日本岛津公司;BS210S电子天平(精确至0.000 1 g),德国Sartorius公司;AS10200B超声清洗器,天津奥特赛恩斯仪器有限公司;Milli-Q超纯水制备系统,密理博中国有限公司;WX-80A涡旋混合仪,海门市其林贝尔仪器制造有限公司;JHD-12E氮吹仪,上海极恒实业有限公司;SHZ-82恒温水浴振荡器,常州市金坛新航仪器厂;SIGM-3-18K高速冷冻离心机,西格玛奥德里奇(上海)贸易有限公司。
氟唑菌酰胺标准品(质量分数≥99.0%),德国Dr.Ehrensorfer公司;乙腈(色谱纯)、丙酮(色谱纯),赛默飞世尔科技有限公司;无水氯化钙(分析纯)、叠氮化钠(分析纯),成都市科龙化工试剂厂。试验用水由Milli-Q超纯水净化器制备。
1.2 供试土壤
试验用土壤采自绵阳。土壤样品根据“五点取样法”在耕层0~20 cm取样,置于室温自然风干,剔除杂质,粉碎过1 mm筛,通过四分法取样,并保存于聚乙烯塑料封口袋中待用。样品理化性质见表1。

表1 土壤理化性质Table 1 Soil characterization properties
1.3 吸附解吸实验
采用振荡平衡法(USEPA,1975)对氟唑菌酰胺在2种土壤上的吸附行为进行研究。
1.3.1 溶液配制
用乙腈配置成1 g·L-1的氟唑菌酰胺标准储备液,置于4 ℃冰箱保存,备用。
配置0.01 mol·L-1的CaCl2-NaN3溶液(加入CaCl2作为背景电解质,加入NaN3抑制土壤中细菌活动,CaCl2和NaN3浓度均为0.01 mol·L-1)备用。
1.3.2 吸附动力学试验
按固液比(土壤质量与溶液体积的比值,g/mL)为1∶5加入5 mg·L-1的氟唑菌酰胺CaCl2-NaN3溶液,加盖密封后置于恒温水浴振荡器上于25±2 ℃条件下振荡,按照平行法,于吸附时间0,0.5,1,3,7,12,18,24 h取样测定氟唑菌酰胺。
1.3.3 吸附、解吸等温试验
(1)固定固液比为1∶5加入不同浓度的氟唑菌酰胺CaCl2-NaN3溶液,氟唑菌酰胺浓度分别为0.50,1.00,2.00,5.00,10.00和20.00 mg·L-1;(2)按固液比1∶5,1∶10,1∶20和1∶50分别加入5 mg·L-1的氟唑菌酰胺CaCl2-NaN3溶液;(3)前述溶液加盖密封后置于恒温水浴振荡器上于25±1 ℃条件下避光振荡24 h,4 000 r/min的转速离心10 min,取上清液过0.22 μm水性滤膜,用HPLC测定溶液中氟唑菌酰胺浓度,每个处理重复3次,同时设置未加土壤的对照处理。
吸附平衡后将实验处理离心,弃上清,加入同体积CaCl2-NaN3溶液,作解吸试验,平衡及前处理如前所述。
1.3.4 吸附热力学试验
按固液比为1∶5加入0.5 mg·L-1的氟唑菌酰胺CaCl2-NaN3溶液,加盖密封后置于恒温水浴振荡器上于25,35,45 ℃条件下振荡24 h。后续操作同1.3.3。
1.4 分析方法
1.4.1 前处理方法[11]
水样:样品直接过0.22 μm膜,上机检测。
土壤:将待测土壤样品按(土壤质量∶溶剂体积,g/mL)1∶2比例加入丙酮,超声提取5 min,4 000 r/min 离心分离5 min,收集上层清液,再加入同样体积的丙酮,重复上述操作两次,合并清液,氮气吹干,用1 mL乙腈定容,过0.22 μm滤膜,待测。
1.4.2 分析方法[10]
WondaSil®-C18液相色谱柱4.6 mm×250 mm×5 μm,检测波长:230 nm,流动相:乙腈-水(80+20,V/V),流速:1.0 mL·min-1,进样量:5 μL,柱温:35 ℃。
1.5 数据处理
1.5.1 吸附动力学方程
在土壤中的吸附动力学曲线采用准二级动力学方程拟合[16]:
(1)
式中:Ce为氟唑菌酰胺在土壤中的吸附量(mg·kg-1);Ct为t时刻氟唑菌酰胺在土壤中的吸附量(mg·kg-1);K2为准二级吸附率常数[kg·(mg·h)-1]。
1.5.2 等温吸附模型[16-17]
Freundlich模型方程:
Cs=Kf×Caq1/n
(2)
式中:Cs为吸附或解吸附平衡时土壤中氟唑菌酰胺的吸附量(mg/kg);Caq为吸附或解吸附平衡时溶液中氟唑菌酰胺浓度(mg/L);Kf,n为Freundlich常数(吸附过程分别设为Kf-ads及nads,解吸附过程分别设为Kf-des及ndes)。
线性分配模型:
Cs=Kd×Ce
(3)
式中:Kd为分配常数。有机质(OM)对农药吸附影响很大,Kd可与土壤中有机质含量ωOM(%)进行换算,得到有机质吸附常数(KOM)。
(4)
1.5.3 吸附扩散模型[18]
氟唑菌酰胺在土壤中的吸附扩散用Weber-Morris模型描述。
(5)
式中:C为涉及到厚度、边界层的常数;KWM为内扩散率常数。
1.5.4 吸附热力学[19]
(1)吸附自由能(ΔG)。运用吉布斯自由能方程分析温度对氟唑菌酰胺吸附行为的影响:
ΔG=-R×T×lnKf
(6)
式中:R为气体摩尔常数,8.314×10-3kJ·mol-1;T为绝对温度,K。
(2)吸附焓(ΔH)、吸附熵变(ΔS)。由Gibbs-Helmholtz方程可计算吸附焓和吸附熵变:
(7)
(8)
(3)活化能(Ea)。吸附所需的活化能由Arrhenius公式求得:
(9)
式中:K0为与温度有关的常数;Ea为吸附活化能。
1.5.5 滞后系数H[20]
氟唑菌酰胺在土壤中是否存在滞后现象可用滞后系数H描述:
(10)
式中:H为滞后系数;1/nads为吸附经验常数;1/ndes为解吸经验常数。
1.5.6 加标回收
土壤中添加量为1.0,5.0,10.0 mg·kg-1时,氟唑菌酰胺的平均回收率为81.76%~100.45%,相对标准偏差为0.71%~4.27%。水中添加量为0.1,0.5,1.0 mg·L-1时,氟唑菌酰胺平均回收率为81.21%~84.06%,相对标准偏差为0.38%~0.85%。检测分析方法准确度及精密度符合农药残留分析试验的要求[21]。
2 结果与讨论
2.1 固液比对土壤吸附氟唑菌酰胺的影响
由表2结果可知,随着固液比增大,氟唑菌酰胺在2种土壤的吸附率增大。固液比增大,黄壤对氟唑菌酰胺吸附率可由49.35%±1.08%升至83.45%±2.01%,紫色土对氟唑菌酰胺吸附率可由16.74%±0.95%升至58.25%±1.24%,表明固液比是影响氟唑菌酰胺在土壤中吸附的因素之一。相同固液比条件下,黄壤吸附率大于紫色土。随着固液比增大,吸附位点数量增加,从而增加了氟唑菌酰胺与吸附位点的接触,增强了土壤对氟唑菌酰胺的吸附。而固液比偏小,溶液越不易形成悬浮状态,不利于吸附进行[18]。

表2 不同固液比下氟唑菌酰胺在2种土壤上的吸附率(n=3)Table 2 Sorption rates of fluxapyroxad on two soils with different soil/solution ratios (n=3)
2.2 初始浓度对土壤吸附氟唑菌酰胺的影响
由图2可知,随着初始浓度的增加,氟唑菌酰胺在 2 种土壤中的吸附量逐渐增大,吸附率呈先减少后平衡趋势。初始浓度由 0.5 mg·L-1增加至20 mg·L-1过程中,黄壤对氟唑菌酰胺的吸附量由1.77 mg·kg-1增大到58.43 mg·kg-1,吸附量增大了33.10倍,而其吸附率则由70.80%降低到50%左右趋于稳定;紫色土对氟唑菌酰胺的吸附量由1.23 mg·kg-1增大到39.41 mg·kg-1,吸附量增大了32.17倍,而其吸附率则由48.96%降低到25%左右趋于稳定。
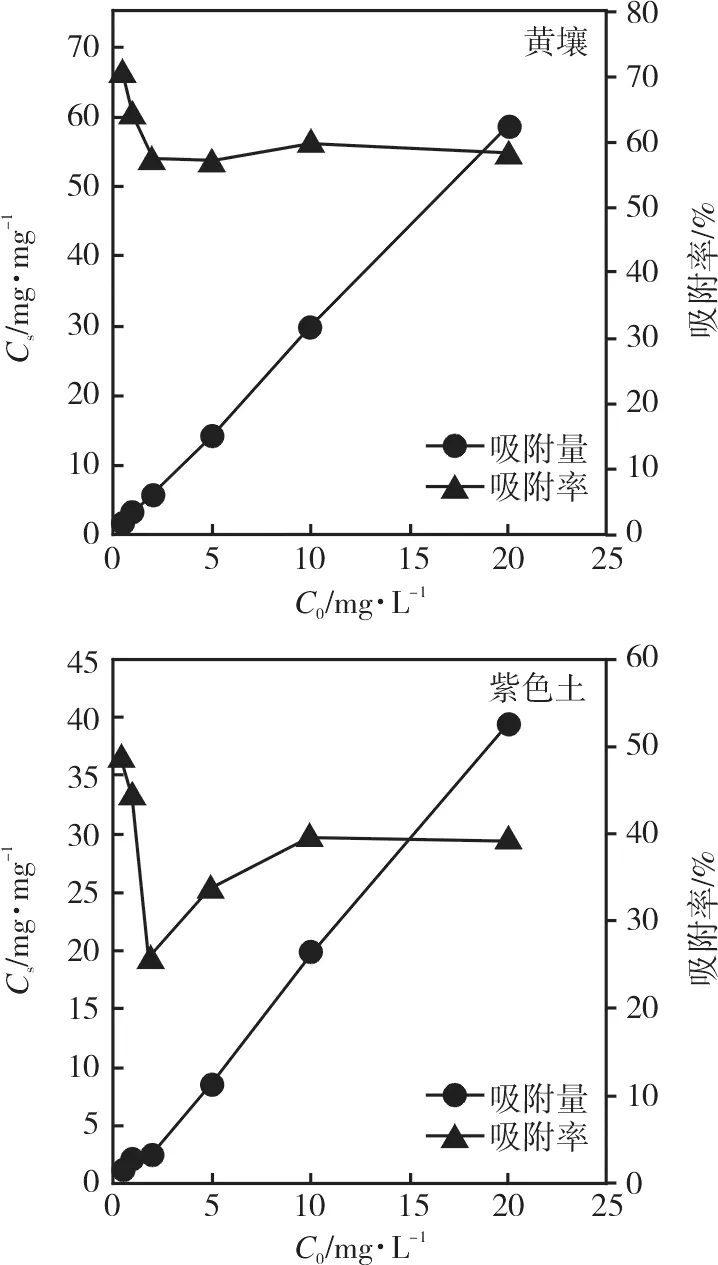
图2 初始浓度对氟唑菌酰胺在土壤中吸附的影响Fig.2 Effect of initial concentration on the sorption of fluxapyroxad on two soils
氟唑菌酰胺的初始浓度是影响其在土壤中吸附的重要因素之一。初始浓度增大促进了土壤对氟唑菌酰胺吸附,这是由于氟唑菌酰胺浓度的增加,吸附位点附近的浓度差随之增大,从而增加了氟唑菌酰胺与吸附位点的接触,增强了传质作用;但吸附率随着初始浓度增加显著下降,这可能是因为单位吸附质的吸附位点有限。初始浓度增大时,虽然增加了氟唑菌酰胺与吸附位点的接触机会,但单位吸附质的吸附位点有限。在2种土壤中的吸附量变化趋势存在差异,这可能与土壤的理化性质差异有关。
2.3 氟唑菌酰胺在土壤中的吸附动力学
在固液比1∶5,浓度为0.5 mg·L-1时,氟唑菌酰胺在黄壤和紫色土上吸附动力学如图3所示。氟唑菌酰胺在2种土壤中的吸附量呈先快速上升后缓慢趋于稳定的趋势。在0~7 h内吸附量快速上升后逐渐变慢,至12 h时吸附量趋于稳定,分别为 1.72,1.16 mg·kg-1。综合考虑,本研究选择以24 h为吸附平衡时间。采用准二阶动力学方程进行拟合分析,拟合情况如表3所示。R2分别为0.992 6,0.994 6,表明准二阶动力学方程能较好地拟合氟唑菌酰胺在2种土壤中的吸附变化情况。
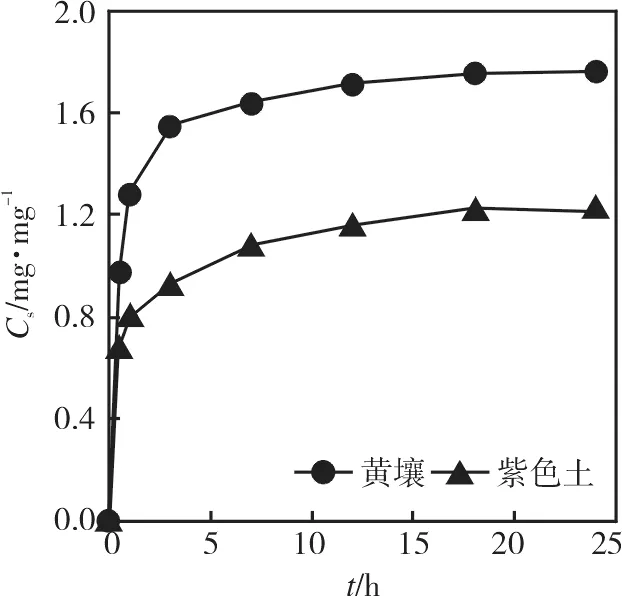
图3 氟唑菌酰胺在2种土壤上的吸附动力学曲线Fig.3 Sorption kinetics curves of fluxapyroxad on two soils
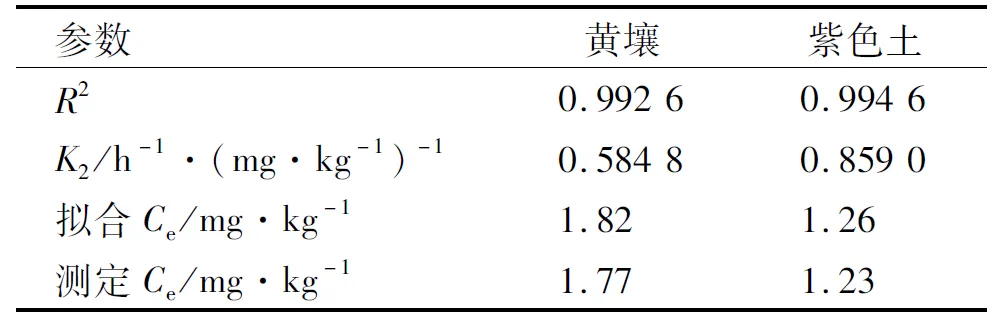
表3 氟唑菌酰胺在2种不同土壤上的准二级动力学拟合参数Table 3 Pseudo-second-order kinetic fitting parameters of fluxapyroxad on two soils
为探究氟唑菌酰胺在土壤中的扩散机制,本文应用Weber-Morris模型对实验数据进行拟合,拟合Cs-t1/2曲线如图4所示。
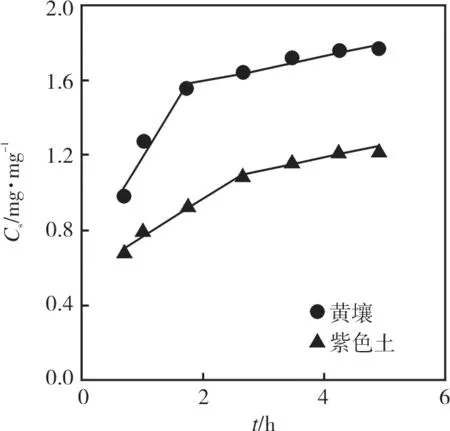
图4 2种土壤上氟唑菌酰胺的Cs-t1/2曲线Fig.4 Cs-t1/2 curves of fluxapyroxad on two soils
图4表明,氟唑菌酰胺在2种土壤中的Weber-Morris模型拟合呈现出多段线性,表明氟唑菌酰胺吸附过程分为多个阶段。结合表4可知,第一阶段拟合斜率(KWM-1)为0.530,0.195 mg·kg-1·h-0.5,第二阶段拟合斜率(KWM-2)为 0.068 7,0.065 2 mg·kg-1·h-0.5,表明氟唑菌酰胺吸附过程可分为溶液-土壤颗粒表面的快速扩散阶段和土壤颗粒表面-内部的慢扩散阶段,且内部扩散是吸附速率的控制步骤。第一阶段斜率差异较大,表明此阶段扩散速率可能与土壤理化性质有关,第二阶段斜率接近,表明内部扩散影响因素具有一致性。C值越大表示边界层对吸附影响越大。在两种土壤中第二阶段C值均大于第一阶段,表明土壤外表面-内部扩散传质阻碍更大。
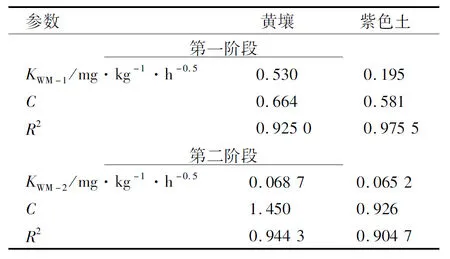
表4 2种土壤上Weber-Morris模型拟合参数Table 4 Fitting parameters of Weber-Morris model on two soils
结合动力学及扩散方程可知,反应最开始阶段溶液中有较高浓度的氟唑菌酰胺,溶液-土壤表面间的浓度差使吸附位点能够快速吸附,而随着吸附时间的增加,表面吸附位点逐渐减少,吸附速率下降;表面被吸附的氟唑菌酰胺向土壤内部结构迁移和扩散,在此阶段传质阻碍更大,导致吸附速率快速降低,但至吸附位点全部占据之前,吸附仍会缓慢进行。在两种土壤上存在扩散速率黄壤>紫色土的趋势,这可能与土壤理化性质的差异有关。
2.4 氟唑菌酰胺在土壤中的吸附-解吸特性
吸附等温线可用于了解氟唑菌酰胺与土壤之间的相互作用,并揭示其吸附机制。氟唑菌酰胺在2种土壤中的吸附、解吸等温线如图5所示。

图5 氟唑菌酰胺在土壤中的吸附等温线Fig.5 Sorption isotherms of fluxapyroxad on soils
氟唑菌酰胺在2种土壤中吸附等温线模型拟合如表5所示。
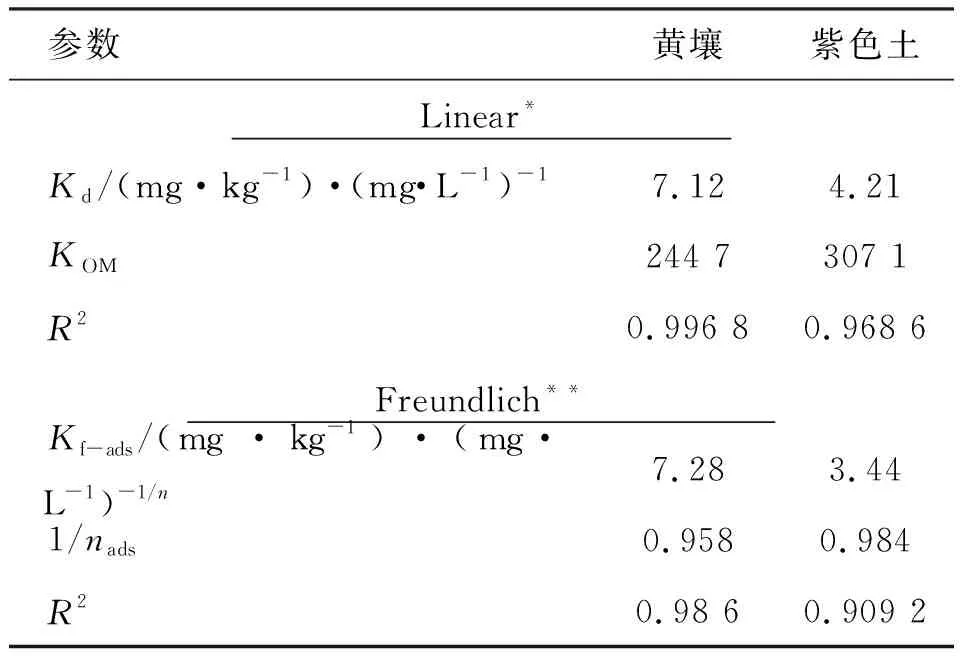
表5 氟唑菌酰胺在土壤上吸附的Linear和Fruendlich模型Table 5 Regression parameters of Linear and Freundlich models for the sorption isotherms of fluxapyroxad on soils
氟唑菌酰胺在黄壤和紫色土中的1/nads值分别为0.958,0.984,均接近于1,表明在实验浓度范围内在土壤上的吸附以分配作用为主。黄壤对氟唑菌酰胺的吸附截留能力显著高于紫色土。黄壤的分配系数Kd为7.12(mg·kg-1)·(mg·L-1)-1,远大于紫色土的分配系数4.21 (mg·kg-1)·(mg·L-1)-1。结合表1可知黄壤的有机质含量大于紫色土的有机质含量,这可能是导致氟唑菌酰胺分配差异的影响因素。尽管两种土壤吸附性能上差异显著,但其有机质标化分配系数却基本相当,这表明2种土壤的主要吸附位点均为土壤有机质。
一般认为,如果滞后系数H=1,表明不存在迟滞解吸现象;如果滞后系数H<1,表示存在正迟滞现象,说明吸附质不易从吸附剂中解吸出来;而当滞后系数H>1,表示发生了负迟滞现象,说明吸附质易从吸附剂中解吸出来。氟唑菌酰胺在2种土壤上的解吸常数和滞后系数H如表6所示。

表6 氟唑菌酰胺在土壤上解吸的Fruendlich模型Table 6 Regression parameters of Freundlich models for the desorption isotherms of fluxapyroxad on soils
氟唑菌酰胺在黄壤和紫色土上的解吸过程均符合Freundlich模型,R2为0.980 5,0.926 1,Kf-des值分别为9.17,6.42 (mg·kg-1)·(mg·L-1)-1/n,表明氟唑菌酰胺在黄壤的解吸能力更强。农药的解吸过程决定了其在土壤中的流动和释放行为。由表6可知,氟唑菌酰胺在2种土壤中的滞后系数均趋近于1,表明氟唑菌酰胺在2种土壤中存在滞后效应较小,而其在黄壤中容易被解吸附,这与吸附结论一致。
土壤是一个多组分非均质的混合物,进入土壤环境的农药可以通过物理吸附、化学吸附、氢键结合和配位价键结合等形式吸附在介质表面,因此可很大程度地影响农药的环境行为[1-4]。农药的吸附解吸附过程决定了农药在土壤中的释放速率和潜在的流动性。研究表明氟唑菌酰胺在土壤中的降解半衰期大于157.6 d[12]。氟唑菌酰胺在四川2种典型土壤上的吸附-解吸特性,为其合理使用及土壤环境中的安全风险评价提供了一定的理论依据。
2.5 氟唑菌酰胺在土壤中的热力学特性
土壤具有多组分非均质的性质,农药可以通过物理吸附、化学吸附、氢键结合和配位价键结合等形式吸附在土壤表面,吸附热力学参数可以表明农药在土壤中的吸附方式。根据1.5.4计算出土壤吸附氟唑菌酰胺的热力学参数ΔG,ΔH,ΔS,Ea,结果如表7所示。
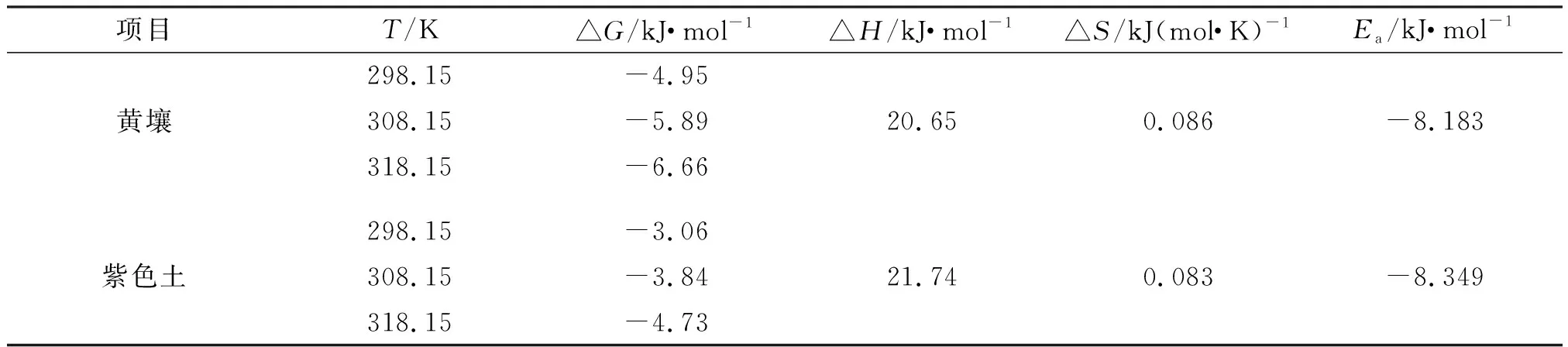
表7 吸附热力学参数Table 7 Sorption thermodynamic parameters
两种土壤对氟唑菌酰胺的吸附均是一个吸热过程(吸附焓ΔH>0),升高温度有利于吸附的进行,吸附过程自发进行(吸附自由能△G<0),并伴随着吸附熵(△S>0)的增加。
氟唑菌酰胺在黄壤和紫色土中的活化能Ea绝对值分别为8.183,8.349 kJ·mol-1,而化学吸附活化能一般需大于40 kJ·mol-1,表明氟唑菌酰胺在土壤中的吸附过程主要以物理吸附为主。
3 结论
(1)固液比和初始浓度均是影响氟唑菌酰胺在土壤中吸附的重要因素。随着固液比增大,氟唑菌酰胺在2种土壤的吸附率增大。随着初始浓度增大,氟唑菌酰胺在土壤上的吸附量逐渐增大,吸附率先减少后趋于平衡。
(2)氟唑菌酰胺在黄壤和紫色土上的吸附过程均能较好拟合准二阶动力学模型(R2>0.99)。吸附过程中颗粒外扩散速率大于颗粒内部扩散,且内部扩散是吸附速率的控制步骤。
(3)通过Linear和Fruendlich模型拟合,实验浓度范围内在2种土壤上的吸附以分配作用为主,黄壤对氟唑菌酰胺的吸附截留能力高于紫色土,而两者有机质吸附常数基本相当,表明2种土壤的主要吸附位点均为土壤有机质。解吸过程中,2种土壤滞后系数均趋近于1,表明滞后效应较小,而黄壤解吸能力大于紫色土,这与其吸附主要为分配作用有关。
(4)氟唑菌酰胺在土壤中的吸附过程是一个自发的吸热过程,且伴随熵增,以物理吸附为主。

