绿豆抗氧化肽的酶法制备及其抗氧化活性
夏吉安, 黄 凯, 李 森, 宋洪东, 管 骁
(上海理工大学 医疗器械与食品学院,上海200093)
抗氧化性的多肽属于天然抗氧化物,安全性高,可作为添加剂或者食品原料广泛应用于食品和药品的生产中,具有较广阔的发展前景[1-5]。
绿豆是一种在世界各地广泛种植的豆科类植物,在我国有着悠久的种植历史[6]。绿豆富含碳水化合物、蛋白质、矿物质和多种维生素,其蛋白质质量分数高达19.5%~33.1%,是蛋白质的良好来源[4]。绿豆蛋白主要包含球蛋白、清蛋白、醇溶蛋白以及谷蛋白,其中球蛋白和清蛋白含量最多。绿豆蛋白质是由17种氨基酸构成,其中包括7种必需氨基酸[7]。绿豆肽是通过酶水解绿豆蛋白获得的寡肽混合物,绿豆肽比绿豆蛋白具有更高的溶解度和吸水性,更低的黏度和更高的流动性。此外,绿豆肽还包含多种生物活性成分[8-9]。我国绿豆资源丰富,但是精深加工程度低,主要集中在绿豆淀粉的加工生产方面,绿豆蛋白则是绿豆淀粉加工过程中的废弃物,其利用程度较低。使用酶解技术对绿豆蛋白进行深度开发,制备具有抗氧化活性的绿豆多肽是提高绿豆资源利用率的有效途径[10]。
作者以绿豆蛋白为原料,选取中性蛋白酶、碱性蛋白酶、胰蛋白酶、胃蛋白酶以及中性蛋白酶与碱性蛋白酶复合,在不同酶解时间和加酶量的条件下对绿豆蛋白进行酶解,得到绿豆抗氧化肽,并对其抗氧化活性进行测定。最后,以凝胶过滤层析法分离纯化最优酶解条件下得到的酶解液,根据测定得到的体外抗氧化指标,挑选出抗氧化性能最优的组分,为绿豆抗氧化肽在天然抗氧化剂和保健食品领域的应用提供了理论依据。
1 材料与方法
1.1 材料与设备
绿豆蛋白粉:购于陕西双瑞生物科技有限公司;碱性蛋白酶(200 000 U/g):购于西亚化学技术有限公司;DPPH、中性蛋白酶(100 000 U/g):购于上海维塔化学试剂有限公司;胰蛋白酶(50 000 U/g)、胃蛋白酶(1 200 U/g):购于上海沪试化工有限公司;BCA蛋白浓度试剂盒:购于碧云天生物技术有限公司;氢氧化钠、铁氰化钾、无水三氯化铁、三氯乙酸、硫酸亚铁铵、盐酸、无水乙醇等试剂均为分析纯试剂。
Synergy HTX多功能微孔板检测仪:美国伯腾仪器有限公司产品;HimacCR22N高速冷冻离心机:天美(中国)科学仪器有限公司产品;低温恒温槽:上海衡平仪器仪表厂产品;FE20 pH计、ME204E电子天平:梅特勒-托利多仪器(上海)有限公司产品;酶反应器:上海垒固仪器有限公司产品;IKARO5多点磁力搅拌器:艾卡仪器设备有限公司产品。
1.2 实验方法
1.2.1 绿豆蛋白酶解液的制备方法 配制底物质量分数为3%的绿豆蛋白溶液。用0.5 mol/L氢氧化钠溶液与盐酸溶液调节绿豆蛋白溶液的pH至蛋白酶的最适pH。称取蛋白酶(加酶量为质量分数6%)加入绿豆蛋白溶液中,酶反应器的温度设定为该蛋白酶的最适温度。使用0.5 mol/L氢氧化钠溶液与盐酸溶液调节pH值,使得整个酶解过程中酶解液的pH始终在蛋白酶的最适pH区域。持续酶解3 h后,沸水浴10 min灭酶。将酶解液冷却至室温,置于低温离心机中8 000 r/min离心10 min,取上清液即得到绿豆蛋白酶解液。
1.2.2 不同蛋白酶对绿豆蛋白酶解效果的影响选用中性蛋白酶、碱性蛋白酶、胰蛋白酶、胃蛋白酶分别在各种蛋白酶的最适温度、pH条件下对绿豆蛋白进行酶解,酶解时间为3 h,通过测定酶解产物抗氧化活性来选取合适的蛋白酶。
1.2.3 组合酶对绿豆蛋白酶解效果的影响 分别配制5份底物质量分数为3%的绿豆蛋白溶液,样品从1—5编号。1号样品为中性蛋白酶单酶水解4 h;2号样品为中性蛋白酶水解3 h后碱性蛋白酶水解1 h;3号样品为中性蛋白酶水解2 h后碱性蛋白酶水解2 h;4号样品为中性蛋白酶水解1 h后碱性蛋白酶水解3 h;5号样品为碱性蛋白酶单酶水解4 h。添加中性蛋白酶时调节pH至7,灭酶后再添加碱性蛋白酶时调节pH为8,在1—4号样品中加入中性蛋白酶(加酶量为质量分数6%),在5号样品中加入碱性蛋白酶(加酶量为质量分数6%),于50℃下酶解。1天后,将4号样品取出沸水浴灭酶,再加入碱性蛋白酶继续酶解,后续操作类似。整个酶解过程为4 h,使用0.5 mol/L氢氧化钠溶液与盐酸溶液调节pH值,使得整个酶解过程中酶解液的pH始终为蛋白酶的最适pH。酶解结束后,将所有样品灭酶,离心,取上清液测其体外抗氧化指标[11]。
1.2.4 不同酶解时间对绿豆蛋白酶解效果的影响质量分数3%的绿豆蛋白溶液在加酶量为质量分数6%、温度50℃、pH 7的条件下,分别水解0.5、1.0、1.5、2.0、3.0、4.0 h后,取出30 mL酶解液,沸水浴灭酶10 min,再将样品冷却至室温,8 000 r/min离心10 min,取上清液,测其体外抗氧化指标[12]。
1.2.5 不同酶用量对绿豆蛋白酶解效果的影响质量分数3%的绿豆蛋白溶液在水解温度50℃、pH为7.0、酶用量分别质量分数为2%、4%、6%、8%、10%的条件下,水解3 h,沸水浴灭酶10 min,再将样品冷却至室温,8 000 r/min离心10 min,取上清液,测其体外抗氧化指标[13]。
1.2.6 绿豆蛋白酶解液的分离纯化 采用凝胶过滤层析法对绿豆蛋白酶解液(酶解条件:中性蛋白酶质量分数2%、底物质量分数为3%、温度50℃、pH 7.0、水解3 h)进行分离纯化。选用SephadexG-25填料,将处理好的填料装入层析柱中。凝胶柱通过预处理、装柱、平衡后,缓慢加入经0.45μm超滤膜过滤后的样品,样品质量浓度为100 mg/mL,进样量为3 mL。洗脱液为去离子水,洗脱流量控制在0.7 mL/min,每10分钟收集一管,紫外检测波长220 nm,收集各峰处的洗脱液后浓缩,测定蛋白质浓度以及体外抗氧化指标[14]。
1.2.7 DPPH自由基清除能力的测定 用无水乙醇配置0.1 mmol/L的DPPH溶液,避光保存。将1 mL测试样品溶液加入到1 mL DPPH溶液中,混匀,室温下避光静置30 min后在517 nm处测定其吸光度,同时测定1 mL DPPH溶液与1 mL乙醇混合后的吸光度,以及1 mL测试样品溶液与1 mL无水乙醇混合后的吸光度,计算清除率[15]。
1.2.8 还原能力的测定 取0.4 mL样品和1 mL PBS(pH 6.6,0.2 moL/L)以及1 mL质量分数为1%铁氰化钾溶液混合,50℃水浴20 min,冷却后加1 mL质量分数为10%三氯乙酸溶液混匀,静置15 min。取1 mL上清液,加入0.2 mL质量分数为0.1%三氯化铁溶液和1 mL去离子水。10 min后,把样品吸入96孔板中,在700 nm处测吸光度,吸光度值越高,则还原能力越强[16]。
1.2.9 羟基(OH)自由基清除能力的测定 采用Fenton反应法,取1 mL样品溶液分别加入1 mL 2 mmol/L硫酸亚铁溶液、1 mL 6 mmol/L水杨酸溶液以及1 mL 6 mmol/L过氧化氢溶液,混匀,于510 nm处测定吸光度,用去离子水代替样品溶液测定吸光度,用去离子水代替过氧化氢溶液测定吸光度,计算清除率[17]。
1.3 数据处理
每组实验重复3次,实验结果分析取平均值±标准差。采用GraphPad Prism 17.0进行绘图。
2 结果与分析
2.1 蛋白酶的选择
选用中性蛋白酶(反应温度50℃,pH 7)、碱性蛋白酶(反应温度50℃,pH 8)、胰蛋白酶(反应温度50℃,pH 8)、胃蛋白酶(反应温度37℃,pH 2)4种蛋白酶酶解绿豆蛋白,酶解时间为3 h,酶用量为质量分数6%,测定酶解产物的体外抗氧化活性图1(a)为各蛋白酶酶解产物的DPPH自由基清除率,由图可以看出各蛋白酶酶解产物的DPPH自由基清除率均高于未经过酶解的绿豆蛋白溶液,其中中性蛋白酶酶解产物的清除率明显高于其他3种蛋白酶的酶解产物,并且可以看出DPPH自由基清除率与酶解产物的浓度呈正相关性。随着酶解产物浓度的增大,DPPH自由基清除率逐步增大,抗氧化能力越强。图1(b)为各酶解产物的还原能力,与DPPH自由基清除率相同,各蛋白酶酶解产物的还原能力均高于未经过酶解的绿豆蛋白液,其中中性蛋白酶酶解产物的还原能力略高于其他3种蛋白酶的酶解产物。同样可以看出,还原能力与酶解产物的浓度也呈正相关。随着酶解产物浓度的增大,吸光度值越高,抗氧化能力越强。
选用中性蛋白酶与碱性蛋白酶组合酶解绿豆蛋白,测定酶解产物的抗氧化能力。图2(a)为酶解产物的DPPH自由基清除率,由结果可知,中性蛋白酶酶解产物的DPPH自由基清除率明显高于组合酶以及碱性蛋白酶酶解的产物,且随着中性蛋白酶酶解时间减少以及碱性蛋白酶的酶解时间增加,清除率呈下降趋势。图2(b)为酶解产物的还原能力,中性蛋白酶酶解产物的还原能力与组合酶相当,略高于碱性蛋白酶酶解的产物。
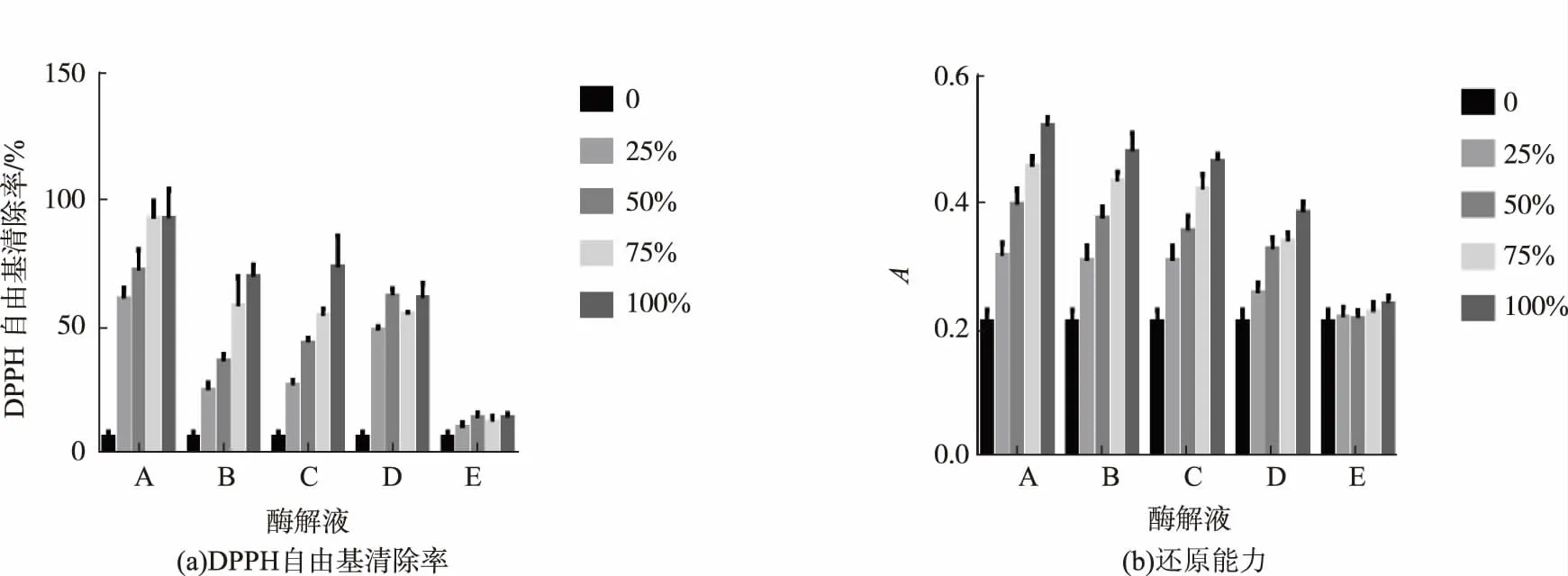
图1 不同蛋白酶酶解绿豆蛋白产物的抗氧化能力Fig.1 Antioxidant ability of different proteases to enzymolysis mung bean protein products
综合各蛋白酶以及组合酶酶解绿豆蛋白产物的抗氧化能力来看,中性蛋白酶酶解产物的抗氧化效果最好,可作为制备绿豆抗氧化肽的最优蛋白酶。此结果也与李琴等人的实验结果相符[13]。
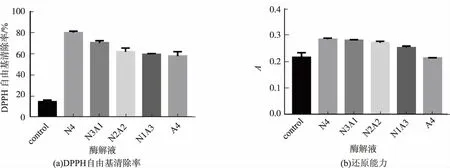
图2 组合酶酶解绿豆蛋白产物的抗氧化能力Fig.2 Antioxidant ability of combined enzymes to enzymolysis mung bean protein products
2.2 酶解时间的选择
底物质量分数3%的绿豆蛋白在加酶量质量分数6%(中性蛋白酶)、温度50℃、pH 7的条件下,分别酶解0.5、1.0、1.5、2.0、3.0、4.0 h后,灭酶取上清液后测其抗氧化指标。从图3(a)中可以看出,随着酶解时间的增加,酶解产物的DPPH清除率呈现出先增长后减缓的趋势,并在3 h处达到清除率的顶峰。从图3(b)中可以发现,酶解产物的还原能力相差不大,3 h处的还原能力略高于其他时间。分析原因可能是,酶解时间不足3 h时,水解不够充分,当酶解时间超过3 h时,水解过度,绿豆蛋白被水解成了抗氧化活性较差的寡肽或者游离氨基酸,因而水解产物的抗氧化活性降低。所以选择酶解时间为3 h。
2.3 加酶量的选择
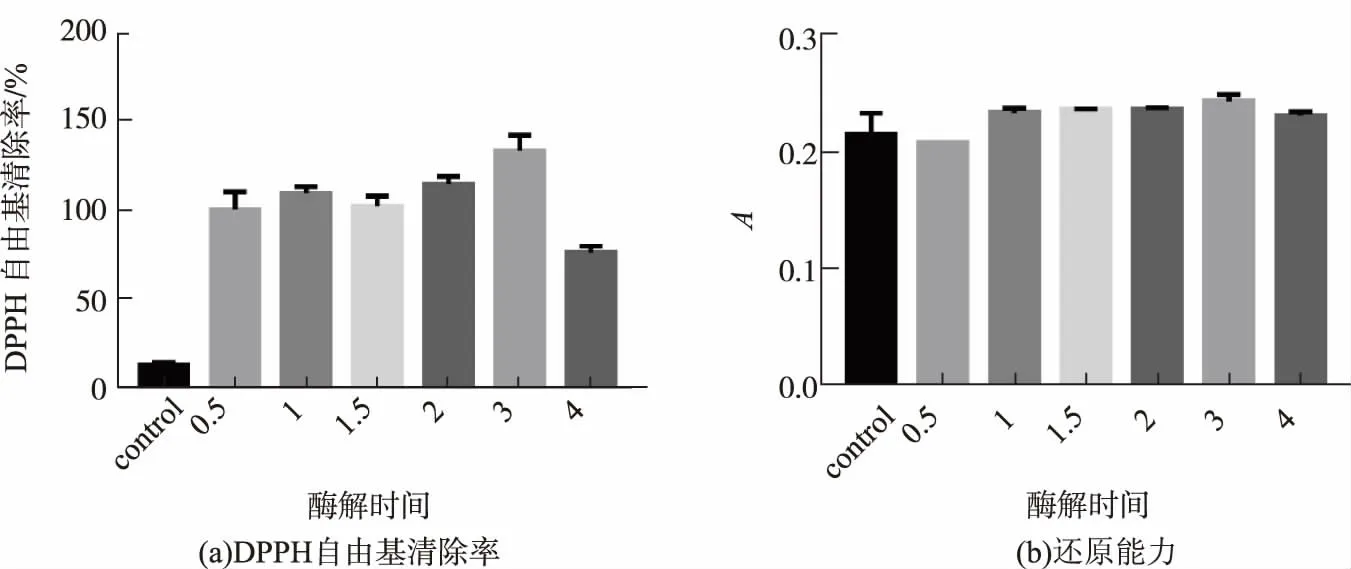
图3 不同酶解时间绿豆蛋白酶解产物的抗氧化能力Fig.3 Antioxidant ability of mung bean proteolysis products with different enzymatic time
底物质量分数3%的绿豆蛋白在水解温度50℃、pH 7、中性蛋白酶加酶量(质量分数)分别为2%、4%、6%、8%、10%的条件下,水解3 h,然后灭酶,离心取上清液,测体外抗氧化指标。图4(a)为DPPH自由基清除率,随着酶用量的增大,清除率先减小后缓慢增加,加酶量为质量分数2%时DPPH自由基清除率为最大值。图4(c)为羟基自由基清除率,与DPPH自由基清除率变化相同,也是随着酶用量的增大,清除率先减小后缓慢增大,加酶量为质量分数2%时,羟基自由基清除率为最大值。分析原因可能是,底物质量分数不变时,随着加酶量的增加,绿豆蛋白被充分水解成了抗氧化活性相对较差的肽段。图4(b)为还原能力与酶解时间关系,由图可知,各组之间的还原能力差距不大,随着酶用量的增大,还原能力略微增大,而且还原能力的体系所呈现出的组间差别并没有清除率那么大。综合DPPH自由基清除率、羟基自由基清除率以及生产成本的角度来看,选择质量分数2%的加酶量为最适加酶量条件。
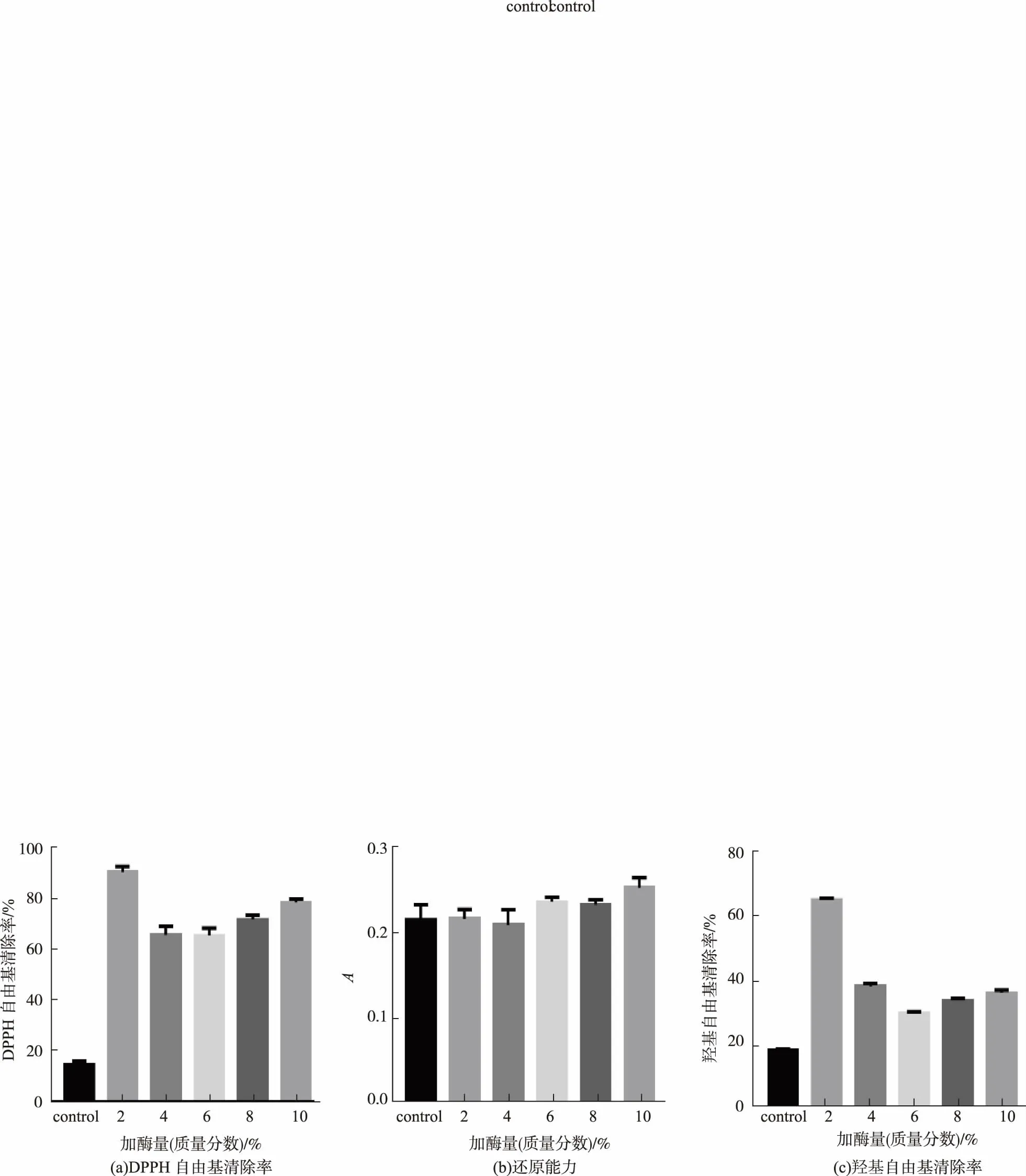
图4 不同加酶量绿豆蛋白酶解产物的抗氧化能力Fig.4 Antioxidant ability of mung bean proteolysis products with different enzyme contents
2.4 优化酶解条件下绿豆蛋白酶解产物的抗氧化能力
根据前期对绿豆蛋白酶解条件优化实验的结果,得出最优酶解条件:用中性蛋白酶酶解绿豆蛋白,在pH 7、温度50℃、底物质量分数3%、加酶量为质量分数2%的条件下,酶解3 h,后灭酶,离心取上清液,最后冻干得到绿豆肽,测定其抗氧化能力。图5(a)中可看出,DPPH自由基清除率与酶解得到绿豆肽的质量浓度呈正相关性,随着绿豆肽质量浓度的增大,其DPPH自由基清除率逐渐增大,这与酶种类选择的实验中酶解产物的浓度与DPPH自由基清除率呈正相关的结论一致。质量浓度为1、5、10 mg/mL的绿豆肽DPPH自由基清除率分别是(29.37±0.9)%、(91.58±2.44)%、(96.16±2.2)%,其中5 mg/mL绿豆肽的DPPH自由基清除率与图5(c)中500μg/mL谷胱甘肽的DPPH自由基清除率相当,说明该绿豆肽具有较好的抗氧化能力。图5(b)中可以看出,还原能力与酶解得到绿豆肽的质量浓度呈正相关,随着绿豆肽质量浓度的增大,其DPPH自由基清除率逐渐增大,这同样与酶种类选择的实验中酶解产物的质量浓度与还原能力呈正相关的结论一致。质量浓度为1、5、10 mg/mL绿豆肽的吸光度值分别为0.11±0.01、0.18±0.01、0.31±0.03,吸光度值逐渐增大,还原能力也逐渐增强,其中5 mg/mL绿豆肽的还原能力与图5(d)中100μg/mL谷胱甘肽的还原能力相当,表明了优化酶解条件下绿豆蛋白酶解产物具有较好的抗氧化能力。
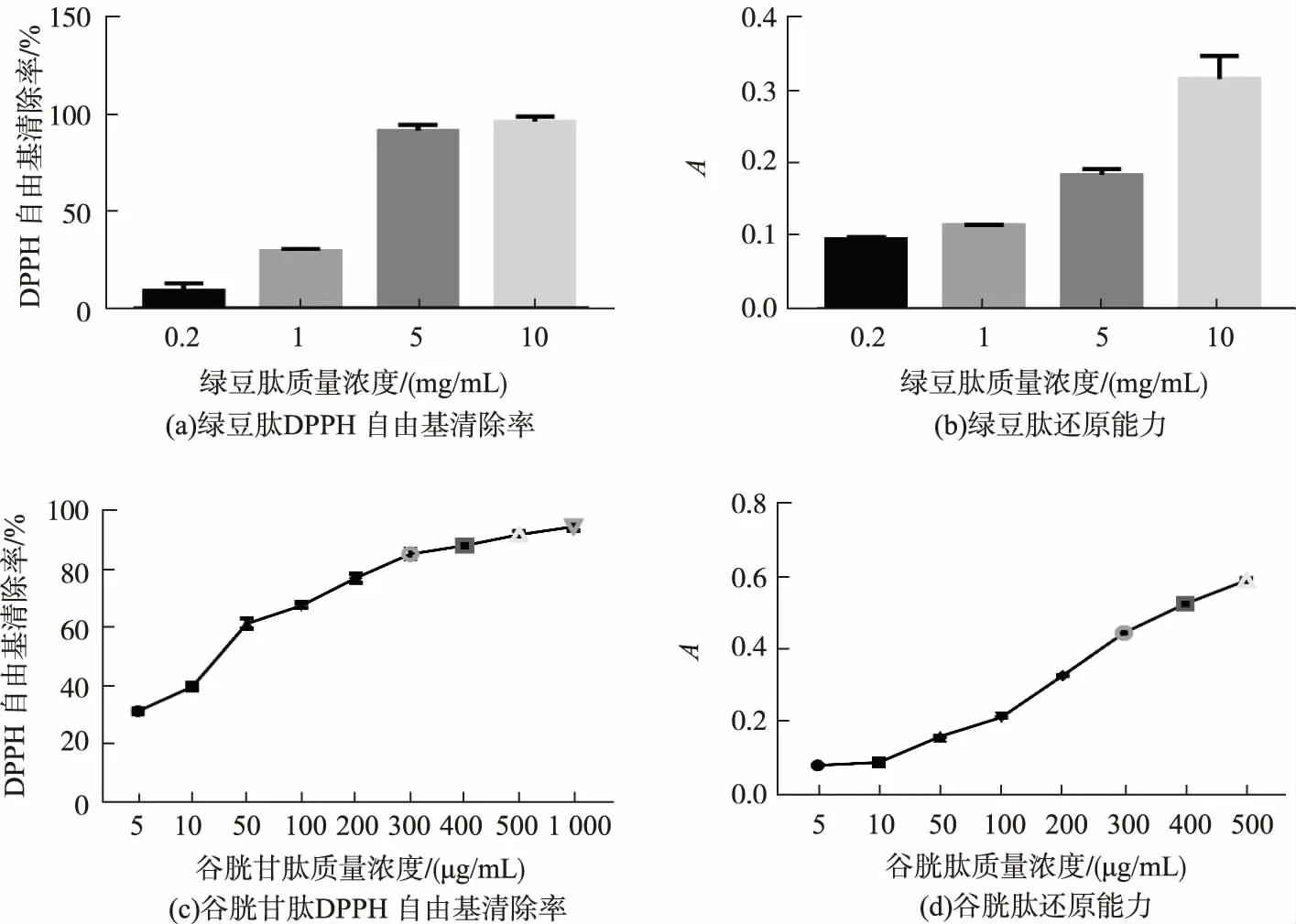
图5 优化酶解条件下绿豆蛋白酶解产物以及谷胱甘肽的抗氧化能力Fig.5 Antioxidant capacity and mung bean proteolysis products under optimal enzymatic conditions
2.5 优化酶解条件下绿豆肽的分离纯化及其抗氧化活性
将优化酶解条件后得到的绿豆肽用凝胶过滤层析法分离纯化,收集峰值处组分,测其体外抗氧化指标。从图6中可以看出,洗脱过程中按照洗脱时间的先后顺序共出现5个明显的峰,分别收集得到组分1—5,测其体外抗氧化指标与未分离多肽的抗氧化指标进行比较。图7(a)为未分离多肽与分离的5个组分的DPPH自由基清除率,由图可知,未分离多肽的自由基清除率高于组分2和组分3,但是低于组分1、组分4和组分5。组分5的清除率最高,为组分4清除率的2.6倍;其次是组分1,为组分4的2倍。图7(b)为未分离多肽与分离的5个组分的还原能力,与DPPH自由基清除率的结果相似,组分5的还原能力最高,是组分4的4.7倍。按照图6中出峰时间来判断,组分5出峰时间最晚,为相对分子质量较小的肽段,该分析结果也符合其他参考文献的结论,即相对分子质量较小肽段的抗氧化能力超过相对分子质量较大肽段和未分离多肽[2,18-19]。因此,小分子肽段组分5可作为绿豆蛋白酶解得到的抗氧化性能最好的蛋白肽段。而组分5的进一步分离纯化以及鉴定工作则需要在后续的实验中继续探究。
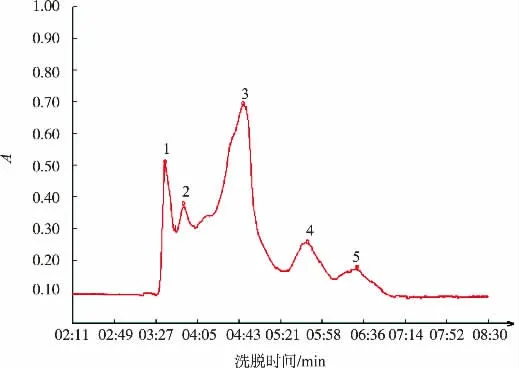
图6 绿豆肽层析图谱Fig.6 Mung bean peptide chromatogram
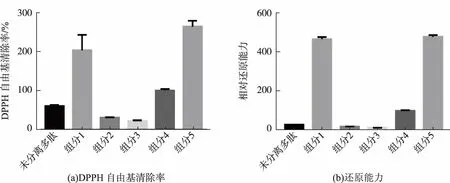
图7 绿豆肽分离组分抗氧化能力Fig.7 Antioxidant ability of mung bean peptide separation components
3 结语
以绿豆蛋白为原料,分别选用碱性蛋白酶、中性蛋白酶、胰蛋白酶、胃蛋白酶以及组合酶分别在其最适温度、pH条件下对绿豆蛋白酶解,再用酶解时间和加酶量作为单因素条件,以DPPH自由基清除率、还原能力以及羟基自由基清除率作为判断酶解效果的指标。得到了绿豆蛋白最佳酶解条件为:中性蛋白酶酶解,底物质量分数3%,酶解时间3 h,加酶量为质量分数2%,pH 7.0,温度50℃,该条件下制备的绿豆蛋白酶解产物的抗氧化性能最好。质量浓度为5 mg/mL时,DPPH自由基清除率已高达(91.58±2.44)%,与500μg/mL谷胱甘肽的DPPH自由基清除率相当,且具有较强的还原能力。另通过凝胶过滤层析分离绿豆肽,测其抗氧化能力,相对分子质量较小的肽段组分5为抗氧化效果最好的肽段。

