杜鹃花总黄酮通过激活大鼠脑基底动脉血管内皮细胞TRPV4、Kca3.1和Kca2.3通道改善缺血性脑损伤
王书凡,赫玉香,程小龙,徐杭杭,沈学彬,,胡浩然,,周若瑜,,3,曹 迪,,3,韩 军,,3,4
(皖南医学院 1.安徽省皖南地区植物药活性物质筛选与再评价工程实验室;2.药物研发中心;3.安徽省多糖药物工程技术研究中心;4.药理学教研室,安徽 芜湖 241002)
脑血管疾病是一种发病率高、致残率高、病死率高的疾病[1-2]。缺血性脑血管疾病由于供应脑血流的主动脉狭窄或闭塞,致脑组织缺氧缺血,引发局部脑组织的缺血甚至坏死[3]。发病后,应尽快恢复缺血组织血流,但再灌注又会引起更严重的脑损伤[4-5]。其病理过程复杂,机制尚不清楚。
脑血管收缩和舒张因子引起的血管张力变化是缺血性脑血管病变化、发展及转归的关键因素。血管内皮衍生超极化因子(endothelium derived hyperpolarizing factor,EDHF)可由脑血管内皮细胞合成释放,促进血管内皮细胞钙激活钾通道(calcium-activated potassium channel,Kca),引起平滑肌细胞超极化,继而导致Ca2+内流减少,产生血管松弛作用[6]。瞬时受体电位通道4(transient receptor potential vanilloid channel 4,TRPV4)是存在于细胞膜上的非选择性阳离子通道,可调节血管功能。在血管内皮细胞中,激活TRPV4可促使Ca2+内流,进而开放中电导钙激活钾通道(intermediate conductance Kca,Kca3.1)和小电导钙激活钾通道(small conductance Kca,Kca2.3),促进EDHF诱导的血管松弛反应[6]。
杜鹃花是杜鹃花科植物,含槲皮素、映山红素、芦丁、金丝桃苷等成分[7],有止咳、平喘、祛风湿等功效。杜鹃花总黄酮(total flavone of rhododendron,TFR)是从杜鹃花中提取的一种化合物[6]。研究发现,TFR可减少脑梗死面积和缺氧复氧损伤神经元内Ca2+浓度,减轻脑水肿[6]。前期研究表明[6-7],在全脑缺血再灌注(ischemia-reperfusion,IR)大鼠脑基底动脉(cerebral basilar artery,CBA)中,TFR减轻缺血性脑损伤的保护作用可能与其激活血管内皮细胞和平滑肌细胞中TRPV4有关。但TFR是否通过激活TRPV4继而开放Kca3.1、Kca2.3通道产生保护作用,未见相关报道。
本研究建立IR大鼠模型,研究TFR改善缺血性脑损伤的保护作用与CBA血管内皮细胞TRPV4、Kca2.3及Kca3.1通道之间的关系。
1 材料与方法
1.1 试剂 TFR(≥85%)、HC-067047(批号:SML0143)、TRAM-34(批号:T6700)和Apamin(批号:A9459),购于上海源叶生物科技有限公司;Rat LDH Elisa kit(批号:CK-E30024)和Rat MDA Elisa kit(批号:CK-E30266R),购自苏州卡尔文生物科技有限公司。
1.2 仪器 BL-310生物机能试验仪(成都泰盟科技有限公司),脑立体定位仪(美国哈佛公司),逆转录PCR仪(美国ABI公司)。
1.3 动物 72只雄性SD大鼠(8 周龄),(250±20) g,南京青龙山动物繁殖场提供,许可证号:SCXK(苏)2014-0001。相对湿度55%~60%,室温(23±2)℃,自由饮食进水,适应性喂养1周。
1.4 实验方法
1.4.1 分组与给药 72只SD雄性大鼠,除假手术组,其余建立IR模型。随机分9组:假手术组、模型组、TFR组(100 mg/kg)、TFR联用HC-067047组(100 mg/kg +10 mg/kg)、TFR联用TRAM-34组(100 mg/kg +0.5 mg/kg)、TFR联用Apamin组(100 mg/kg +0.3 mg/kg)、HC-067047组(10 mg/kg)、TRAM-34组(0.5 mg/kg)及Apamin组(0.3 mg/kg)。上述药物术前30 min或 35 min于尾静脉注射。
1.4.2 Pulsinelli-Brierley四血管阻断法(four-vessel occlusion,4-VO)[3]大鼠腹腔注射水合氯醛(300 mg/kg)麻醉,颈后正中切口2 cm,电凝颈椎两侧翼孔,阻断两侧椎动脉,缝合。24 h 后麻醉,分离左右两侧颈总动脉,阻断两侧颈总动脉25 min,再灌注2 h。以大鼠可自主呼吸,翻正反射消失,脑电波低平为造模成功标志。假手术组不阻断双侧椎动脉和颈总动脉,其余操作相同。
1.4.3 ELISA法检测血清丙二醛(methane dicarboxylic aldehyde,MDA)含量与乳酸脱氢酶(lumbar disc herniation,LDH)活性 大鼠麻醉后,腹主动脉取血,分离血清后按试剂盒说明书检测血清中MDA含量与LDH活性。
1.4.4 HE染色 再灌注24 h后,处死大鼠,取脑组织浸泡于4%多聚甲醛溶液中。经脱水、浸蜡、包埋,切片、脱蜡、染色,显微镜观察各组病理学变化。
1.4.5 RT-qPCR法[3]免疫磁珠法分离脑基底动脉内皮细胞[8],总RNA的提取按照Trizol一步法的说明书,纯化定量后,取2 μg总RNA逆转录合成cDNA(37 ℃ 15 min,85 ℃ 5 s),置于-20 ℃冰箱。按Power SYBR Green PCR Master Mix试剂盒说明书扩增RT-PCR基因片段(95 ℃ 30 s,95 ℃ 5 s,60 ℃ 31 s),共40个循环,GAPDH为内参。采取7300 System SDS Software分析,算出每组RQ值及△△Ct值,分析每组mRNA表达情况。GAPDH,上游:5′-GTGAAGGTCGGAGTCAACGGATTT-3′,下游:5′-CACAGTCTTCTGGGTGGCAGTGAT-3′;Kca3.1引物,上游:5′-GTGCGTGCAGGATTTAGGG-3′,下游:5′-TGC-
TAAGCAGCTCAGTCAGGG-3′;Kca2.3引物,上游:5′-CACCTTCCCCAAAGCCAACA-3′,下游:5′-CGATCACAAAGAGCTGTACTTCC-3′;TRPV4引物,上游:5′-CCCGA GAGAACACCAAGTTTG-3′,下游:5′-GA-
CCGTCATTGTTAAGCACAGTCT-3′。
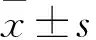
2 结果
2.1 大鼠血清MDA含量和LDH活性 模型组MDA含量及LDH活性较假手术组升高(P<0.05)。与模型组相比,TFR组及TFR联用各阻断剂组MDA含量及LDH活性降低(P<0.05)。与TFR组比较,TFR联用各阻断剂组MDA含量及LDH活性升高(P<0.05)。见表1。

表1 各组IR大鼠血清MDA含量和LDH活性比较
2.2 HE染色结果 与假手术组相比,模型组大鼠可见大量脑组织出现细胞萎缩、空泡,神经纤维崩解等。而TFR组大鼠脑组织病理学改变明显改善。TFR联用各阻断剂组细胞变性坏死仍较明显,细胞周围间隙明显增大,但较模型组改善明显。见图1。
2.3 TFR及各阻断剂对IR大鼠CBA内皮细胞中TRPV4、Kca3.1、Kca2.3 mRNA表达水平的影响 与假手术组相比,模型组TRPV4、Kca3.1及Kca2.3 mRNA表达下降(P<0.05)。与模型组相比,TFR组及TFR联用各阻断剂组TRPV4、Kca3.1及Kca2.3 mRNA表达水平升高(P<0.05),HC-067047组TRPV4 mRNA表达水平下调(P<0.05),Apamin组和TRAM-34组TRPV4 mRNA表达差异无统计学意义(P>0.05)。与TFR组相比,TFR联用各阻断剂组与各阻断剂组TRPV4、Kca3.1及Kca2.3 mRNA表达下降(P<0.05)。与TFR联用各阻断剂组相比,各阻断剂组TRPV4、Kca3.1及Kca2.3 mRNA表达下调(P<0.05)。见表2~4。
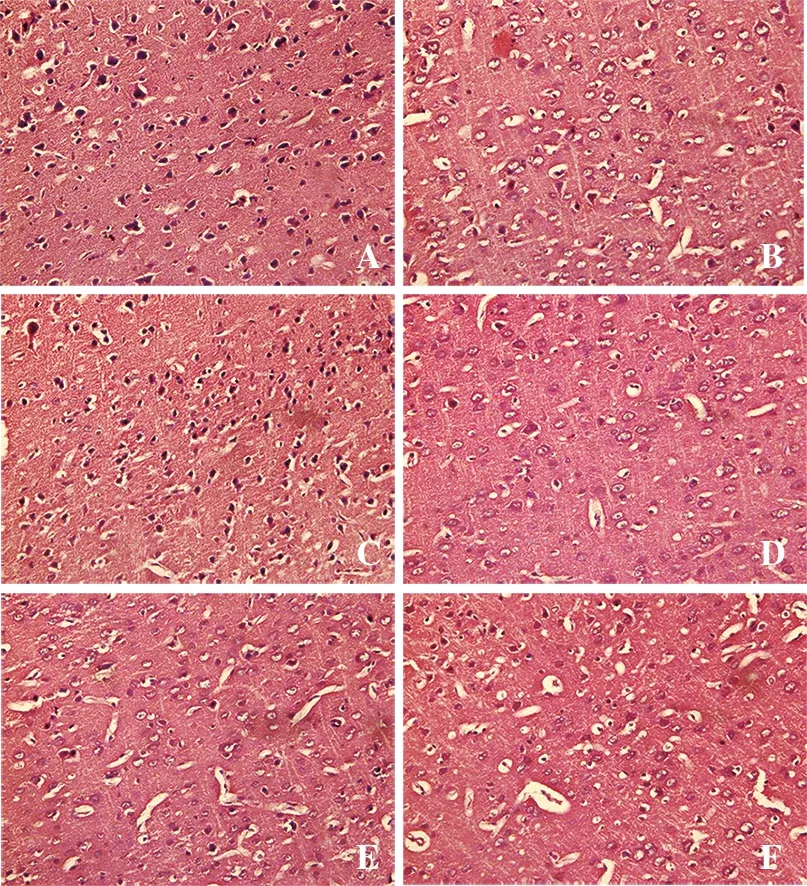
A.假手术组;B.模型组;C.TFR组;D.TFR+HC-067047组;E.TFR+Apamin组;F.TFR+TRAM-34组。

表2 TFR及HC-067047对内皮细胞中TRPV4 mRNA表达的影响

表3 TRAM-34对内皮细胞中 Kca3.1 mRNA表达的影响

表4 TFR及Apamin对内皮细胞中 Kca2.3 mRNA表达的影响
3 讨论
缺血性脑血管疾病是一种常见的神经系统疾病[8],其机制复杂,目前临床上尚无疗效确切的药物。我们的前期研究已证实TFR(100 mg/kg)可产生EDHF样舒张脑血管、改善脑组织病理损伤等作用[6]。
瞬时受体电位通道(TRP)是Ca2+进入内皮细胞的非选择性阳离子通道[9]。瞬时受体电位通道亚家族V(TRPV)是TRP通道的亚科,TRPV4是TRPV的成员,参与细胞增殖、分化与凋亡等。文献报道,激活TRPV4能改善缺血性脑损伤[8]。前期研究发现,TFR预处理后,IR大鼠CBA内皮细胞中TRPV4 蛋白表达明显升高,而此作用可以被TRPV4通道非选择性阻断剂(钌红)抑制。提示TFR可能通过激活TRPV4改善脑组织损伤,但具体机制尚不明确[6]。研究证实,平滑肌细胞膜上Ca2+与K+通道可调节血管舒缩功能。平滑肌细胞膜K+通道[10-11]分为Ca2+激活K+通道(Kca)、内向整流K+通道(Kir)、ATP依赖型K+通道 (KATP)及延迟整流K+通道(Kdr)。Kca对Ca2+浓度敏感,通过负反馈调节,影响胞内Ca2+浓度,调节血管舒缩功能。目前已知Kca有3种亚类[10]:大电导Kca(BKca)、Kca3.1及Kca2.3。心脑血管疾病与这3类Kca联系紧密。其中BKca主要分布在平滑肌及某些神经元;Kca3.1分布广泛,如红细胞、血小板、上皮细胞、血管内皮细胞;Kca2.3在心房肌细胞的胞膜、胞质及胞核均有分布,血管内皮细胞中亦存在。通过抑制Kca3.1的表达,可减弱由乙酰胆碱激活的内皮依赖性超极化反应,减弱血管舒张功能[12]。阻断Kca2.3则减小阻力血管直径,恢复Kca2.3活性时,此现象消失[13]。敲除Kca3.1与Kca2.3两种基因,可减少巨噬细胞浸润,降低氧化应激[14]。
当脑组织缺血缺氧时,乳酸累积,血清中LDH活性升高加快分解乳酸[15],不饱和脂肪酸和氧自由基可合成释放MDA[16]。因此检测血清中LDH活性和MDA含量可间接反映缺血脑组织损伤程度。HC-067047、Apamin和TRAM-34分别是TRPV4[17]、Kca2.3和Kca3.1选择性阻断剂[18]。本实验发现用药TFR后,IR大鼠血清中MDA含量升高及LDH活性下降,脑组织病理损伤改善。而分别加入各相应阻断剂后,以上TFR的作用被抑制。提示TFR的作用可能与其开放TRPV4、Kca3.1、Kca2.3有关。RT-qPCR结果显示,用药TFR后,IR大鼠CBA内皮细胞中降低的TRPV4、Kca3.1和Kca2.3 mRNA表达升高。而各相应选择性阻断剂可抑制TFR的此作用,提示TFR改善大鼠脑组织损伤的作用可能与其激活CBA内皮细胞中TRPV4、Kca2.3及Kca3.1,促进其 mRNA表达有关。研究表明,开放TRPV4可产生EDHF效应并激活Kca3.1和Kca2.3[19]。因此,在IR大鼠CBA内皮细胞中,TFR可能通过激活TRPV4,促进其下游Kca2.3、Kca3.1基因表达,改善缺血性脑损伤。
综上所述,结合前期研究[6-8]可知,缺血性脑损伤发生时,CBA内皮细胞TRPV4受到抑制导致下游Kca3.1与Kca2.3功能与活性降低,脑血管舒张功能减弱,脑血流降低,血清中LDH活性与MDA含量升高。用药TFR后,其作用于CBA内皮细胞激活TRPV4,继而开放Kca2.3与Kca3.1,促进内源性舒血管物质EDHF生成增多,诱导CBA舒张,降低MDA含量与LDH活性,减轻大鼠IR损伤。

