陆地棉钾转运体基因GhHAK5启动子的克隆与功能分析
晁毛妮 胡海燕,* 王润豪 陈 煜 付丽娜 刘庆庆 王清连
陆地棉钾转运体基因启动子的克隆与功能分析
晁毛妮1胡海燕1,*王润豪1陈 煜2付丽娜1刘庆庆1王清连1
1河南科技学院/ 现代生物育种河南省协同创新中心, 河南新乡 453003;2山东棉花研究中心, 山东济南 250100
KUP/HAK/KT钾转运体基因的转录调控是植物响应低钾胁迫的一项重要机制。克隆和分析棉花钾转运体基因的启动子, 不仅有助于了解其表达模式及调控机制, 对于改良棉花的钾吸收特性也具有重要意义。陆地棉钾转运体基因是一个在根中特异性高表达的基因, 其表达受低钾胁迫诱导, 目前关于该基因启动子的功能还不清楚。本研究以陆地棉品种百棉1号为材料, 通过PCR方法对上游2000 bp启动子片段(pGhHAK5)进行克隆, 并通过转化拟南芥、GUS组织定位和低钾诱导表达特性分析来研究其功能。结果表明, pGhHAK5除具有TATA-box和CAAT-box等基本顺式作用元件外, 还含有多个响应于光、逆境胁迫、植物激素和生物钟等的顺式作用元件。pGhHAK5与雷蒙德氏棉pGrHAK5在重要调控元件的数量和位置分布上具有较高的一致性, 均具有5个参与根特异性表达调控的元件(ATAAAAT)和1个参与低钾条件下转录调控的ARF转录因子结合位点(TGTCNN)。GUS组织化学染色结果显示, 转基因拟南芥幼苗的叶脉和胚轴维管束组织染色较深, 根系染色较浅; 成熟期转基因拟南芥植株的根、叶脉和花萼维管束组织染色较深, 茎和荚皮染色较浅, 表明pGhHAK5驱动的主要在拟南芥成熟的根和地上部维管束组织中表达。进一步低钾诱导表达特性分析表明, PGhHAK5驱动的在拟南芥幼苗幼嫩根中的表达很弱, 且其表达不受低钾胁迫诱导而增强, 表明PGhHAK5可能是一个主要在成熟根中具有功能的低钾诱导型启动子。转录组分析和荧光定量PCR结果表明,主要在成熟的根中表达, 且其表达受发育时期的影响, 该结果与pGhHAK5驱动的在拟南芥根中的表达结果一致。本研究结果有助于深入了解表达调控的分子机制, 并为棉花钾吸收效率的提高及钾高效棉花品种的培育提供理论依据。
启动子; 维管束组织; 钾转运体; 低钾; 陆地棉
棉花是我国重要的经济作物, 也是钾敏感作物[1]。据估计, 我国耕地有1/4~1/3的土壤缺钾或严重缺钾[2], 土壤缺钾不仅会影响棉花的产量和纤维品质的形成, 也是引起棉花早衰的重要原因之一[3-8]。研究表明, 植物可以通过提高自身的钾吸收效率或调整内源钾的再分配与利用来适应外界的低钾环境[9], 该过程主要通过钾转运体和钾离子通道蛋白两大钾转运系统来完成[10-11]。近年来, 对钾转运系统基因的研究已成为提高作物钾吸收特性和培育钾高效作物品种的一条新途径。
KUP/HAK/KT钾转运体是植物钾转运系统较早发现的一个基因家族, 其成员在介导植物对K+的高亲和性吸收、转运与分配等方面都起着关键作用[12-13]。是拟南芥KUP/HAK/KT家族成员之一, 其表达受低钾胁迫诱导, 也被认为是拟南芥响应钾缺乏的标志性基因[12]。作为拟南芥KUP/HAK/ KT家族中唯一的能在低于10 μmol L–1钾浓度环境下参与钾吸收的高亲和性钾转运体基因[13], 目前关于表达调控的分子机制已开展许多研究。研究者们发现,启动子区特定的顺式作用元件会与相应的转录因子结合来调控该基因的表达, 使植物更好地适应外界低钾环境[14-15]。例如, 转录因子ARF2通过与启动子区生长素响应元件结合来抑制的表达, 并可通过低钾引起的ARF2磷酸化来解除其对表达的抑制, 使其在低钾条件下被诱导并大量表达[14]; 同样地, 转录因子RAP2.11可通过与启动子区ERE结构域和GCC-box位点结合来正向调控在低钾条件下的表达[15]。的表达除受转录水平调控外, 近年来研究发现激酶CIPK23能磷酸化AtHAK5蛋白的N端, 并在转录后水平调控AtHAK5蛋白的活性, 增强其对环境中钾的吸收能力[16]。这些研究表明, 钾转运体基因的表达调控在植物适应外界低钾胁迫方面发挥着重要作用。
启动子对于基因的表达调控至关重要, 其包含的顺式作用元件种类和数量会影响基因的表达模式和强度[17]。因此, 克隆和分析基因的启动子, 有助于了解其表达模式及表达调控机制。陆地棉钾转运体基因是拟南芥的同源基因, 其CDS序列已被克隆, 关于其序列特征和表达特性已进行了初步研究[18], 然而, 关于该基因表达调控机制的研究尚很少开展。本研究以陆地棉品种百棉1号为材料, 对基因启动子2000 bp片段pGhHAK5进行克隆和顺式作用元件分析。为了研究pGhHAK5启动子的功能, 构建了融合表达载体pGhHAK5::GUS并转化拟南芥, 通过对转pGhHAK5拟南芥植株进行GUS组织定位和低钾诱导表达特性分析来探索基因的表达调控模式。研究结果不仅有助于阐明钾转运体基因表达调控的分子机制, 也可为棉花的钾营养性状的改良提供理论依据。
1 材料与方法
1.1 供试材料与植株培养
试验材料陆地棉品种百棉1号由河南科技学院棉花课题组提供, 用于基因启动子2000 bp片段pGhHAK5的克隆和表达特性的分析。
将百棉1号种植于河南科技学院光照培养室, 光照强度为450 μmol m–2s–1, 光周期为(30~33)℃/ 14 h光照, (23~26)℃/10 h黑暗。挑选整齐一致且饱满的棉花脱绒种子于湿沙中萌发和出苗, 待子叶展开后转移至1/2 Hoagland’s营养液[19]中培养。在棉花幼苗生长24、48、72、96、120 h及子叶期和四片真叶期时, 分别取棉花植株的根和叶, 速冻于液氮中并保存于-80℃冰箱, 以供用于基因不同发育时期的表达特性分析。
1.2 DNA的提取及pGhHAK5扩增
以幼嫩的百棉1号根系为材料, 按照DNA提取试剂盒(TIANGEN, DP321)说明书提取基因组DNA。根据pGhHAK5的序列信息, 利用Primer5.0设计引物, 引物序列为pGhHAK5-F: 5¢-TTCACGCCCATCTT TATCTC-3¢; pGhHAK5-R: 5¢-TCAACGTCCTTATCC AATCC-3¢。PCR体系50 μL, 包括10 μL 5× Prime STAR GXL buffer (Mg2+plus)、4.0 μL 2.5 mmol L–1dNTPs、10 mmol L–1正反向引物各1.5 μL、1 μL 1.2 U μL–1PrimeSTAR GXL DNA Polymerase (TaKaRa, R050A)、5.0 μL DNA模板和27.0 μL ddH2O。PCR程序为94°C 5 min; 94°C 30 s, 65°C 2.5 min, 32个循环; 72°C 10 min。PCR产物经1%琼脂糖凝胶电泳检测, 确定为目的基因的经胶回收试剂盒(Axygen, AP-GX-4)回收后送华大基因公司测序。
1.3 序列分析
利用植物顺式作用元件数据库PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线分析启动子的顺式作用元件。从Phyzotome网站(https://phytozome.jgi.doe.gov/pz/ portal.html)下载拟南芥(AT4G13420.1)、水稻(LOC_Os04g3292 0.1)、毛果杨(POPTR_0001s03680)ATG上游2000 bp的启动子序列; 从Cottongen网站(https://www.cottongen.org/)下载海岛棉(GB_D01G 2145)、雷蒙德氏棉(Gorai.002G213000.1)和亚洲棉(Ga02G1270)ATG上游2000 bp的启动子序列。利用Clustal软件进行序列比对后, 使用Bioedit 7.0软件分析序列间的相似性。
1.4 基因表达特性分析
不同生长发育时间点(幼苗生长24、48、72、96、120 h及4片真叶期)棉花组织(根和叶)的转录组数据下载于NCBI网站SRA (Sequence read archive)数据库(SRA: PRJNA248163[20])。使用软件cufflinks (Version 2.1.1)的FPKM (Fragments per kilobase of exon model per million mapped reads)方法来计算基因的表达量[21]。
采用荧光定量PCR (qRT-PCR)的方法进一步分析的表达特性, 内参基因为棉花组成型表达基因(GenBank登录号为AY907703.1)。内参基因和基因的荧光定量PCR引物序列为GhHAK5-F: 5'-GTAAGGACGGGTGGATA-3'; GhHA K5-R: 5'-AGTAAAGCAGGCAAGGTA-3'; Actin-F: 5'-GACCGCATGAGCAAGGAGAT-3'; Actin-R: 5'- GCTGGAAGGTGCTGAGTGAT-3'。以反转录得到的cDNA为模板, 于BIOER荧光定量PCR仪上进行qRT- PCR。反应体系包括2× SYBR Premix Ex(TaKaRa, RR820L)10 μL、10 mmol L–1正反向引物各0.8 μL、1 μL cDNA模板和7.4 μL ddH2O, 共计20 μL。反应程序为95°C 30 s; 95°C 5 s, 60°C 20 s, 40个循环后增加熔解曲线。每个样品设3次重复, 采用2–ΔΔCt法[22]计算基因的相对表达量。
1.5 载体的构建及农杆菌介导的转化
选用pCAMBIA1381Z(含有基因, 不含启动子)作为表达载体。首先, 根据启动子2000 bp的序列设计特异性引物, 引物序列为pGhHAK5- GUS-F: 5¢-CATGATTGATTTCAAAAAAA AAATGATATG-3' (下画线为内切酶I的识别序列); pGhHAK5-GUS-R: 5'-CATGAAGTT GCGATGACGGTGAG-3' (下画线为内切酶I的识别序列)。接着, 通过PCR扩增将酶切位点I引入pGhHAK5的上下游。对PCR回收产物和载体pCAMBIA1381Z分别用内切酶I进行酶切并胶回收, 载体胶回收产物再用去磷酸化酶CIAP (2250A, Takara)进行去磷酸化并胶回收, 载体酶切并去磷酸化后的胶回收产物和PCR酶切后的胶回收产物用T4连接酶进行连接反应, 将连接产物转化大肠杆菌感受态DH5α, 涂布含有卡纳霉素的LB抗性平板, 37℃培养12 h后, 挑取单克隆, 并进行菌液PCR检测。检测为阳性的菌液提取质粒后进行进一步的酶切验证, 将含有目的基因片段的菌液送华大基因公司测序。最后, 将测序结果与目标序列比对, 序列一致且目的片段连入方向正确的菌液提取质粒后转化根癌农杆菌EHA105。采用农杆菌介导的蘸花法[23]将上述重组表达载体转化野生型拟南芥(Cloumbia-0), 获得T0代转基因种子。
1.6 转基因拟南芥植株的筛选和鉴定
将收获的T0代转基因种子种在含有潮霉素抗性的MS培养基上筛选, 经抗性筛选长出的植株为T1代植株, 待T1代植株长出两片真叶后移栽到蛭石中, 在光照培养箱(22℃, 光16 h/暗8 h)中培养。于幼苗期取T1代转基因拟南芥植株的叶片, 用于进一步PCR检测, 检测为阳性的植株于成熟期收获T1代种子。PCR检测方法如下, 首先, 通过DNA提取试剂盒(Tiangen, DP321)提取转基因拟南芥植株和野生型拟南芥(阴性对照)叶片DNA; 然后, 利用目的基因特异性引物F: 5'-ATTGATTTCAAAAAAAAAATG ATATG-3', R: 5'-AAGTTGCGATGACGGTGAGAAA TG-3', 以叶片DNA和表达载体pCAMBIA1381Z- pGhHAK5质粒(阳性对照)为模板进行PCR扩增。最后, 扩增产物经1%脂糖凝胶电泳检测后, 根据检测结果鉴定目标启动子片段是否插入拟南芥基因组DNA中。以同样方法继续对T1代种子进行潮霉素抗性筛选和PCR检测, 收获的T2代种子用于后续的pGhHAK5功能分析。
1.7 拟南芥幼苗的低钾处理
将转基因拟南芥种子春化、消毒后分别播种在正常(MS)和低钾(LK, 100 µmol L–1K+)培养基上[24], 然后于相同条件的光照培养箱(22℃, 光16 h/暗8 h)中培养, 生长2周后, 取整株拟南芥幼苗进行GUS染色。
1.8 GUS组织化学染色
参照Jefferson等[25]的方法略加修改, 取拟南芥幼苗和成熟期拟南芥植株的根、叶片、茎、花和荚等组织, 加入GUS染色液, 于37℃温育过夜24 h, 用70%乙醇脱色, 直至底色完全消失, 在体视显微镜(AXIO Zoom.V16, 蔡司)下观察染色结果并照相。
2 结果与分析
2.1 GhHAK5基因启动子的克隆
以先前克隆的位于陆地棉D亚组的钾转运体基因[18]ID号Gh_D01G1760检索陆地棉基因组数据库[20], 得到其起始密码子ATG上游2000 bp的启动子序列。在该目标序列的上下游约500 bp范围内设计1对特异性引物, 以百棉1号DNA为模板, 通过PCR方法对启动子2000 bp片段pGhHAK5进行扩增。扩增片段的理论大小为2600 bp, 由图1可以看出, PCR产物电泳检测结果与预期的片段大小相符。PCR产物经测序后与陆地棉TM-1基因组数据库pGhHAK5参考序列比对分析表明, 克隆的2600 bp序列包含完整的目标pGhHAK5片段, 且与TM-1基因组参考序列一致, 表明已成功克隆基因上游2000 bp的启动子序列。
2.2 pGhHAK5顺式作用元件预测与分析
利用在线启动子元件预测工具PlantCARE对pGhHAK5进行顺式作用元件分析, 发现该启动子除具有CAAT-box和TATA-box等启动子基本核心元件外, 还包括1个提高转录水平的5' UTR Py-rich stretch元件、5个参与光响应的元件(Box I、I-box、G-Box、AT1-motif和Box II 2)、1个生物钟调控元件(circadian)、4个参与植物激素响应的元件(包括1个水杨酸响应元件TCA-element, 1个茉莉酸响应元件CGTCA-motif, 1个生长素响应元件TGA-element和1个乙烯响应元件ERE)、5个逆境胁迫响应元件(包括4个热胁迫响应元件HSE和1个真菌诱导子元件Box-W1); 另外, 还包括4个胚乳表达相关顺式作用调控元件(Skn-1_motif)、1个AT-rich DNA结合蛋白的结合位点(AT-rich element)和5个根特异性表达响应元件[26]等其他类顺式作用元件(表1和图2)。这些结果表明基因的表达可能受光、植物激素、逆境胁迫和生物钟等外界环境条件的调控。

图1 陆地棉启动子序列的扩增
Fig. 1 Amplification ofpromoter sequence in upland cotton (L.)
1:启动子PCR扩增产物; 2: DNA分子量标准(DL2000)。
1: PCR products ofpromoter; 2: DNA marker (DL2000).
2.3 GhHAK5与其同源基因启动子序列的比较分析
为了深入了解的表达调控特性, 对及其同源基因包括拟南芥、水稻、毛果杨、四倍体棉种海岛棉以及二倍体祖先棉种雷蒙德氏棉(D5)和亚洲棉(A2)基因ATG上游2000 bp的启动子序列比较分析。表明pGhHAK5具有5个根特异性表达调控的元件(ATAAAAT)[26](图3), 暗示着可能是一个在根中特异性高表达的基因。是一个在根中特异性高表达的基因(数据来源于Phyzotome网站), 与pGhHAK5一样, pPtHAK5.1也具有5个根特异性表达调控元件(图3)。另外, pGhHAK5含有1个参与低钾条件下转录调控的ARF转录因子结合位点[27](TGTCNN), 但是不含有参与低钾条件下表达调控的RAP2.11转录因子结合位点GCC-box[15](图3)。说明pGhHAK5的表达可能受低钾胁迫调控, 但是可能具有和其他植物不一样的转录调控机制。进一步对棉属4个种基因启动子序列比较分析发现, pGhHAK5与雷蒙德氏棉pGrHAK5在重要调控元件数量和位置分布上具有较高的一致性, 均含有5个根特异性表达调控元件和1个ARF转录因子结合位点(图3), 且两者启动子间的序列相似性达87.7%; 与海岛棉pGbHAK5在元件数量和分布上差异次之, 且两者启动子间的序列相似性达68.9%, 与亚洲棉pGaHAK5在元件数量和分布上差异最大, 且两者启动子间序列相似性达40.5% (图3)。陆地棉是一个位于D亚组的基因, 陆地棉pGhHAK5与二倍体祖先种雷蒙德氏棉(D5)pGrHAK5在核心元件数量和位置上具较高的一致性, 表明棉花启动子区重要的调控元件或位点在物种进化过程中可能是保守的。
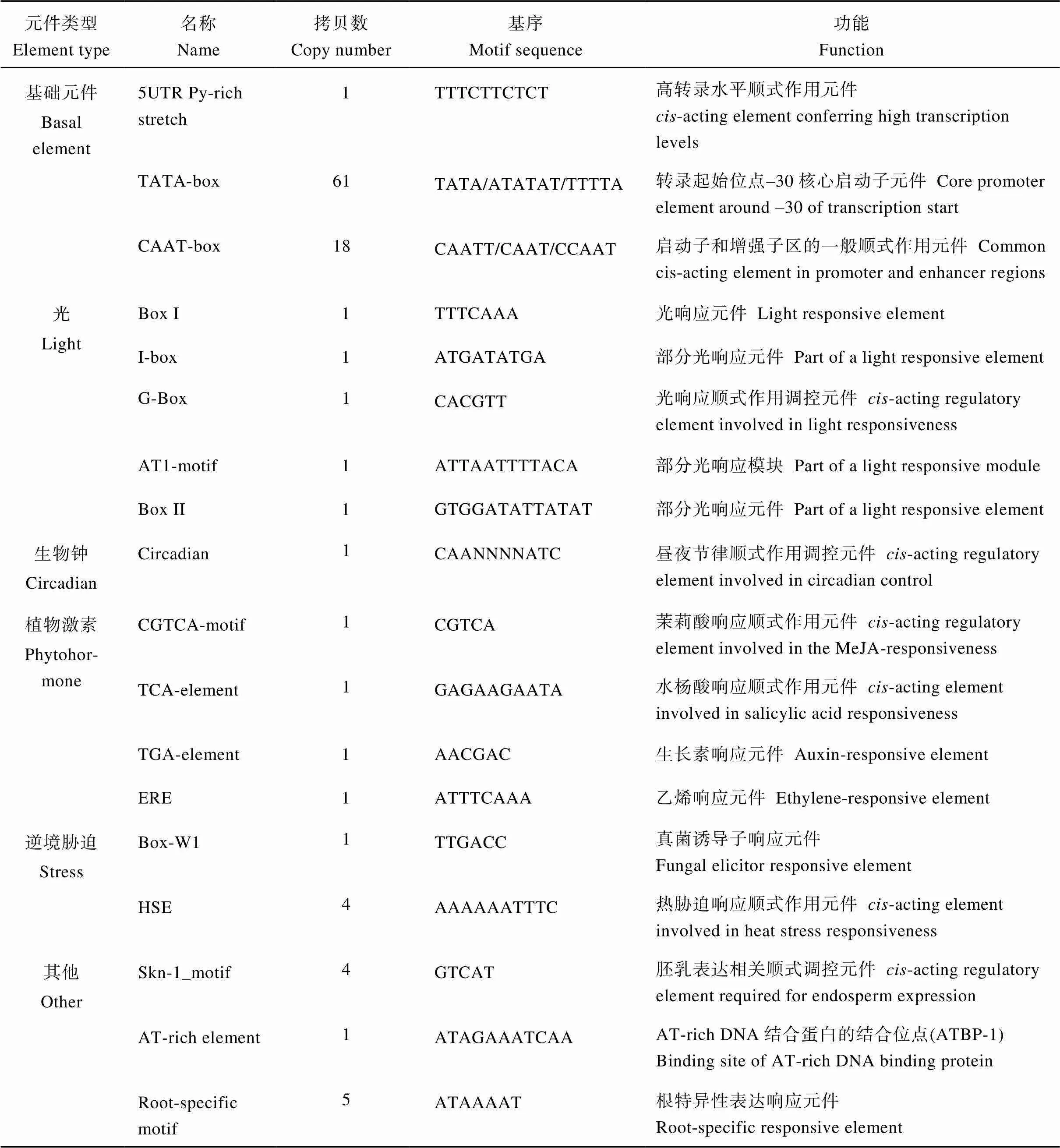
表1 GhHAK5启动子区包含的顺式作用元件

图2 GhHAK5启动子的序列分析
核苷酸的+1位置指的是起始密码子ATG中的A的位置, ATG用红色表示。部分预测的顺式作用元件在图中用灰色阴影表示。1个ARF转录因子结合位点(TGTCNN)在图中用红色加下画线表示。5个根特异性表达元件(ATAAAAT)在图中用红色加粗表示。
The nucleotide at position +1 is the ATG start codon, the ATG is indicated in red. Parts of the putative-regulatory elements are noted under the sequences in shadow. The one ARF binding site (TGTCNN) is underlined in red, and the five root-specific motifs are bold in red.
2.4 转基因拟南芥阳性植株的鉴定
将2000 bp的启动子片段pGhHAK5通过单酶切法(I)构建到含有基因的表达载体pCAMBIA1381Z (有GUS, 无启动子)上, 并通过农杆菌介导法转化野生型拟南芥(Cloumbia-0), 成熟后收获T0代种子, 经含有潮霉素MS培养基筛选后, 进一步对T1代拟南芥幼苗进行PCR检测。由图4可知, T1代拟南芥幼苗和表达载体pCAMBIA1381Z-pGhH AK5质粒均能扩增到2000 bp的目标条带pGhHAK5, 而野生型拟南芥没有扩增到目标条带, 表明本研究检测的T1代拟南芥幼苗为阳性植株, 成熟后收获T1代种子, 经含有潮霉素MS培养基筛选和PCR检测, 成熟后收获的T2代种子用于后续的功能分析。
2.5 pGhHAK5的功能分析
对转pGhHAK5拟南芥植株进行GUS组织化学染色, 结果pGhHAK5驱动的主要在转基因拟南芥幼苗的叶脉(图5-B1, B2)和胚轴维管束组织(图5-B1, B3)中表达, 在根(图5-B1, B4)中表达量较低, 而野生型拟南芥幼苗的各个组织均无染色(图5-A1~A4)。先前研究发现是一个在根中特异性高表达的基因[18], 为了探究pGhHAK5驱动在根中的表达是否受发育时期影响, 本研究进一步对成熟期拟南芥植株的根、叶片、茎、花和荚等组织进行GUS染色。结果转基因拟南芥的叶脉(图5-B5)、根(图5-B11, B12)和花萼维管束组织(图5-B7, B8)均染色较深, 茎(图5-B6)和荚皮(图5-B9, B10)染色较浅; 野生型拟南芥的叶片(图5-A5)、茎(图5-A6)、花(图5-A7, A8)、荚(图5-A9, A10)和根(图5-A11, A12)均没染色。说明pGhHAK5驱动主要在转基因拟南芥成熟的根和地上部维管束组织中表达, 且在拟南芥根中的表达受发育时期的影响。

图3 GhHAK5同源基因启动序列的比较分析
加粗的为棉属4个种钾转运体基因的启动子。
The promoter of potassium transporter geneof four species inare indicated in bold.
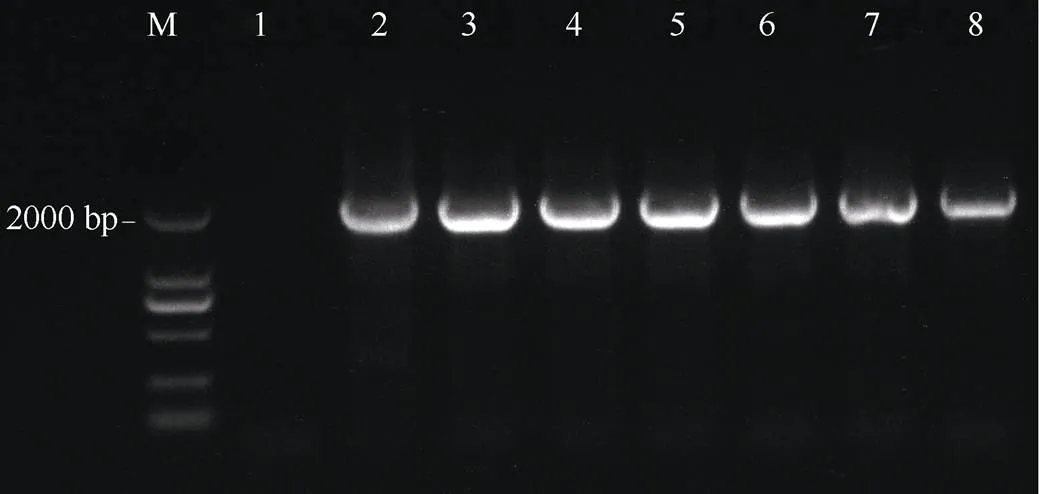
图4 T1代转基因拟南芥植株的PCR检测
M: marker; 1: 野生型拟南芥(阴性对照); 2: 表达载体pCAMBIA1381Z-pGhHAK5质粒(阳性对照); 3~8转基因拟南芥。
M: marker; 1: wild(negative control); 2: expression vector pCAMBIA1381Z-pGhHAK5 plasmid (positive control); 3–8: transgenic.
2.6 低钾胁迫对转pGhHAK5拟南芥幼苗GUS表达的影响
为了探究pGhHAK5驱动的在转基因拟南芥幼苗根中微弱的表达是否会受低钾胁迫诱导而增强, 对转pGhHAK5拟南芥幼苗进行低钾胁迫处理。结果与正常供钾(HK)水平相比, 低钾(LK)处理后pGhHAK5驱动在拟南芥幼苗根中的微弱表达并未显著增强(图6), 表明PGhHAK5驱动的在拟南芥幼苗的幼嫩根中的表达不受低钾胁迫诱导, 这可能是植株处于幼苗期时, 植物本身对外界环境中钾元素需求量比较低的缘故。这些研究结果表明本研究克隆的pGhHAK5可能是一个主要在成熟根中具有功能的低钾诱导型启动子。
2.7 GhHAK5基因的时空表达特性分析
为了验证pGhHAK5的功能, 对的时空表达特性研究表明, 在棉花幼苗发育前5 d (生长24~ 120 h),在根中表达量很低; 在棉花四片真叶期, 与发育前5 d相比,在根中的表达量迅速上升, 在叶片中的表达量一直很低(图7-A)。进一步荧光定量PCR分析表明, 在棉花四片真叶期,在根中的表达量迅速升高, 而在叶片中的表达量一直处于较低水平(图7-B), 该结果与转录组分析结果相一致。另外, 与子叶期幼嫩的根相比(图7-C),在四叶期根中表达要显著高于其在子叶期幼嫩根中的表达(图7-B)。这些结果表明在根中的表达受发育时期的影响, 该结果与转pGhHAK5拟南芥植株根系GUS染色结果相一致; 另外, 本研究观察到的在叶片中较低的表达也与基因是一个主要在根中负责外界环境中钾离子吸收的功能相一致。

图5 转pGhHAK5拟南芥植株的GUS组织化学染色
A: 野生型拟南芥; B: 转pGhHAK5拟南芥; 1~4: 拟南芥幼苗(1)及其叶片(2)、胚轴(3)和根(4)对应位置放大图; 5~12: 成熟期拟南芥植株的叶片(5)、茎(6)、花(7)、花对应位置放大图(8)、荚(9)、荚对应位置放大图(10)、根(11)和根对应位置放大图(12)。
A: wild-typeseedlings; B: pGhHAK5 transgenic; 1–4:seedlings (1) and enlarged view of its leaf (2), hypocotyl (3) and roots (4); 5–12: the leaf (5), stem (6), flower (7), enlarged view of flower (8), pod (9), enlarged view of pod (10), roots (11), and enlarged view of roots (12) in mature period
3 讨论
KUP/HAK/KT钾转运体家族, 对植物钾营养的吸收具有重要作用。由于土壤中钾离子的浓度往往低于植物生长发育所需的浓度, 植物常常处于低钾环境[28]。已有研究发现, 许多高亲和性的钾转运体基因, 例如拟南芥[29]以及其同源基因大麦[30]、番茄[31]、水稻[32]和陆地棉[18]等, 它们的表达均受低钾条件诱导。研究这些基因表达调控的分子机制, 并通过基因工程手段提高这些基因的表达水平, 对于提高植物的钾吸收效率具有重要意义。本研究对陆地棉钾转运体基因启动子序列分析发现, pGhHAK5除了含有基础元件外, 还含有多个参与光、植物激素、逆境胁迫和生物钟等顺式作用元件(表1和图2), 这些元件的存在, 暗示着基因的表达可能受多种外界条件的影响。先前研究表明, 陆地棉基因的表达受低钾胁迫诱导[18], 但其他逆境胁迫或者养分胁迫是否也能引起基因表达的变化目前还不清楚。在拟南芥中,的表达除受低钾诱导外, 还受其他的一些逆境条件如低钙、盐胁迫和ABA胁迫等不同程度影响[33]。另外, 氮(NO3-)和磷(P)也可诱导拟南芥和番茄基因表达水平的升高[34]。因此, 在今后的研究中, 有必要在多种逆境胁迫或养分胁迫条件下来进一步研究的表达特性。

图6 转pGhHAK5拟南芥幼苗对低钾胁迫的响应
WT: 野生型拟南芥; HK: 正常钾; LK: 低钾。a: 拟南芥幼苗; b: 叶对应位置放大图; c: 根对应位置放大图。
WT: wild typeseedlings; HK: high potassium; LK: low potassium. a:seedlings; b: enlarged view of leaf; c: enlarged view of roots.

图7 陆地棉GhHAK5基因的时空表达特性分析
A: 陆地棉基因时空表达特性的转录组分析; B: 陆地棉基因时空表达特性的荧光定量PCR分析; C: 不同发育时期棉花根系形态的比较; **表示在0.01水平上差异显著。
A: transcriptome analysis of spatio-temporal expression ofin upland cotton; B: quantitative real-time PCR analysis of spatio-temporal expression ofin upland cotton; C: the comparison of roots morphological change at different development stages in cotton; ** Significant at the 0.01 probability level.
在许多植物中, 钾转运体基因的表达具有组织特异性, 其主要在根中表达[12,27,30,32]。本研究对pGhHAK5序列分析发现, pGhHAK5与同源基因的启动子一样, 具有参与根特异性表达的调控元件(ATAAAAT)(图3), 暗示着可能是一个在根中特异性高表达的基因。但是, 本研究对转pGhHAK5拟南芥植株的GUS组织定位分析发现, pGhHAK5驱动的主要在拟南芥成熟的根、叶脉、花萼维管束和胚轴维管束组织中表达(图5), 表明本研究克隆的pGhHAK5片段在拟南芥中不能驱动根特异性的表达调控模式, 尽管先前研究表明是一个在根中特异性高表达的基因[18]。同样地,也是一个在根中特异性高表达的基因, 然而将1.5 kb的启动子片段连上并进行烟草转化后发现, pEgHKK5驱动的除在烟草根中高表达外, 在叶脉和胚轴的维管束组织中也大量地表达[27]。在拟南芥中,基因启动子驱动的仅在拟南芥的根中表达, 本研究观察到的pGhHAK5驱动的非特异性组织表达模式, 可能是由于本研究克隆的启动子片段缺乏一些其他的重要组织特异性调控元件, 也或者是由于pGhHAK5可能需要与棉花中特异的转录因子结合才能激活其组织特异性的表达调控模式。因此, 在今后的研究中, 有必要将pGhHAK5通过转化棉花植株来进一步研究其功能。
钾转运体基因的转录调控被认为是植物响应外界低钾胁迫的一项重要机制[35-37]。在拟南芥中, 钾转运体基因是维持植物在低钾条件下高效吸收环境中钾离子的重要基因, 其表达调控除受和两个转录因子影响外, 可能还有其他多个转录因子参与调控[38]。转录因子作为低钾条件下调控拟南芥表达的重要参与者, 该基因缺失的突变体与过表达植株具有相同的表型, 它们的高亲和性钾吸收能力均显著提升[14]。本研究克隆的陆地棉启动子具有1个在低钾条件下参与转录调控的与转录因子结合位点(TGTCNN), 说明转录因子可能参与陆地棉的表达调控, 但仍需进一步的实验研究。GCC-box位点是拟南芥启动子序列中可与转录因子结合的重要基序[39], 但是陆地棉启动子序列中不含有GCC-box位点, 表明陆地棉可能具有与拟南芥不一样的表达调控机制。总的来说, 基因的表达调控是一个非常复杂的过程, 一方面单个钾转运体基因表达可能受多个转录因子的调控, 另外多个激酶参与的转录后调控在植物响应钾缺乏和增强钾吸收方面也起着重要作用[40]。因此, 在以后的研究中, 如何将反向遗传学, 如表达数量性状定位方法(eQTL)[41]与正向遗传学的方法相结合来鉴定调控表达的关键因子, 对于我们深入认识陆地棉响应低钾胁迫的分子机理和调控网络至关重要。
4 结论
从陆地棉品种百棉1号中克隆了钾转运体基因上游2000 bp的启动子片段pGhHAK5, 并构建融合表达载体pGhHAK5::GUS。通过转化拟南芥表明pGhHAK5能在拟南芥中驱动的表达, 且其驱动的主要在拟南芥成熟的根和地上部维管束组织中表达, 在幼嫩的根中表达很弱且不受低钾胁迫诱导, 表明本研究克隆的pGhHAK5可能是一个主要在成熟根中具有功能的低钾诱导型启动子。
[1] 张志勇, 王清连, 李召虎, 段留生, 田晓莉. 缺钾对棉花幼苗根系生长的影响及其生理机制. 作物学报, 2009, 35: 718–723. Zhang Z Y, Wang Q L, Li Z H, Duan L S, Tian X L. Effect of potassium deficiency on root growth of cotton (L.) seedlings and its physiological mechanisms involved., 2009, 35: 718–723 (in Chinese with English abstract).
[2] 鲁如坤. 我国土壤氮、磷、钾的基本状况. 土壤学报, 1989, 26: 280–286. Lu R K. General status of nutrients (N, P, K) in soils of china., 1989, 26: 280–286 (in Chinese with English abstract).
[3] 孔祥强, 罗振, 李存东, 董合忠. 棉花早衰的分子机理研究进展. 棉花学报, 2015, 27: 71–79. Kong X Z, Luo Z, Li C D, Dong H Z. Molecular mechanisms of premature senescence in cotton., 2015, 27: 71–79 (in Chinese with English abstract).
[4] 刘冬青, 刘锐. 转基因抗虫棉早衰与土壤肥力的相关性分析. 中国土壤与肥料, 2002, (6): 41–42. Liu D Q, Liu R. Correlation analysis between soil fertility and premature senescence of transgenic cotton., 2002, (6): 41–42 (in Chinese with English abstract).
[5] Pettigrew W T, Meredithjr W R. Dry matter production, nutrient uptake, and growth of cotton as affected by potassium fertilization., 1997, 20: 531–548.
[6] 李书田, 邢素丽, 张炎, 崔荣宗. 钾肥用量和施用时期对棉花产量品质和棉田钾素平衡的影响. 植物营养与肥料学报, 2016, 22: 111–121. Liu S T, Xing S L, Zhang Y, Cui R Z. Application rate and time of potash for high cotton yield, quality and balance of soil potassium., 2016, 22: 111–121 (in Chinese with English abstract).
[7] 宋美珍, 毛树春. 钾素对棉花光合产物的积累及产量形成的影响. 棉花学报, 1994, 6(增刊): 52–57. Song M Z, Mao S C. Effects of potassium on photosynthetic matter accumulation and yield., 1994, 6(suppl): 52–57 (in Chinese with English abstract).
[8] 房慧勇, 张桂寅, 马峙英. 转基因抗虫棉抗黄萎病鉴定及黄萎病发生规律. 棉花学报, 2003, 15: 210–214. Fang H Y, Zhang G Y, Ma Z Y. Disease dynamic and resistance identification to Verticillium wilt of transgenic cotton., 2003, 15: 210–214 (in Chinese with English abstract ).
[9] 陈光, 高振宇, 徐国华. 植物响应缺钾胁迫的机制及提高钾利用效率的策略. 植物学报, 2017, 52: 89–101. Chen G, Gao Z Y, Xu G H. Adaption of plants to potassium deficiency and strategies to improve potassium use efficiency., 2017, 52: 89–101 (in Chinese with English abstract).
[10] Maathuis F J M, Sanders D. Regulation of K+absorption in plant root cells by external K+: interplay of different plasma membrane K+transporters., 1997, 48: 451–458.
[11] Maathuis F J, Sanders D. Mechanism of high-affinity potassium uptake in roots of., 1994, 91: 9272–9276.
[12] Ahn S J, Shin R, Schachtman D P. Expression ofgenes inand the role of root hairs in K+uptake., 2004, 134: 1135–1145.
[13] Véry A A, Nieves-Cordones M, Daly M, Khan I, Fizames C, Sentenac H.Molecular biology of K+transport across the plant cell membrane: What do we learn from comparison between plant species?, 2014, 171: 748–769.
[14] Zhao S, Zhang M L, Ma T L, Wang Y. Phosphorylation of ARF2 relieves its repression of transcription of the K+transporter genein response to low potassium stress., 2016, 28: 3005–3019.
[15] Kim M J, Ruzicka D, Shin R, Schachtman D P. TheAP2/ERF transcription factor RAP2.11 modulates plant response to low-potassium conditions., 2012, 5: 1042–1057.
[16] Ragel P, Ródenas R, García-Martín E, Andrés Z, Villalta I, Nieves-Cordones M, Rivero R M, Martínez V, Pardo J M, Quintero F J, Rubio F. CIPK23 regulates HAK5-mediated high-affinity K+uptake inroots., 2015, 169: 2863–2873.
[17] Rushton, P. J. Synthetic plant promoters containing defined regulatory elements provide novel insights into pathogen- and wound-induced signaling., 2002, 14: 749–762.
[18] 晁毛妮, 温青玉, 张志勇, 胡根海, 张金宝, 王果, 王清连. 陆地棉钾转运体基因的序列特征及表达分析. 作物学报, 2018, 44: 236–244. Chao M N, Wen Q Y, Zhang Z Y, Hu G H, Zhang J B, Wang G, Wang Q L. Sequence characteristics and expression analysis of potassium transporter genein upland cotton (L.)., 2018, 44: 236–244 (in Chinese with English abstract).
[19] Zhang Z, Chao M, Wang S, Bu J, Tang J, Li F, Wang Q, Zhang B. Proteome quantification of cotton xylem sap suggests the mechanisms of potassium-deficiency-induced changes in plant resistance to environmental stresses., 2016, 6: 21060.
[20] Zhang T, Hu Y, Jiang W, Fang L, Guan X, Chen J, Zhang J, Saski C A, Scheffler B E, Stelly D M, Hulse-Kemp A M, Wan Q, Liu B, Liu C, Wang S, Pan M, Wang Y, Wang D, Ye W, Chang L, Zhang W, Song Q, Kirkbride R C, Chen X, Dennis E, Llewellyn D J, Peterson D G, Thaxton P, Jones D C, Wang Q, Xu X, Zhang H, Wu H, Zhou L, Mei G, Chen S, Tian Y, Xiang D, Li X, Ding J, Zuo Q, Tao L, Liu Y, Li J, Lin Y, Hui Y, Cao Z, Cai C, Zhu X, Jiang Z, Zhou B, Guo W, Li R, Chen Z J.Sequencing of allotetraploid cotton (L. acc. TM-1) provides a resource for fiber improvement., 2015, 33: 531–537.
[21] Trapnell C, Williams B A, Pertea G, Mortazavi A, Kwan G, van Baren M J, Salzberg S L, Wold B J, Pachter L. Transcript assembly and quantification by RNA-seq reveals unannotated transcripts and isoform switching during cell differentiation., 2010, 28: 511–515.
[22] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCTmethod., 2001, 25: 40 2–408.
[23] Clough S J, Bent A F. Floral dip: a simplified method for Agrobacterium-mediated transformation of, 1998, 16: 735–743.
[24] 李红. 拟南芥转运蛋白NRT1.5/NPF7.3调控K+在木质部装载的分子机制研究. 中国农业大学博士学位论文, 北京, 2016.Li H. Mechanism Analyses of NRT1.5/NPF7.3-Mediated K+Realase into the Xylem in. PhD Dissertation of China Agricultural University, Beijing, China, 2016 (in Chinese with English abstract).
[25] Jefferson R A, Kavanagh T A, Bevan M W. GUS fusions: beta-glucuronidase as a sensitive and versatile gene fusion marker in higher plants., 1987, 6: 3901–3907.
[26] Christ A, Maegele I, Ha N, Hong H N, Crespi M D, Maizel A. In silico identification and in vivo validation of a set of evolutionary conserved plant root-specific-regulatory elements., 2013, 130: 70–81.
[27] Costa C S, Bravo J P, Ribeiro C L, Soprano A S, Sassaki F T, Maia I G. Vascular expression driven by the promoter of a gene encoding a high-affinity potassium transporter HAK5 from., 2017, 131: 1–10.
[28] 王毅, 武维. 植物钾营养高效分子遗传机制. 植物学报, 2009, 44: 27–36. Wang Y, Wu W. Molecular genetic mechanism of high efficient potassium uptake in plants., 2009, 44: 27–36 (in Chinese with English abstract).
[29] Gierth M, Schroeder J I. The Potassium TransporterFunctions in K+deprivation-induced high-affinity K+uptake and AKT1 K+channel contribution to K+uptake kinetics inroots., 2005, 137: 1105–1114.
[30] Santa-María G E, Rubio F, Dubcovsky J, Rodríguez-Navarro A. Thegene of barley is a member of a large gene family and encodes a high-affinity potassium transporter., 1997, 9: 2281–2289.
[31] Wang Y H, Garvin D F, Kochian L V. Rapid induction of regulatory and transporter genes in response to phosphorus, potassium, and iron deficiencies in tomato roots. Evidence for cross talk and root/rhizosphere-mediated signals., 2002, 130: 1361–1370.
[32] Bañuelos M A, Garciadeblas B, Cubero B, Rodríguez-Navarro A. Inventory and functional characterization of the HAK potassium transporters of rice., 2002, 130: 784–795.
[33] 张彦桃, 王欣, 祁智, 亢燕. 拟南芥高亲和性钾转运体参与植物根对盐胁迫及ABA的反应. 华北农学报, 2014, 29(6): 214–219. Zhang Y T, Wang X, Qi Z, Kang Y.high-affinity potassium transporter5 participated in the response to salt stress and ABA in the plant root., 2014, 29(6): 214–219 (in Chinese with English abstract).
[34] Rubio F, Fon M, Ródenas R, Nieves-Cordones M, Alemán F, Rivero R M, Martínez V. A low K+signal is required for functional high-affinity K+uptake through HAK5 transporters.2015, 152: 558–570.
[35] Ashley M K, Grant M, Grabov A. Plant responses to potassium deficiencies: a role for potassium transport proteins., 2006, 57: 425–436.
[36] Wang Y, Wu W H. Potassium transport and signaling in higher plants., 2013, 64: 451–476.
[37] Chérel I, Lefoulon C, Boeglin M, Sentenac H. Molecular mechanisms involved in plant adaptation to low K+availability., 2014, 65: 833–848.
[38] Hong J, Takeshi Y, Kondou Y, Schachtman D P, Matsui M, Shin R. Identification and characterization of transcription factors regulatingHAK5., 2013, 54: 1478–1490.
[39] Kim M J, Ruzicka D, Shin R, Schachtman D P. TheAP2/ERF transcription factor RAP2.11 modulates plant response to low-potassium conditions., 2012, 5: 1042–1057.
[40] Li W, Xu G, Abdel A, Yu L. Plant HAK/KUP/KT K+transporters: function and regulation., 2018, 74: 133–141.
[41] Druka A, Potokina E, Luo Z, Jiang N, Chen X, Kearsey M, Waugh R. Expression quantitative trait loci analysis in plants., 2010, 8: 10–27.
Cloning and functional analysis of promoter of potassium transporter genein upland cotton (L.)
CHAO Mao-Ni1, HU Hai-Yan1,*, WANG Run-Hao1, CHEN Yu2, FU Li-Na1, LIU Qing-Qing1, WANG Qing-Lian1
1Henan Institute of Science and Technology / Henan Collaborative Innovation Center of Modern Biological Breeding, Xinxiang 453003, Henan, China;2Cotton Research Center of Shandong Academy of Agricultural Sciences, Jinan 250100, Shandong, China
Transcriptional regulation of KUP/HAK/KT potassium transporter gene is an important mechanism of plant response to low potassium stress. Cloning and analysis of promoter of potassium transporter gene in cotton is not only helpful to understand its expression pattern and regulation mechanism, but also important to improve the potassium absorption in cotton. Potassium transporter geneis a highly expressed in roots and induced by low potassium stress in upland cotton, but the function of its promoter is still unclear. In this study, the 2000 bp promoter fragment ofwas cloned from upland cotton variety Baimian 1 by using PCR amplification, and its function was analyzed by GUS histochemical staining and induced expression analysis ofunder low potassium in pGhHAK5 transgenic. In addition to TATA-box, CAAT-box and other basic-acting elements, pGhHAK5 also contained a number of-acting elements responsive to light, stress, phytohormone and circadian. pGhHAK5 was highly consistent with pGrHAK5 in the number and location of important regulatory elements, and had five root-specific expression regulatory elements (ATAAAAT) and an ARF transcription factor binding site (TGTCNN) involved in transcription regulation under low potassium conditions. GUS histochemical staining of transgenicseedlings showed that the leaf veins and vascular tissue of hypocotyl were deeply stained, and the roots were shallowly stained. For matureplants, enhanced GUS staining was observed in roots, leaf veins and the vascular tissue of calyx, and weakened GUS staining was observed in stem and pod skin, suggesting that pGhHAK5-drivenwas mainly expressed in mature roots and vascular tissue of shoots. Induced expression analysis ofunder low potassium in pGhHAK5 transgenicshowed that the expression ofdriven by pGhHAK5 was weak in young roots ofseedlings, and its expression was not enhanced by low potassium stress. These results suggest that pGhHAK5 might be a potassium-deficient inducible promoter mainly in mature roots. Transcriptome and quantitative real-time PCR analysis showed thatexpression in roots was affected by developmental stages, which was consistent with the results ofexpression driven by pGhHAK5 in. These results are helpful to understand the molecular mechanism ofexpression regulation, and provide theoretical basis for improving potassium uptake efficiency and breeding potassium efficient varieties in cotton.
promoter; vascular tissues; potassium transporter; low potassium; upland cotton
2019-04-25;
2019-08-09;
2019-09-12.
10.3724/SP.J.1006.2020.93027
胡海燕, E-mail: haiyanhuhhy@126.com, Te1: 0373-3040337
chaomaoni@126.com
本研究由国家自然科学基金项目(31601347),河南省博士后科学基金项目(1902042),河南省科技攻关计划项目(192102110030)和河南省高等学校重点科研计划项目(19A210013)资助。
This study was supported by theNational Natural Science Foundation of China (31601347), the Henan Postdoctoral Science Foundation (1902042), the Henan Scientific and Technological Research Program (192102110030), and the Key Research Projects of Henan Higher Education Institutions (19A210013).
URL: :http://kns.cnki.net/kcms/detail/11.1809.S.20190912.1507.002.html

