山西猪场猪蓝耳病并发猪胸膜肺炎放线杆菌的病毒鉴定及细菌分离鉴定以及治疗方案
张小敏,郭 波,段宝敏,冯敬敬,李 嘉,雷向东,陈家锃
(天津渤海农牧产业联合研究院有限公司,天津 300000; 天津瑞普生物技术股份有限公司, 天津 300000)
猪蓝耳病(PRRS)是由猪繁殖与呼吸综合征病毒(PRRSV)引起的一种高度接触性传染性疾病,是一种免疫抑制病,常继发或并发感染猪链球菌、鼻支原体、胸膜肺炎放线杆菌病[1]。猪传染性胸膜肺 炎(Porcine contagious pleuro pneumia, APP)是由胸膜肺炎放线杆菌引起以出血性纤维素性胸膜肺炎为病理特征的一种高度接触传染性呼吸道传染病,能引起猪急性纤维素性胸膜肺炎或慢性局灶性坏死性肺炎。猪传染性胸膜肺炎不分年龄阶段,各性别猪均易感染。给养猪业造成巨大的经济损失[2-4]。
2020年2月,山西某大型规模猪场一批体重40 kg左右的育肥猪表现呼吸困难,无过多症状表现,即突然死亡,发病率为2%,死亡率1.5%左右。根据死亡猪与病猪的临床症状综合诊断,初步怀疑病猪为猪繁殖与呼吸综合征并发APP感染引起的发病,为确定感染病原,无菌采集病死猪的肺脏、肝脏、脾脏病料,做病原RT-PCR检测猪繁殖与呼吸障碍综合征;通过细菌分离培养、镜检、PCR检测、16SrRNA基因序列进化树构建等实验室方法对分离菌进行系统分析,为该病的防治提供理论依据。
1 检测方案及治疗意见
1.1 病毒RT-PCR鉴定
无菌采集病料组织,用RTPCR技术对提取的病毒 RNA进行高致病性猪蓝耳病病毒初步鉴定。以总RNA为模板,Random Primer(6mer) 为引物,在M-MLV反转录酶作用下合成第一链cDNA。反转录体系为5×M-MLV Buffer 8μL,dNTP Mixture(2.5 mM)4μL,Random Primer(6mer)2μL,M-MLV反转录酶0.5μL,RNA酶抑制剂0.5μL,cDNA 模板25μL。反应程序为30 ℃10 min,42 ℃1 h,72 ℃15 min,冷却至室温,-20 ℃保存。PCR扩增反应体系如下:ddH2O 11.6μL,10 ×PCR Buffer 2μL,DNTP1.6μL,Taq酶0.3μL, 上、下游引物各1,模板2.5μL加去离子水至20μL,混合均匀。PRRSV引物扩增的反应程序为:95 ℃预变性3 min,94 ℃变性30 s,55 ℃复性 30 s,72 ℃延伸5 min,30个循环,最后72 ℃延伸10 min,4 ℃保存。用浓度1%琼脂糖凝胶进行电脉,电泳完毕后于紫外凝胶成像系统观察拍照。
1.2 细菌分离与鉴定
1.2.1 细菌分离与纯化
无菌采取肺脏病变部位接种于含1%NAD和5%胎牛血清的TSA琼脂平板置于37 ℃培养箱中培养12 h,无菌挑取单个菌落进行划线纯培养直至平板上长出的菌落完全一致。
1.2.2 细菌染色镜检
取载玻片一张,用灭菌接种环取少量菌涂于载玻片上磨匀。使其自然干燥。通过火焰2~3次固定(以不烫手为宜),染色:结晶紫—初染:1 min;碘液—媒染1 min;1~2 min 95%乙醇—脱色30 s;复红—复染1 min。
1.2.3 细菌PCR鉴定
吸取1mL TSB(含5%牛血清+1%NAD)培养基于1.5mL高压灭菌的离心管中,接种环灭菌后挑取疑似猪胸膜肺炎单菌落于离心管中,放入摇床中24 h。将营养液培养物取2μL作为模板,反应条件为:95 ℃变性10 min;然后进入30个循环,94 ℃1 min、49 ℃ 30 s、72℃ 30 s;最后72 ℃延伸5 min,4℃终止反应。
1.2.4 细菌16SrRNA 核苷酸遗传进化构建
将鉴定为猪胸膜肺炎的菌液重新进行PCR扩增,反应条件为95℃变性10 min;然后进入30个循环,94℃ 1 min、56 ℃ 30 s、72 ℃ 30 s;最后72 ℃延伸5 min,4℃终止反应。PCR产物由擎科生物科技有限公司测序,对测序结果进行核苷酸的同源性比较及构建系统进化树。
1.3 分离菌株的药敏试验
挑取TSA琼脂培养基(含1%NAD+5%牛血清)上的单个菌落于TSB(含1%NAD+5%牛血清)液体培养基中增菌培养约6~8 h后取菌液0.5mL均匀涂布于TSA琼脂培养基表面,待菌液吸收后均匀贴上安普霉素、安普霉素+氨苄西林、恩诺沙星、硫酸黏菌素、替米考星+氟苯尼考、替米考星+阿莫西林、氟苯尼考、头孢噻呋钠+硫酸黏菌素、头孢喹肟、头孢噻呋钠+新霉素、替米考星+头孢噻呋钠、多西环素、多西环素+氟苯尼考、头孢噻呋钠+阿莫西林、阿莫西林+克拉维酸钾、头孢噻呋钠+恩诺沙星、新霉素、头孢噻呋钠、安普霉素+头孢噻呋钠19种药敏纸片置37 ℃培养箱中培养12~24 h,用游标卡尺测量抑菌圈直径,参考药敏试验抑菌圈直径判定标准(WS-T125-1999) 判定药敏试验结果,确定待检分离菌株对药物的敏感性。
1.4 根据临床及检测结果制定治疗方案及处理意见
2 结果
2.1 剖检病变
剖检猪发现肺脏淤血、出血、坏死有纤维素性渗出物(见图1、图3)肝脏肿大、淤血(见图2)。
2.2 病毒HP-PRRSV RT-PCR检测
RT-PCR检测结果表明,送检样品均检出HP-PRRSV核酸阳性。阴、阳性对照成立(见图4)。
2.3 分离菌株的菌落形态特征
分离菌株在含 1%NAD和5%胎牛血清的TSA琼脂培养基上培养约12 h后形成表面光滑、圆形、凸起、湿润菌落直径为2~3 mm(见图5)挑取单菌落进行涂片,经革兰氏染色于油镜下观察为革兰氏阴性球杆菌,菌体细小,也可见杆状、丝状散在菌体(见图6)。
2.4 细菌PCR 鉴定结果
挑取疑似副猪胸膜肺炎放线杆菌菌落加入TSB+5%牛血清+1%NAD的液体培养基中,37 ℃培养24 h摇床培养,用菌液当作模板进行PCR检测。
PCR检测结果表明,1#APP核酸阳性。阳性、阴性对照成立。阳性对照扩增出分子量约为400 bp片段,与预期片段427 bp大小相符,阴性对照未扩增出任何片段表明扩增方法正确,因此PCR鉴定该菌为猪胸膜肺炎放线杆菌(见图7)。
2.5 分离菌株的16SrRNA基因鉴定结果
用细菌16SrRNA通用引物扩增目的序列,扩增的片段与预期目的片段1492 bp接近(见图8);测序结果分析表明:分离菌株(命名为HeB200229)与NCBI上的胸膜肺炎放线杆菌菌株有99.5%~99.7%的同源性(见图9),与大肠杆菌菌株84(登录号:MF399285.1)亲缘关系较远[4](见图10)。
分离菌株16SrRNA基因PCR扩增结果表明,1#16SrRNA核酸阳性。阳性、阴性对照成立。
2.6 药敏试验结果
药敏试验结果显示(见表1):分离菌株对安普霉素、硫酸黏菌素、替米考星+氟苯尼考、替米考星+阿莫西林、氟苯尼考、头孢噻呋钠+硫酸黏菌素、头孢喹肟、头孢噻呋钠+新霉素、替米考星+头孢噻呋钠、多西环素+氟苯尼考、头孢噻呋钠+阿莫西林、阿莫西林+克拉维酸钾、头孢噻呋钠+恩诺沙星、新霉素、头孢噻呋钠、安普霉素+头孢噻呋钠敏感;对恩诺沙星耐药。
3 临床及检测结果制定治疗方案及处理意见
根据检测结果高致病性蓝耳病毒核酸阳性及胸膜肺炎放线杆菌核酸阳性,结合药敏试验结果,制定治疗方案及处理意见如下。
3.1 群体防控
每吨饮水添加阿莫西林+克拉维酸钾500 g和卡巴匹林钙500 g自由饮水;每吨饲料添加替米考星肠溶颗粒1000 g和复合维生素1000 g混饲。
3.2 个体治疗
加大巡查频率和猪群观察时间,对早期发病猪只采取氟尼辛葡甲胺+氟苯尼考混合肌注,同时配合注射地塞米松和维生素C。
3.3 后期防控
肺纤毛受损是传染性胸膜肺炎发病的必要条件,分析诱发猪群肺纤毛受损的原因,解决通风问题,是否存在氨气过多,是否寒冷应激或者支原体感染,制定相应防控和改善措施。
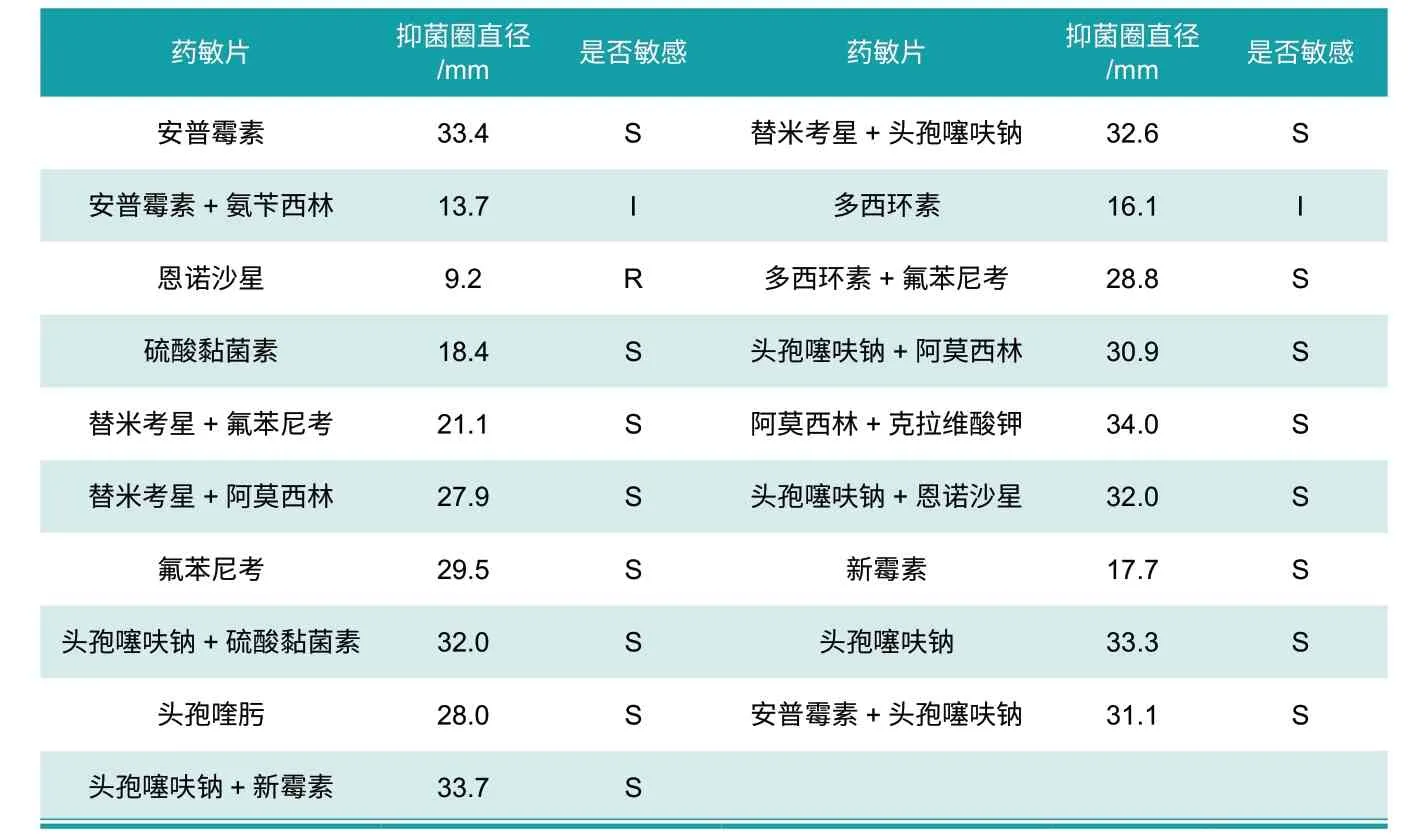
表1 药敏试验结果
4 小结
猪传染性胸膜肺炎是由胸膜肺炎放线杆菌引起的猪细菌性肺炎中危害最大的一种疾病,病原感染后可快速导致各阶段猪群纤维出血性、坏死性胸膜肺炎,机体因吸收大量细胞壁脂多糖引起内毒素休克快速死亡。发病到死亡一般不超过3 h,往往发现时已来不及治疗。
肺纤毛受损是发病的必要条件,主要因寒冷、氨气过多,支原体等引起。典型病例出现浅血色泡沫状鼻涕,非典型病例出现类似流感症状;发病耐过猪不注意管理可导致后期再暴发。耐过猪只应单独隔离饲养并尽早出栏,如果无条件隔离饲养的,需要定期对整个猪群进行药物预防,并做好通风、换气和日常消毒工作,防止二次发病。
本实验室根据临床症状、检测结果及药敏试验,分别对发病猪群饲料、饮水、发病个体和群体后期防控制定了治疗方案和处理建议,为该猪场猪繁殖与呼吸障碍综合征并发猪传染性胸膜肺炎的临床诊断及用药提供了理论依据。

