中华鲟的性腺发育与退化问题研究
高 欣 张富铁 常 涛 刘焕章
(中国科学院水生生物多样性与保护重点实验室, 中国科学院水生生物研究所, 武汉 430072)
中华鲟(Acipenser sinensis)是一种低等的硬骨鱼类, 是国家一级重点保护野生动物。中华鲟被认为是长江水生动物保护的旗舰物种和长江水生态系统健康状况的指示物种。近年来, 中华鲟多次被监测到未进行野外繁殖, 其生存前景堪忧。
有关中华鲟没有繁殖的原因存在多方面的争议, 包括三峡工程调度导致水文条件改变, 不能满足中华鲟繁殖的需求; 以及中华鲟繁殖亲本太少,难以自然配对繁殖, 等等。最新奇的一个论点是黄真理和王鲁海[1]提出的:在葛洲坝水利枢纽修建以后, 中华鲟的性腺退化严重, 是导致中华鲟种群数量减少的主要原因, 并宣称“中科院水生所有关否定中华鲟性腺退化的方法和材料, 是不充分和不可靠的”。这是一个关乎中华鲟保护的严重问题, 如果没有正确的源流认识, 任由谬论误导, 将极大地影响中华鲟未来的保护工作。
经过仔细研读中国科学院水生生物研究所(以下简称中科院水生所)的相关文献, 并分析黄真理等的系列文章就可以发现, 黄真理等没有亲自在长江对中华鲟洄游和繁殖实地调查的第一手资料和数据, 而是选择性地引用他人文章中的数据, 然后发挥想象力, 编造故事, 自我陶醉。而中科院水生所的研究结果是通过长期实地调查取得的, 具有客观性和科学性, 经得起推敲和质疑。本文试从中华鲟的性腺发育过程及退化的判断标准、中华鲟的生活史阶段及性腺状态、葛洲坝与三峡工程对中华鲟繁殖影响等方面, 论述中华鲟的性腺是否可以发育成熟? 是否存在性腺退化现象? 从而为中华鲟的保护提供科学合理的依据。
1 鱼类性腺的发育与退化过程
1.1 鱼类性腺的发育与退化过程
鱼类的生殖系统包括性腺(精巢、卵巢)和生殖导管(输精管、输卵管)。鱼类的生殖细胞可以分为6个发育时相, 对应地鱼类的性腺发育可以划分为6个时期, 即Ⅰ—Ⅵ期。其中Ⅰ—Ⅲ期为发育不成熟的性腺,Ⅳ—Ⅴ期为成熟性腺。对于一生多次产卵的鱼类来说, 性腺发育到Ⅳ期成熟, 可以产卵; 产卵过程中为Ⅴ期性腺, 这一时期极为短暂; 产卵完成后为Ⅵ期性腺。在一般情况下, 产卵后会慢慢恢复到Ⅱ期性腺,然后再发育成熟, 进入新的繁殖循环[2—5]。
性腺退化(Gonadal degeneration)现在一般是指性腺成熟(性腺Ⅳ期), 但因环境条件无法满足繁殖需求导致不产卵(排精)或者部分产卵(排精), 从而错过繁殖窗口期后性腺再被吸收的过程。也有研究将完全产卵和排精后, 性腺(Ⅵ期)回复到Ⅱ期的过程视为性腺退化。其特征是性腺逐渐萎缩、营养物质被吸收, 性腺会从Ⅳ或者Ⅵ期回到Ⅱ期[3—7]。性腺成熟与退化可以通过形态学、组织学观察和血清学检查来进行判断。
1.2 中华鲟“性腺退化”的由来
早在1971—1982年开展的葛洲坝工程“救鱼问题”论证过程中, 就有人“预测”中华鲟受到葛洲坝阻隔, 不能溯游到长江上游的产卵场, 性腺会退化。柯福恩等[8]首次“证实”了葛洲坝下中华鲟大规模性腺退化的问题。他们认为, 在葛洲坝工程修建后, 下游环境条件发生变化, 造成了大量的中华鲟出现性腺退化现象。他们分析了1984年4—5月和10—11月在葛洲坝下宜昌江段采集的中华鲟样本,认为存在很高比例的性腺退化, 性腺退化个体占繁殖群体个体总数的48.87%, 雄鱼性腺退化个体比例为29.41%, 雌鱼性腺退化个体比例达71.43%。特别是在10—11月的样本中, 除1尾雌鱼外其余9尾均存在性腺退化现象。
柯福恩等[8]定义中华鲟性腺退化的形态学标准为“雄鲟: 性腺上脂肪重比正常脂肪重的平均值减少50%以上, 精巢重比正常精巢重平均值减少或者增加10%以下; 或雄鱼性腺上的脂肪全部消耗完, 精巢重不超过1.5 kg的性腺为退化性腺。雌鲟: 性腺上脂肪基本消失或剩下很少, 卵径没有增大, 卵粒变色、变形, 成熟系数在10以下的卵巢为退化卵巢。”
我们认为, 以性腺上的脂肪多少作为标准判断中华鲟性腺是否退化是不合适的。研究发现, 对于西伯利亚鲟或者俄罗斯鲟的雄鱼, Ⅱ期精巢完全包埋在脂肪中, 性腺上脂肪约为性腺重量的80%—95%; 精巢发育至Ⅲ期时, 脂肪大量减少。雌鲟到Ⅱ期末, 卵巢也被大量脂肪包围; Ⅲ期时滤泡增长,卵膜层加厚, 性腺变长变大, 卵黄沉积, 脂肪会大量减少, 白色的、灰色的卵母细胞会增加。到IV期时, 无论雌雄鲟鱼的性腺上几乎都完全看不到脂肪[7]。同样, 中华鲟IV期时, 性腺脂肪已消失或仅有少量丝络状的脂肪组织[9, 10]。因此脂肪的减少、尤其Ⅲ期性腺发育过程中脂肪大量减少是鲟鱼正常发育过程中必然出现的现象。以此将其作为判断性腺退化的标准, 容易误将正常发育的中华鲟Ⅲ期性腺判断为退化性腺。
此外, 以“卵径没有增大, 卵粒变色、变形, 雌鲟性腺成熟系数低于10的即为退化”, 判断也不严谨。因为正常生长Ⅲ期雌鲟的卵径是较小的(中华鲟为2.0—3.7 mm, 俄罗斯鲟或者西伯利亚鲟为1.6—2.6 mm), 卵母细胞呈现多种颜色(黄、白、灰等), 卵巢中有卵原细胞和Ⅰ—Ⅲ时相的卵母细胞同时存在, 大小和形态各异, 此时中华鲟性腺成熟系数为3.2—13.6[7, 9, 10]。因此, 以此作为性腺退化的判断依据, 也极易将正常发育的Ⅲ期卵巢误判为退化性腺。
柯福恩等[8]观察到所谓退化中华鲟雌鲟“卵粒没有光泽, 呈灰白色、黄白色、浅褐色且带白色斑纹, 尤如麻雀蛋壳的花纹, 有的呈糊状花纹”, “卵粒的卵径波动在 2.1—3.3 mm, 平均2.75 mm, 成熟系数波动在4.91—9.68, 平均7.62。同一卵巢有的卵粒大小不均, 20尾鱼的卵巢都伴随白色点状的Ⅱ时相卵粒”, “大多数都是处在第Ⅲ时相的卵母细胞, 但也有第Ⅳ时相的卵母细胞”, “卵膜(放射带和胶质膜)加厚, 其厚度可增至42.19 μm”。实际上, 这些卵母细胞的大小、颜色、时相及卵膜结构等, 都比较符合雌鲟正常发育Ⅲ—Ⅳ期性腺的特征, 而不是性腺退化。
周春生等[9]和四川省长江水产资源调查组[10]详细记载了中华鲟性周期中已产卵性腺退化的特征:Ⅵ期时, 性腺松弛充血, 绝大部分成熟卵已排出, 残存在卵巢中的主要是结缔组织和排卵后脱落的滤泡膜。有少量未产出的过熟卵已处于退化过程中,这些卵粒已失去弹性, 体积膨大, 卵径可达8 mm,形状为不规则的球形, 呈灰褐色, 卵核和卵黄粒溶解或仅存少量卵黄粒, 卵膜变形, 厚度不均, 卵膜很易破裂。卵巢内除少量第Ⅳ时相卵母细胞外, 主要为第Ⅱ时相的卵母细胞, 黄白色, 数量较多, 卵径0.3—0.9 mm, 成熟系数2.5—5。Chebanov和Galich[7]也记载: Ⅵ期时, 性腺强烈充血, 结构松散, 开始时有明显的边界和膜层。但是, 如果错过了产卵期,性腺会出现再吸收, 随着再吸收过程的进行, 成熟卵母细胞界限越来越模糊; 成熟的雌鲟在繁殖温度下超过20d就会出现过熟卵子和滤泡上皮细胞的再吸收现象, 成熟卵母细胞形状变得不规则, 边界消失, 初级卵母细胞越来越清晰可见, 在某些情况下性腺会萎缩。柯福恩等[8]未报道中华鲟性腺有无充血情况, 所谓的退化性腺中卵母细胞时相也不符合。从鲟鱼类性腺发育的规律看, 柯福恩等[8]所谓判断为退化的性腺, 实际上是中华鲟正常的未发育成熟的性腺。
从1984年起, 柯福恩等就以人工繁殖的名义,申请捕捞中华鲟的亲鱼, 在20世纪90年代每年捕捞数十尾[11]。试问, 既然这些中华鲟的性腺已经“退化”, 那他们捕去干什么用呢?
2 中华鲟的生活史阶段及其在长江中的性腺发育过程
2.1 中华鲟在长江中的生活史阶段
中华鲟是一种洄游鱼类, 具有溯河产卵习性。中华鲟产卵场位于长江上游、金沙江下游, 其繁殖期为秋季10—11月。在产卵场孵化的中华鲟仔鱼于长江中生长和发育, 向下游洄游, 于次年4—5月到达长江口, 然后进入中国近海的大陆架水域, 进一步摄食和生长。在一般情况下, 中华鲟雌鲟13—26龄到达性成熟, 雄鲟8—18龄到达性成熟[10—12]。
每年6—7月, 在海中长大、即将成熟的中华鲟个体进入长江口, 溯江而上; 8—9月经过九江; 9月下旬至10月陆续进入湖北江段; 10—11月份, 上溯至四川, 并在产卵场下游附近江段的深潭或坑洼中越冬, 在翌年秋季10—11月再进入产卵场进行繁殖。由于中华鲟进入长江后, 到完成其繁殖全过程需要15个月以上的时间, 因此, 每年的6—11月会在长江不同江段发现处于不同洄游阶段的两类中华鲟繁殖群体。其中在湖北及以下江段发现的中华鲟群体, 通常是当年进入长江等待翌年繁殖的亚成熟个体, 即新股群; 而在上游江段发现的中华鲟群体则同时包括当年进入长江的亚成熟个体(新股群), 和上年进入长江准备当年繁殖的成熟个体(老股群)[10]。根据历史上合江至屏山江段的捕捞情况来看, 每年10—11月繁殖季节捕获的主要是性腺发育成熟的老股群, 而性腺处于Ⅲ期的亚成熟个体主要出现在12月以后。随着葛洲坝工程的修建, 阻隔了中华鲟的洄游路线, 这也导致中华鲟在坝下大量聚集, 并同时存在新老两个股群, 而新股群的越冬场也由四川江段下移至长江中游江段。
产后亲鲟的洄游过程在不同产卵场存在差异。四川省长江水产资源调查组在长江上游原产卵场的调查认为, 产后亲鲟大部分迅速降河返回海洋育肥; 而在葛洲坝产卵场, 王成友[13]对4尾精巢Ⅳ期的雄鲟标记放流发现, 其繁殖后并不立即离开产卵场, 而是在产卵场徘徊最长达148d, 这意味着雄鲟从进入产卵场到离开约经历20个月, 而雌鲟则是立即离开。相关研究显示, 中华鲟降河洄游的速度较快, 只需花费约15d的时间就可完成整个迁移过程到达海中[14]。
2.2 中华鲟的性腺发育状态
研究表明, 中华鲟成鱼从第一年的夏季进入长江后, 到次年的秋季进行繁殖, 期间是停食的, 其性腺发育所需的能量消耗完全依靠身体积累的脂肪来维持[10]。其在不同的生活史阶段, 性腺发育状态不同; 在繁殖期后, 由于能量消耗极大, 雌鲟需要迅速返回海洋进行摄食。
在一般情况下, 每年进入长江的中华鲟性腺通常处于Ⅱ—Ⅲ期, 其中卵粒在不同个体中呈现黄色、褐色和灰色。灰褐色卵径较大, 平均2.45—3.07 mm, 黄色卵径略小, 平均2.19—2.62 mm。性成熟系数为3.2—13.6。卵粒包含在黄色脂肪内, 渔民称这样的卵巢为“油子”。而精巢呈乳白色, 性成熟系数较小, 为0.15—0.64。调查发现, Ⅲ期的鲟鱼通常6—9月份在河口、江苏、安徽、九江、湖北等江段中出现, 均为新股群。而9—11月在上游江段发现的鲟鱼中, 大部分个体卵巢处于Ⅳ—Ⅴ期,为上年进入长江的老股群。此时卵巢内卵径在3.71—4.90 mm, 多数为4.5 mm, 性成熟系数为14.8—19.5, 性腺中脂肪很少或无脂肪; 渔民称该时期的卵巢为“水子”。而精巢挤压或切割时有白色液体渗出, 性成熟系数在0.62—0.67变动[10]。
据相关研究报道, 沙市和宜昌江段曾分别在1979年和1980年的5月捕获到少量性腺处于Ⅳ期的“水子”鲟鱼[15], 说明这部分鲟鱼为上年进入长江,准备当年上溯参与繁殖的群体。由此可以推断, 在葛洲坝阻隔前, 中华鲟也能在湖北江段达到性腺成熟。
综上所述, 处于不同生活史阶段的中华鲟, 或者说中华鲟的新股群和老股群, 其性腺发育状态是不同的。据此分析, 柯福恩等[8]1984年4月采集的中华鲟是1983年从长江口上溯的待产亲鱼, 应该是老股群, 其将在1984年10—11月参加繁殖。4月取样时正是性腺发育时期, 卵粒直径2.9—3.3 mm, 成熟系数6.49—13.2(柯福恩等[8]表 2), “大多数都是处在第Ⅲ时相的卵母细胞, 但也有第IV时相的卵母细胞”(柯福恩等[8]性腺切片描述原文), 这表明这些卵巢符合正常发育卵巢的特征(Ⅲ—Ⅳ期), 并不是退化卵巢。
据危起伟等[14]的资料, 1984年中华鲟自然繁殖两次, 分别是10月16日和11月13日。那么柯福恩等[8]1984年10月19—31日采集的雌鲟样本中, 理论上包括三个类型的群体: 1983年上溯且已在1984年10月16日产卵的鱼(老股群1)、1983年上溯且即将于1984年11月13日产卵的鱼(老股群2), 及1984年上溯将在1985年秋季产卵的鱼(新股群)。老股群1鲟鱼已完成正常的生殖活动, 繁殖后性腺吸收会从Ⅵ期慢慢回复到Ⅱ期, 符合性周期规律。老股群2鲟鱼性腺达到成熟即将参与11月的繁殖, 柯福恩等[8]表2中性成熟系数达到23.33的那尾鱼属于老股群2。新股群鲟鱼则具有正常发育的尚未成熟的Ⅲ期卵巢。结合中华鲟雌鱼产卵后几小时内立即降河洄游的特点[14], 我们推断1984年10月16日产卵的雌鲟(老股群1)在10月19—31日不可能出现在产卵场附近。10月采集的10尾雌鱼样本中, 成熟系数达到23.33的雌鱼属于老股群2; 其他的个体推测是未发育成熟、将在1985年秋季产卵的鱼(新股群)。因此1984年10月的样本中也不存在性腺退化现象。
3 葛洲坝水利枢纽对中华鲟性腺发育的影响
3.1 葛洲坝水利枢纽对中华鲟性腺发育时间的影响
1963—1975年, 葛洲坝水利枢纽工程截流前,金沙江三块石、偏岩子、金堆子和长江上游铁炉滩、望龙碛等产卵场中华鲟第一次产卵的日期从10月11日至11月1日[10]。葛洲坝截流之后, 1983—2002年, 中华鲟第一次产卵的日期从10月13日至11月7日(图 1)[12, 16]。从时间范围来看, 没有明显的差异。
为了定量比较, 将10月1日假设为繁殖期的第一天, 以此量化中华鲟初次繁殖时间。葛洲坝工程截流前, 1963—1975年, 中华鲟繁殖时间为11—32d,中值为14d, 平均17d(SD=7d)。葛洲坝截流后, 1983—2002年, 中华鲟繁殖时间为13—38d, 中值为21d, 平均22d(SD=6d)。根据t检验分析, 葛洲坝截流前后,中华鲟在长江上游和中游的繁殖时间没有显著的差异(P>0.05)。结果表明, 葛洲坝对中华鲟的繁殖时间没有明显的影响。这也就意味着葛洲坝修建之后, 宜昌江段满足中华鲟的性腺发育条件和繁殖条件。洄游距离的改变没有影响中华鲟性腺发育与产卵繁殖的时间格局。这也说明Huang和Wang[17]依据洄游距离的模型预测完全脱离实际。
3.2 葛洲坝工程对中华鲟性腺发育成熟比例的影响
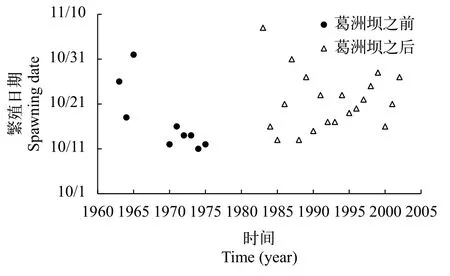
图 1 1963—2002年长江中华鲟的初次繁殖日期变化(此图用的是金沙江三块石、偏岩子、金堆子和长江上游铁炉滩、望龙碛等产卵场中华鲟第一次产卵的日期) [10, 12, 16]Fig. 1 Changes on spawning date of Chinese sturgeon in the Yangtze River from 1963 to 2002 (The figure shows the first spawning dates of Chinese sturgeon in Sankuaishi, Pianyanzi and Jinduizi sites in Jinsha River and Tielutan and Wanglongqi sites in the upper Yangtze River) [10, 12, 16]
中华鲟亲鱼需要在长江中滞留1年以上才能完成繁殖活动。长江中会存在当年繁殖的老股群和次年繁殖的新股群, 如果繁殖群体数量保持相对稳定, 在繁殖季节, 正常的性腺成熟个体比例为50%左右[12, 18], 即老股群的个体均可达到性腺成熟。
1981—1998年中华鲟繁殖群体性腺发育成熟个体的平均比例范围为13.2%—92.6%[12, 18—20], 平均值61.6%(SD=26.8%, 图 2)。1981年1月4日葛洲坝截流, 1980年6—10月进入长江的新股群, 部分通过葛洲坝到长江上游, 部分在葛洲坝下游发育。因此1981年10—11月的繁殖季节中, 葛洲坝下游繁殖群体性腺发育成熟的个体比例偏少。1982年和1983年性腺成熟个体比例为13.2%和20.5%, 明显少于50%。这是因为1981年和1982年过度捕捞造成次年性腺成熟个体比例减少[18]。
1983年,我国全面禁止中华鲟的商业捕捞,1984—1990年葛洲坝下游宜昌江段的中华鲟每年捕捞量降为约62—120尾[12]。因此, 1984—1990年,中华鲟性腺成熟个体比例恢复正常, 为37.9%—66.8%,平均53.4%(SD=8.8%); 1991—1998年, 中华鲟性腺成熟个体比例增加至77%—92.6%, 平均86%(SD=5.1%)[12, 20]。这些数据皆证明, 中华鲟繁殖群体中老股群的个体都能达到性腺成熟, 不存在大量性腺退化现象。
1991—1998年的性腺成熟个体比例明显大于1984—1990年(P<0.05)。性腺成熟个体比例增加的原因是, 葛洲坝水利枢纽修建阻隔了中华鲟的洄游通道, 长江上游产卵场丧失, 中华鲟产卵规模减少。1991年开始, 葛洲坝下游出生个体开始逐渐洄游补充进入繁殖群体, 但是新股群的数量少于老股群的数量, 导致性腺成熟比例增加。
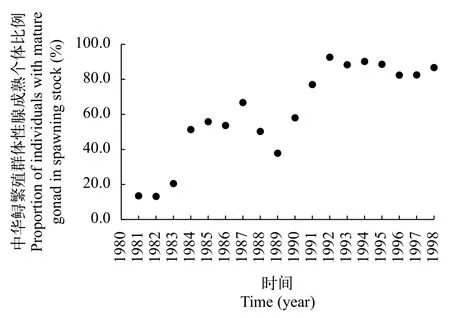
图 2 1981—1998年长江中华鲟繁殖群体性腺成熟个体比例变化[12]Fig. 2 Proportion changes of individuals with mature gonad in spawning stock of Chinese sturgeon in the Yangtze River from 1981 to 1998 [12]
以野外调查数据[12, 18—20]为依据的分析结果显示, 严重的过度捕捞会降低次年繁殖群体的性腺成熟个体比例; 当捕捞数量降低时, 性腺成熟个体比例会恢复到50%左右; 新股群数量减少会提高性腺成熟个体比例。同时, 结合周春生等[9]、陈金生等[21]研究结果显示, 在葛洲坝工程修建之后, 在没有受到过度捕捞影响的情况下, 中华鲟繁殖群体中性腺成熟个体比例是正常的, 没有所谓严重“性腺退化”的现象, 即不影响性腺正常发育成熟。
4 三峡工程对中华鲟繁殖的影响
三峡水利枢纽蓄水运行对中华鲟繁殖活动有明显的影响(图 3)。三峡水库蓄水运行造成中华鲟繁殖期产卵场下游水温滞后和流量减小[22], 导致中华鲟初次繁殖时间从10月中下旬推迟到11月底, 繁殖次数从每年2次减少到1次(2012年有2次)[16]。2013年、2015年、2017—2019年, 中华鲟在长江中没有进行繁殖活动。而根据中科院水生所的调查结果显示, 2017—2019年中华鲟繁殖群体数量已经减少至10—24尾, 难以自然配对繁殖。
5 关于中华鲟性腺退化问题的讨论
5.1 柯福恩等对中华鲟性腺退化现象的误判
柯福恩等[8]提出了中华鲟大规模性腺退化的问题。其研究认为, 在葛洲坝修建以后, 由于产卵环境条件发生改变, 导致中华鲟性腺发生退化,1984年4—5月和10—11月葛洲坝下宜昌江段雌鱼性腺退化个体比例为71.43%, 雄鱼性腺退化个体比例为29.41%, 性腺退化个体占繁殖群体个体总数的48.87%。
然而仔细分析柯福恩等[8]判断性腺退化的标准, 无论是以性腺上脂肪的重量, 还是以卵径的大小和性成熟系数低于10为标准, 都不能准确地判断是否为性腺退化。正确的判断必须是经历IV或者VI期后的性腺, 卵巢充血, 卵母细胞出现再吸收的情况。柯福恩等[8]判断为性腺退化的雌鱼应该是未发育成熟的鱼。同时, 柯福恩等[8]没有提供制定性腺退化标准的理论依据和数据基础, 也没有进行数据统计分析来验证该标准, 因此这些所谓“标准”从理论、数据和统计学等方面都没有实质的支撑。
中华鲟性腺退化观点的提出还存在着一定的时代背景, 即20世纪70、80年代, 葛洲坝救鱼之争,国家水产总局力主修建过鱼设施, 作为拯救中华鲟等珍贵稀有水生动物的主要保护措施[23, 24]。水利枢纽工程会造成洄游亲鱼性腺退化的观点则是支撑修建过鱼设施的依据之一[25]。1981年, 张亢西[25]就以俄国鲟和鳇为例, 提出了大坝会造成坝下洄游亲鱼性腺退化的观点, 并建议建设“水利枢纽渔业综合工程”, 例如鱼道。因此, 柯福恩等[8]并非提出中华鲟性腺退化的第一人, 而只是“印证”了这一观点。
5.2 黄真理等[1, 17]、柯福恩等[8]对中华鲟性腺发育过程的错误认识
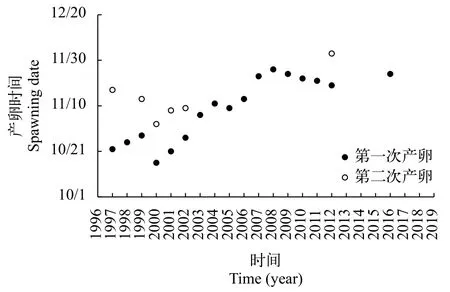
图 3 1997—2019年三峡工程蓄水前后中华鲟繁殖日期(2014年中华鲟的繁殖时间和地点不确定)Fig. 3 Spawning dates of Chinese sturgeon before and after impoundment of the Three Gorges Reservoir from 1997 to 2019(The spawning date and location are unknown in 2014)
从黄真理等[1, 17]、柯福恩等[8]对中华鲟性腺退化的观点看, 他们对于中华鲟的性腺发育过程存在若干错误的认识。首先, 黄真理和王鲁海[1, 17]通过建立性腺发育模型认为, 中华鲟的性腺发育与洄游距离相关; 在葛洲坝工程截流后, 由于洄游距离减少, 所以中华鲟性腺退化。这是十分荒谬的。据柯熏陶[15]报道, 沙市和宜昌江段曾分别在1979年和1980年春季(5月)捕获到性腺处于Ⅳ期的“水子”鲟鱼, 说明在葛洲坝工程阻隔前, 中华鲟就可以在湖北江段达到性腺发育成熟, 与洄游距离无关。在葛洲坝工程阻隔后, 中华鲟在坝下能够成功繁殖。1984—1998年, 繁殖雌鱼个体为年均72尾(26—163尾)或62尾(24—133尾)(常剑波[12]表5.15, 按照雌鱼平均怀卵量64.5万粒的产出率为100%计算)。危起伟等[14]也报道,1998年、2005年和2007年仅一批次繁殖活动中产卵雌鱼数量就可达154尾、159尾和176尾。这说明中华鲟在葛洲坝下可以大批量正常发育成熟。对葛洲坝建坝前后中华鲟繁殖的时间对比, 也没有发现差异。洄游距离的变化没有影响繁殖时间和性腺成熟。Huang和Wang[17]的性腺发育模型是闭门造车, 空中楼阁, 完全不符合中华鲟的实际情况。以是否符合模型的结果来讨论中华鲟的性腺退化问题, 无异于“郑人买履”,让实际的数据去迎合理论模型。
此外, 黄真理等[1, 17]、柯福恩等[8]对中华鲟性腺退化的认识也不符合中华鲟的生活史阶段的常识。黄真理和王鲁海[1]认为: 1981—1995捕捞的中华鲟中, “新股群和老股群都出现性腺退化”, 纯属凭空臆想。柯福恩等[8]认为1984年4月的样本中有退化的性腺, 这有悖于中华鲟性腺发育的规律。这些老股群鱼类还未到产卵期, 从性腺发育的卵径、时相和成熟系数来看, 都属于正常III—IV发育过程中的特征。他们还认为1984年10月的样本中, 新股群也存在性腺退化的现象。如果新股群刚刚进入长江不久, 性腺就退化, 性腺退化的胁迫原因是什么? 如果没有严重的胁迫因子, 性腺就发生退化, 这也有悖于鱼类生活史的一般特征。
5.3 黄真理等[1]对中华鲟相关研究数据的曲意歪解
除了对中华鲟性腺发育基本认识的错误之外,为了证明黄真理等(Huang和Wang[17])的观点, 黄真理和王鲁海[1]对中华鲟相关研究数据进行曲意歪解。他们认为1981年中华鲟的性腺退化率为70%,其使用的性腺成熟个体数来源于曹文宣等[26]和“胡兴祥(1989)”(注: 黄真理和王鲁海[1]文中引用的文献“胡兴祥. 葛洲坝鱼类救助工作综述”是不存在的,第七页是“水生所. 关于葛洲坝枢纽下游中华鲟自然繁殖的调查报告”一文[27])。当时, 曹文宣等和周春生等皆为中科院水生所第一研究室的同事, 1981年中华鲟性腺发育数据来源一致。周春生等[9]已经证实, 仅1982年调查到1尾雌鱼的卵巢有不正常现象,并且卵巢上有较多的脂肪。1981年没有中华鲟出现性腺退化的现象, 性腺退化率为0。曹文宣等[28]也没有提及中华鲟性腺退化的现象。然而, 黄真理和王鲁海[1]的文中却有意曲解数据, 认为除了11尾性腺发育到IV期或产过卵的中华鲟之外, 其余皆为性腺退化个体, 推算结果为70%的性腺退化率。该结果是严重地歪曲事实, 蓄意抬高性腺退化率。实际上, 1981年1月4日葛洲坝截流, 1980年6—10月进入长江的新股群, 部分通过葛洲坝, 部分在葛洲坝下游发育, 因此1981年10—11月繁殖季节葛洲坝下游繁殖群体中老股群数量较少, 导致性腺发育成熟个体比例偏少, 并非性腺退化造成[18]。
关于1996—1998年的性腺退化率为63.5%。黄真理和王鲁海[1]引用1997年的实际产卵雌鱼数量为18尾(数据来源于危起伟[29])。危起伟[29]文中明确指出, 18尾仅为第一次产卵雌鱼数量, 第二次产卵雌鱼数量不明。黄真理和王鲁海[1]选择引用数据, 明显低估雌鱼繁殖比例, 以此来提高性腺退化率。
此外, 黄真理和王鲁海[1]对陈金生等[21]的数据也进行了选择性的使用。黄真理和王鲁海[1]认为, 陈金生等[21]的“材料和方法部分语焉不详, 比如调查样本76尾, 来源模糊”, 而且附件记录中只有66尾样本的来源记录, 还差10尾, 并得出结论陈金生等的复核报告是不可靠的。然而, 在早期的研究中, 黄真理[30]却引用了陈金生等[21]的76尾数据为依据计算了1989年中华鲟繁殖群体数量。这说明黄真理等为了达到其不同的目的, 会特意选择性地使用数据。
同样, 黄真理和王鲁海[1]的结果显示, 葛洲坝截流之后中华鲟性腺退化十分严重, 性腺退化率为75.8%。根据该研究结果计算, 性腺成熟个体比例应小于24.2%。然而, 黄真理[30]的《利用捕捞数据估算长江中华鲟资源的新方法》和黄真理等[31]的《葛洲坝截流前后长江中华鲟繁殖群体数量变动研究》在计算中华鲟繁殖群体数量时, 引用的1984—1990年的性腺成熟个体比例均为51.1%—58%(该数据来源于赵燕等[18]和肖慧[20]), 明显高于24.2%。这是黄真理等选择性使用数据的证据, 同时也说明采用正确方法计算的结果与实际数据吻合, 用所谓性腺发育理论模型计算的结果则完全脱离实际。
5.4 中华鲟是否可以性腺发育成熟以及未来的保护措施
虽然葛洲坝水利枢纽修建阻隔了中华鲟的洄游通道, 造成中华鲟种群数量锐减[12, 32], 但是宜昌江段产卵场仍可以提供合适的繁殖条件[33], 满足每次平均34或38尾雌鱼完成繁殖活动[12]。这说明一般情况下, 中华鲟在葛洲坝下产卵场可以正常发育成熟, 并成功产卵繁殖。
如果中华鲟的繁殖活动和物种能够得到有效保护, 中华鲟的种群是有可能以较小的规模长期维持的[32]。然而, 中华鲟的保护效果并不好, 其繁殖群体数量持续减少。导致这种结果的原因是多方面的: 第一, 葛洲坝下中华鲟产卵场受到三峡工程蓄水运行、航道整治等影响[16, 22, 34], 中华鲟繁殖的环境条件常常受到人类活动干扰; 第二, 捕捞对中华鲟种群长期的不利影响[32]。中华鲟同白鱀豚、白鲟、长江江豚一样, 都是在20世纪80年代后期长江电缆捕鱼兴起后, 数量急剧减少, 并导致白鱀豚和白鲟功能性绝灭。目前, 长江实施了十年休渔政策, 但是在此前的多年时间里, 长江中捕捞压力巨大, 对中华鲟繁殖群体影响明显; 第三, 人工繁殖放流规模小对种群的补充效果不明显[32, 35—37], 自中华鲟的人工繁殖成功以来, 相对放流量太小, 难以遏制中华鲟种群下降的趋势。尽管如此, 目前没有确凿的证据表明中华鲟的性腺有大规模的退化现象。因此, 中华鲟的野生群体保护仍然具有希望。从目前存在的问题看, 未来中华鲟的保护需要采取多方面的措施, 包括野外产卵场的修复和繁殖条件的满足, 及更大的群体放流规模, 等等。我们相信,随着未来保护措施的落实, 中华鲟种群的恢复还是非常有可能的。
6 结语
中华鲟是长江的旗舰物种, 是长江生态系统健康的标志。保护中华鲟是我们大家的责任。保护中华鲟需要科学、客观地分析其所面临的困境, 因症施策, 这样才能保证措施的有效性。目前有关中华鲟大规模性腺退化的观点是错误的, 柯福恩等[8]对性腺退化判断的标准不科学, 将正常发育未成熟的III期性腺作为退化性腺处理, 甚至认为中华鲟刚刚进入长江不久即出现性腺退化, 不符合中华鲟性腺发育的规律。黄真理等[1, 17]沿袭了这一错误的认识, 并且以调查数据不符合他们的模型结果, 从而否定调查数据的正确性, 严重误导公众的认识。监测数据显示, 葛洲坝工程没有改变中华鲟繁殖的时间格局, 也没有改变中华鲟性腺成熟的比例, 黄真理等的性腺分析模型是脱离实际的。而且, 黄真理等[1]还将柯福恩等称为“吹哨人”, 一方面是将其错误认识以正确自居, 另一方面是想误导大众, 污蔑中科院水生所的正确观点。该论文已经不再是学术研究和探讨, 充满了恶意的攻击, 居心叵测。科学论文和期刊本应以科学探索和学术研究为主旨,可以百家争鸣, 而不是党同伐异。当然, 现阶段中华鲟的保护确实遇到了困境。但是, 我们相信, 如果加强中华鲟野外产卵场的修复和繁殖条件的满足, 进行更大规格、更大规模的群体放流, 中华鲟的种群还是有可能恢复的。
致谢:
本文承中国科学院水生生物研究所曹文宣院士提出修改意见, 特此致谢!
——以泉吉河为例

