基于响应面法的电芬顿降解活性黑5性能研究
陈于梁,成先雄,连军锋,黄雅莲,王明珠,袁俊
(江西理工大学 赣江流域水质安全保障工程技术研究中心,江西 赣州 341000)
我国每年排放大约1.6×106t的染料废水,约占工业废水的1/5[1]。染料废水具有色度高、成分复杂、毒性大、难生物降解等特点[2-3]。传统的生物法难以有效处理染料废水,而电芬顿法可以通过产生的·OH氧化染料废水中的有机物,处理效率高,便于操作,且几乎无二次污染[4],受到人们的广泛关注。
本实验以网状玻璃碳(RVC)为阴极、钌铱钛网为阳极,进行阴极电芬顿(EF)处理实验配制的活性黑5染料废水。考察最佳反应条件,采用响应面法确定各因素间的交互作用及优化参数。
1 实验部分
1.1 材料与仪器
活性黑5、无水Na2SO4、FeSO4·7H2O、H2SO4、NaOH均为分析纯。
UTP1306S 32V/6A 优利德直流稳压电源;PB-10型pH计;LZB-3WB玻璃转子流量计;AIR2000小型空气泵。
1.2 实验方法
实验装置主要由反应器(12 cm×12 cm×12 cm)、电极、直流稳压电源、空气泵组成。阳极为钌铱钛网(5 cm×5 cm),阴极为网状玻璃碳(RVC)电极(5 cm×5 cm×0.5 cm),极板间距为5 cm。底部曝气管曝气。
将pH为3的400 mL初始浓度200 mg/L活性黑5染料废水先曝气30 min,曝气强度为 1.5 L/min。加入1.0 mmol的FeSO4·7H2O,通入0.3 A的电流,开始反应,每隔30 min收集5 mL样品,反应120 min。立即用紫外-可见分光光度计进行分析。
1.3 分析方法
采用紫外-可见光分光光度计测定溶液在 600 nm 处的吸光度值,计算活性黑5溶液的脱色率。
脱色率=(1-At/A0)×100%
式中A0——初始吸光度;
At——反应t时间的吸光度。
2 结果与讨论
2.1 pH对脱色率的影响
在活性黑5初始浓度200 mg/L,电流强度 0.2 A,Fe2+用量1 mmol的条件下,pH对溶液脱色率的影响见图1。

图1 pH对脱色率的影响Fig.1 Effect of pH on decolorization rate
由图1可知,pH为3时,脱色率可达86.8%,当pH为2或4时脱色率减小。这是因为pH较小时,溶液中的H+过量,会发生H+得电子生成H2的副反应,影响H2O2的生成,影响溶液的脱色率。pH较大时,H+不足,产生的H2O2不足,而且pH较大时Fe2+和Fe3+易水解形成氢氧化物沉淀,·OH的生成量急剧减小,进而影响溶液的脱色率。
2.2 电流强度对脱色率的影响
在活性黑5初始浓度200 mg/L,pH为3,Fe2+用量1 mmol的条件下,电流强度对溶液脱色率的影响见图2。
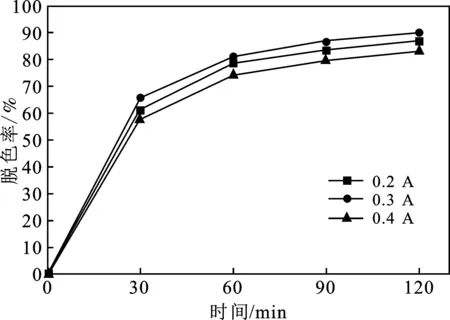
图2 电流强度对脱色率的影响Fig.2 Effect of current intensity on decolorization rate
由图2可知,电流强度0.3 A时,脱色率最高,可达90.1%。随着电流强度的增大,脱色率呈现出先增大后减小的趋势。随着电流强度的增大,阴极原位电解生成的H2O2增多,从而与Fe2+反应生成的·OH增多。但电流强度过高时,电解液温度升高,电流效率下降,析氢反应剧烈,产生大量小气泡,发生一系列副反应,对电极腐蚀严重,使得溶液脱色率下降。
2.3 Fe2+用量对脱色率的影响
在活性黑5初始浓度200 mg/L,pH为3,电流强度0.2 A的条件下,Fe2+用量对溶液脱色率的影响见图3。

图3 Fe2+用量对脱色率的影响Fig.3 Effect of Fe2+ dosage on decolorization rate
由图3可知,Fe2+用量为1 mmol时,脱色效果最佳。随着Fe2+浓度的增加,脱色率呈现出先增加后减小的趋势。这是因为当Fe2+浓度过低时,·OH 的量较少,故而脱色率较低。而Fe2+浓度过高时,会与·OH发生副反应,减少溶液中的·OH的量,故而脱色率会降低。
网状玻璃碳阴极电-Fenton降解活性黑5的最佳反应条件为:pH为3,电流强度为0.3 A,Fe2+用量为1 mmol。
2.4 响应面法优化工艺条件
2.4.1 实验设计 在单因素实验的基础上,利用响应面法Box-Behnken Design(BBD)(所用软件为Design Expert 8.0.6)对初始pH(A)、电流强度(B)和Fe2+浓度(C)进行优化,以脱色率(Y)为对应的响应值,实验因素水平见表1,结果见表2。

表1 因素水平及编码Table 1 Factor level and coding
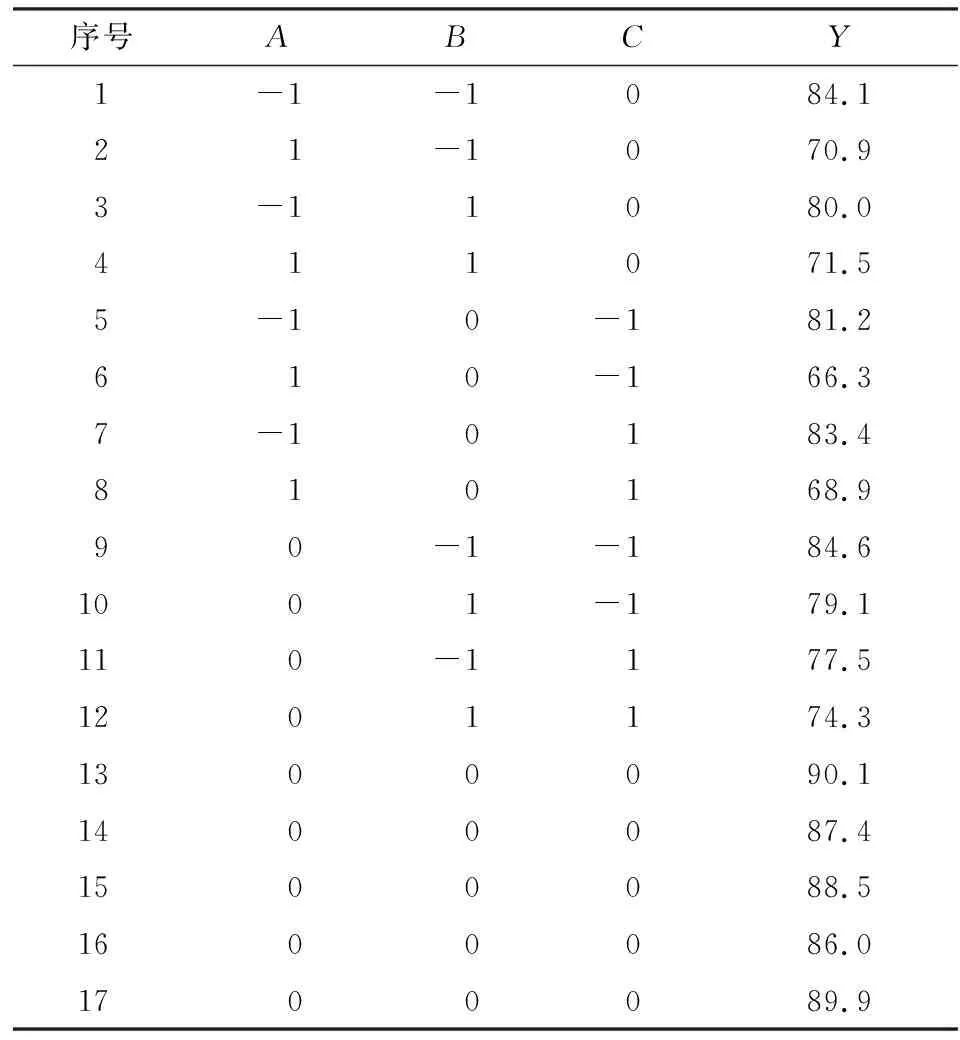
表2 实验结果Table 2 The experimental results
2.4.2 方差分析 利用响应面法软件Design Expert 8.0.6对实验数据进行回归分析,得二阶二次多项式回归方程:Y=88.38-6.39A-1.52B-0.89C+1.17AB+0.10AC+0.57BC-7.84A2-3.92B2-5.59C2,二次方程模型的方差分析见表3。
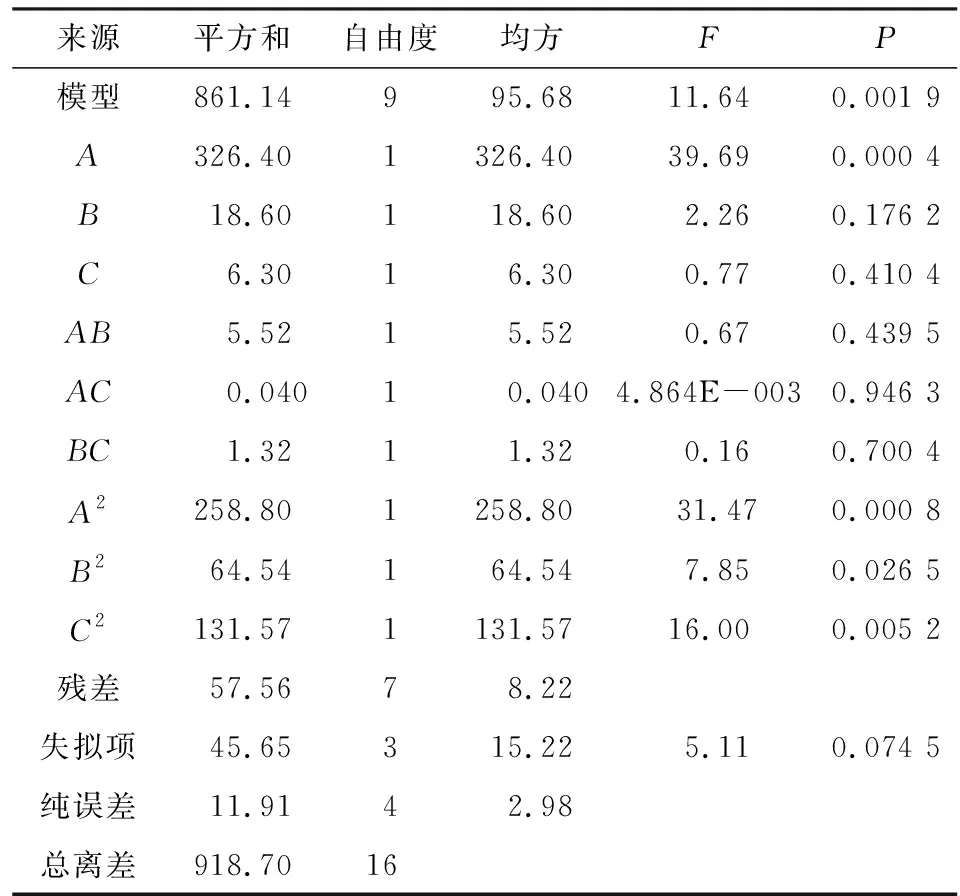
表3 回归方程的方差分析Table 3 Variance analysis of regression equation

图4为此电芬顿体系中得到的预测值与实际值的关系。横坐标为实际值,即实验实际得到的脱色率,纵坐标为预测值,即模拟方程预测的脱色率。

图4 脱色率预测值与实际值的关系Fig.4 Relationship between predicted value ofdecolorization rate and actual value
由图4可知,预测值与实际值较为接近,且数据点均匀地分布在直线Y=X的附近,表明此模拟方程能够很好地预测溶液的脱色率。
2.4.3 响应面分析 图5是各实验因素对脱色率影响的响应曲面图[6-7]。
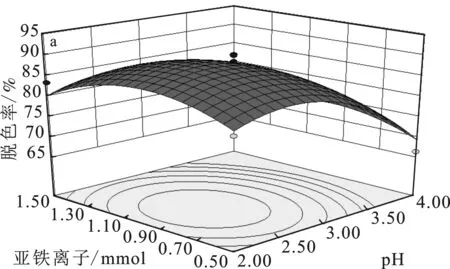

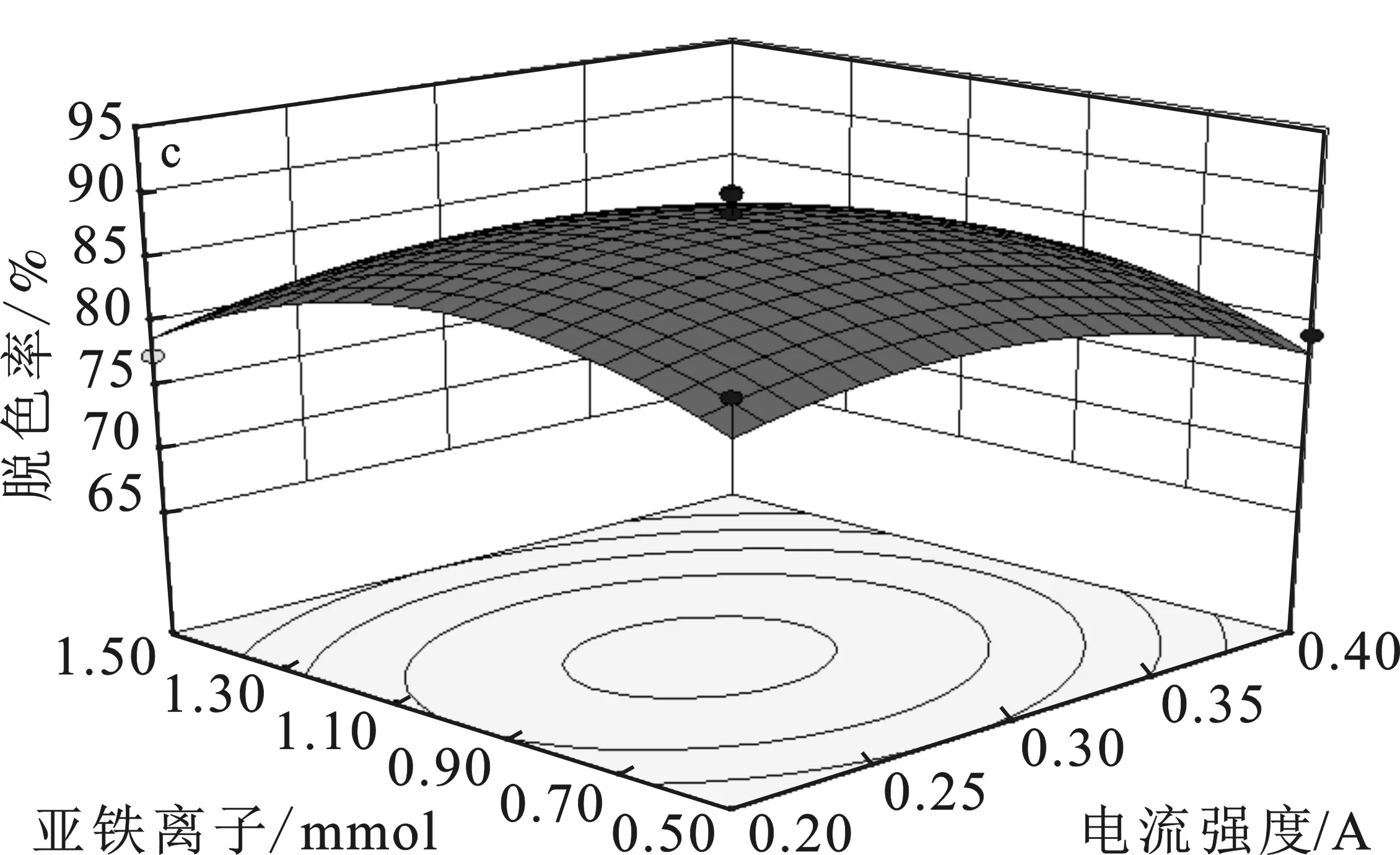
图5 各实验因素对脱色率影响的响应曲面图Fig.5 Response surface diagram of the influence ofvarious factors on the decolorization ratea.Fe2+用量和pH;b.电流强度和pH;c.Fe2+和电流强度
由图5a可知,当电流强度为0.3 A时,pH的影响比Fe2+用量更显著。由图5b可知,当Fe2+用量为1 mmol时,pH的影响比电流强度更显著。由 图5c可知,当pH为3时,电流强度的影响比Fe2+用量略微更显著。所以各因素对脱色率影响的显著性顺序为:pH>电流强度>Fe2+用量,并且pH和电流强度的交互作用最显著。
2.4.4 参数优化和模型的验证 利用Design Expert 8.0.6中的数值优化工具对最佳反应条件进行优化。优化后的反应条件为:pH为2.57,电流强度为0.27 A,Fe2+用量为0.95 mmol,相应的脱色率预测值为89.99%。为了验证模型方程得到的预测结果,在响应面法优化后的条件下进行了三组平行实验,得到了脱色率的平均值为88.67%,与预测值的偏差仅为1.80%。表明该模型能够比较可靠优化反应条件,有效地预测溶液的脱色率。
3 结论
网状玻璃碳阴极电芬顿降解活性黑5的最佳反应条件为:pH为2.57,电流强度为0.27 A,Fe2+用量为0.95 mmol。在此条件下,实际的脱色率平均值为88.67%,与模型的预测值只有1.80%的偏差。

