根际促生菌应用于基质对水稻幼苗生长的影响①
戚秀秀,魏 畅,刘晓丹,张林利,姜 瑛,张登晓
根际促生菌应用于基质对水稻幼苗生长的影响①
戚秀秀,魏 畅,刘晓丹,张林利,姜 瑛,张登晓*
(河南农业大学资源与环境学院,郑州 450002)
为了研究根际促生菌对水稻幼苗的促生效果,培育高效优质水稻育苗基质,本研究选用5株根际促生菌(LY5:枯草芽孢杆菌(),LY11:解淀粉芽孢杆菌(),X2:摩拉维亚假单胞菌(),X3:沙芬西芽孢杆菌(),X8:绿针假单胞菌()分别与本实验室已筛选出的最适配比基质进行混合制作高效水稻育苗基质,以不添加促生菌为对照,在盆栽条件下,研究根际促生菌对水稻幼苗生长和代谢的影响。结果表明:①解淀粉芽孢杆菌(LY11)应用于育苗基质对水稻幼苗的促生效果及代谢活性最好。②在育苗基质中添加根际促生菌后,地上部生物量和壮苗指数均比对照显著增加,增幅分别为17.24% ~ 31.19% 和11.37% ~ 23.28%。③添加根际促生菌的育苗基质能够促进水稻幼苗根系的生长,根体积、总根长等均比对照显著增加,且改善了根系形态结构,显著提高了根系活力。④根际促生菌处理显著促进了水稻幼苗对氮磷钾养分的吸收,且氮、钾的转运系数显著提高。⑤水稻幼苗体内谷氨酰胺合成酶和蔗糖磷酸合成酶活性在促生菌处理下均显著提高。因此,根际促生菌应用于水稻育苗基质能够促进秧苗的生长并提高其代谢活性,本研究结果能够为高效优质水稻育苗基质的研发提供理论支撑。
水稻;根际促生菌;育苗基质;根系构型;代谢活性
水稻作为主要粮食作物之一,在我国种植面积占总耕地面积的22.8%,总产量占粮食总产量的40%,其中2017年水稻总产量达2.13亿t[1]。目前我国水稻种植仍以育苗插秧为主,育苗是水稻生产的重要环节,水稻幼苗的生长状况对其定植及以后的生长发育和产量有着重要影响。通常采用肥力较高、生产性能好的稻田土壤作为基质进行育苗,然而这会造成耕层土壤大量流失和植被破坏等问题,不利于作物的可持续生产[2]。随着育苗需求的不断扩大,以草炭等为主要原料的育苗基质得到广泛应用,而草炭作为不可再生资源,其成本较高且不可再生。因此,研发优质高效可持续的水稻育苗基质对保障水稻产量具有重要意义。
利用来源广泛的生物质废弃物研发高效水稻育苗基质成为当前研究的热点[3-4],并且通过生物质循环利用,最大限度地减少废弃物对环境的影响。生物质废弃物经过堆肥腐熟后,性状适宜且养分释放充分,保水保肥性能好,可作为优良的基质原料[5-7]。并且其优良的物理、化学和生物学特性能够促进作物的生长[8-9]。生物质废弃物经腐熟产生的有机肥应用于基质中具有提高养分利用率、提高基质中微生物活性和养分转化,以及提高作物抗性等作用。有机肥自身含有较高的养分含量,能够为作物的生长提供直接养分来源。并且作为微生物代谢的碳源和能源,在基质中能够增加微生物的数量并且提高磷酸酶、脲酶等与养分转化相关酶活性[10-11],保障作物生长过程中对养分的需求。有机肥中含有大量的腐殖酸等物质通过鳌合或络合等过程对养分的释放起调控作用,减少养分损失并提高养分利用率[12]。因此,有机废弃物经腐熟后应用于作物基质中具有提高养分利用率和促进作物增长的潜力。
土壤自身包含很多微生物具有促生功能,通过溶磷、溶钾、固氮、产铁载体、产植物激素等机制直接或间接作用于植物,在作物生长过程中保障土壤养分的持续释放和作物对养分的吸收利用,从而能够促进植物生长。有研究发现,在作物育苗基质中加入促生菌具有促进作物幼苗生长和增加幼苗抗性的作用[13]。促生菌株的实际应用效果已得到广泛验证且效果显著,如Hamdali 等[14]从含无机磷酸盐的土壤中分离出8 株解磷菌,其代谢过程中释放的磷酸酶和有机酸等物质促进土壤中有机磷和稳定态磷的活化,从而使小麦地上部干物质重增长70%,根长增长30%。刘佳莉等[15]从盐碱土壤中分离出两株促生菌,用其处理燕麦种子,对燕麦生长的促生效果明显。姜焕焕等[16]指出,促生菌通过诱导产生植物激素、渗透调节物质和抗氧化防御物质等机制诱导植物自身抗胁迫机制的建立而增强作物抗性。然而促生菌的类型多,其代谢特性和生理功能等各有不同。因此,在不同的水稻育苗基质中筛选出适宜的促生菌类型,生产出高效的育苗基质对水稻生产具有重要意义。
基于此,本研究选用以生物质废弃物为主要原料的水稻育苗基质,通过添加不同的促生菌,研究其对水稻幼苗生长、养分吸收及其代谢活性的影响,探究出高效的育苗基质,以期为水稻的高效高产提供理论和应用依据。
1 材料与方法
1.1 试验材料
1.1.1 供试基质和稻种 供试基质为本实验室前期筛选出的优势配比水稻育苗基质[17],即(酒糟+秸秆)堆肥60% + 蛭石30% + 珍珠岩10%,以1.5% 的硫酸水溶液调节至pH 5.0左右。其中酒糟(由河南新乡龙泉酒业有限公司提供)和小麦秸秆(由河南省农业科学院提供)以C/N 28混匀,采用圆垛式堆肥,以人工堆积自然通风的方式,每3 d翻堆一次,至腐熟完成。
水稻种子是由广西恒茂农业科技有限公司提供,品种为两优1号。稻种在室内晾晒2 ~ 3 d后以20%盐水选种,去除秕子及杂物,清水洗去种子表面的盐分。水浸催芽,定期换水。待种子吸水膨胀出芽2 mm左右时,摊晾,备用。
1.1.2 促生菌悬液制备 LB 培养基:蛋白胨10 g,酵母粉5 g,NaCl 10 g,去离子水1 000 ml,pH 7.2 ~ 7.4,121 ℃ 高压灭菌20 min。
促生菌菌株为本实验室前期筛选出的具有较强固氮解磷能力的优势菌株[13],分别为:LY5:枯草芽孢杆菌(),LY11:解淀粉芽孢杆菌(),X2:摩拉维亚假单胞菌(),X3:沙芬西芽孢杆菌(),X8:绿针假单胞菌(),将已活化的促生菌接种于LB液体培养基,30 ℃、170 r/min振荡培养36 h,4 000 r/min离心10 min,用无菌水重悬-离心洗涤3次后,重悬于无菌水中,调节其浓度为108/ml,备用。
1.2 试验设计及管理
本试验共设6个处理,分别为CK(最适配比基质)、LY5(最适配比基质+菌LY5)、LY11(最适配比基质+菌LY11)、X2(最适配比基质+菌X2)、X3(最适配比基质+菌X3)、X8(最适配比基质+菌X8)。本试验所用育苗盘为580 mm´280 mm´30 mm带孔育苗盘,基质均匀平铺于盘中,将促生菌悬液均匀喷洒于基质表面,每盘喷洒50 ml,对照处理喷洒等量无菌水。每个处理重复3次,即播种3盘。按照常规生产方式装盘育苗,均匀撒种。每盘等量播种芽谷130 g,均匀喷水使基质含水量达到饱和状态并维持厚度约3 cm,播种后覆土,覆土厚度约0.1 cm,湿润覆土后覆膜保温保湿。各处理随机摆放并定时随机调整摆放位置。播种第22天采样,进行相关指标测定。
1.3 样品采集与测定
1.3.1 样品采集与处理 植株样品采集:每株幼苗从基质中取出,先用自来水冲洗掉基质颗粒,并用蒸馏水冲洗后从根茎连接处剪断,获取根系和地上部样品。其中每盘随机留取10株地上部样品,迅速置于–20 ℃ 冰箱中,备用,并将10株根系用根系扫描仪测定相应指标。随机留取100株样品分地上部和根系分别放置在信封中,于105 ℃ 烘箱中杀青30 min,80 ℃ 烘干至恒重,称重并保存备用。
1.3.2 分析项目和方法 1)植株农艺性状:株高、茎粗分别用直尺和游标卡尺测量;地上部干重采用烘干法测定。
2)根系测定:根系总长、根系总面积、根系平均直径、根系总体积和根尖总数用根系扫描仪(EPSON EXPERSSION 1680型)测定;根系活力的测定采用Leagene植物根系活力定性检测液(TTC法)检测[18]。
3)植株氮磷钾含量测定参照《土壤农化分析》[19]:用浓H2SO4-H2O2消煮,分别用凯氏定氮法、钼蓝比色法和火焰光度计法测定氮、磷、钾的含量。
4)SPAD值:采用叶绿素仪(SPAD-502)测定。
5)氮、磷、钾转运系数TF:
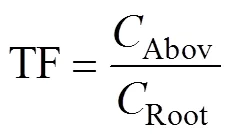
式中:Abov为地上部氮磷钾养分含量(g/kg),Root为根系氮磷钾养分含量(g/kg)。
6)植株地上部谷氨酰胺合成酶(GS)和蔗糖磷酸合成酶(SPS)活性测定:称取0.5 g植株地上部样品,加入6 ml 50 mmol/L的Tris-HCl (pH 7.6) 缓冲提取液(含2 mmol/L的MgSO4、0.5 mmol/L的EDTA、10 mmol/L的β-巯基乙醇)及少量石英砂后冰浴研磨,4 ℃ 下8 000 r/min离心20 min,保存上清液。谷氨酰胺合成酶(GS)和蔗糖磷酸合成酶(SPS)活性反应体系分别采用Zhang等[20]和薛应龙[21]的方法进行,用酶标仪(Multishan GO 1510,Finland)测定。
1.4 数据处理及分析
采用Excel 2003和Origin 8.5软件进行数据统计及作图。数据均采用平均值±标准差的形式表示,采用IBM SPSS Statistics 20进行数据方差分析,Duncan法进行多重比较,显著性水平为<0.05。
2 结果与分析
2.1 水稻植株生长
不同促生菌处理对植株农艺性状的影响如图1所示。与CK相比,5种类型促生菌的添加均显著提高了水稻幼苗株高,其中LY11和X8增加效果最好,达到5.15% 和6.50%(图1A)。对于茎粗和SPAD值来说,LY11处理显著高于CK,并且比其他促生菌处理显著提高(图1B、1C)。因此,从水稻幼苗农艺性状上看,促生菌加入育苗基质中能够促进水稻幼苗的生长,并且LY11的促生效果最好。不同促生菌处理均显著增加水稻幼苗地上部生物量,由图1D可知,促生菌处理下地上部生物量比CK处理增加幅度在17.24% ~ 31.19% 之间。其中,LY5、LY11和X8处理下生物量最大,且显著高于X3处理。同时,从壮苗指数上看,促生菌的添加显著提高了壮苗指数且不同促生菌之间差异较小(图1E)。因此,促生菌加入水稻育苗基质中能够显著促进幼苗的生长并提高秧苗质量。
2.2 根系形态结构
促生菌的添加显著影响水稻幼苗的根系形态结构(图2)。与CK相比,各促生菌处理下根系总长、根平均直径和根总体积分别显著增加了28.29% ~ 178.94%、18.60% ~ 65.22% 和15.65% ~ 99.32%,表明促生菌的添加促进了水稻幼苗根系的生长(图2A、2B、2C)。其中,LY11的增加幅度最大,其次为X8,而X2的增加幅度最低。促生菌处理对根表面积和根尖数的增加显著,说明促生菌不仅促进了根系的生长,同时增加了细根的数量,能够增加根系与土壤的接触,有利于促进养分吸收(图2D、2E)。并且LY11和X8处理使根尖数比对照分别增加了2.3倍和2.7倍。另外,促生菌的添加对水稻幼苗根系的影响不仅表现在根系形态结构上,而且显著提高了根系活力(图2F),提高幅度在20.86% 以上。
2.3 养分吸收与转运
从水稻幼苗地上、地下部养分含量看出(表1),促生菌处理显著促进了秧苗地上、地下部氮磷养分的积累,其中,地上部氮磷含量分别比CK处理增加67.80% ~ 104.92% 和34.17% ~ 171.76%,地下部氮磷含量分别提高89.59% ~ 149.09% 和4.23% ~ 71.64%,而且LY11和X8两种促生菌处理提高效果最好。而钾含量只有LY11和X8处理表现出显著性差异,地上部分别提高6.39% 和4.98%,地下部钾含量提高3.23% ~ 15.83%。因此,促生菌加入水稻基质中具有促进稻秧养分吸收的作用,并且不同类型促生菌之间表现出显著差异。

(图中小写字母不同表示处理间差异达P<0.05显著水平,下图同)

图2 不同处理对植株根系的影响
由于促生菌对水稻幼苗生物量积累的增加作用,养分吸收总量的变化比养分含量更大(表1)。特别是氮素在地上、地下部的养分吸收量均比CK处理增加1倍以上。磷素吸收量的增加幅度地上部超过57.43%,地下部介于9.69% ~ 89.17%。同时钾素的吸收量与CK相比增幅介于11.24% ~ 39.61%。总之,促生菌加入水稻育苗基质中能够显著促进植株对养分的吸收,对实现养分高效利用具有重要作用。
通过氮磷钾养分的转运系数能够看出(表2),几种促生菌处理下水稻幼苗中氮素的转运系数(1.46 ~ 1.64)均比CK处理(1.78)相对降低,即在根系中的积累大于地上部。磷素的转运系数在LY5和LY11处理下分别为1.24和1.23,比CK处理显著增加,而其他促生菌处理下差别较小。钾的转运系数在各处理间差别不明显。从该结果中能够看出,促生菌加入水稻育苗基质中能够影响植株体内养分的运移,而其作用效果与促生菌类型有关。
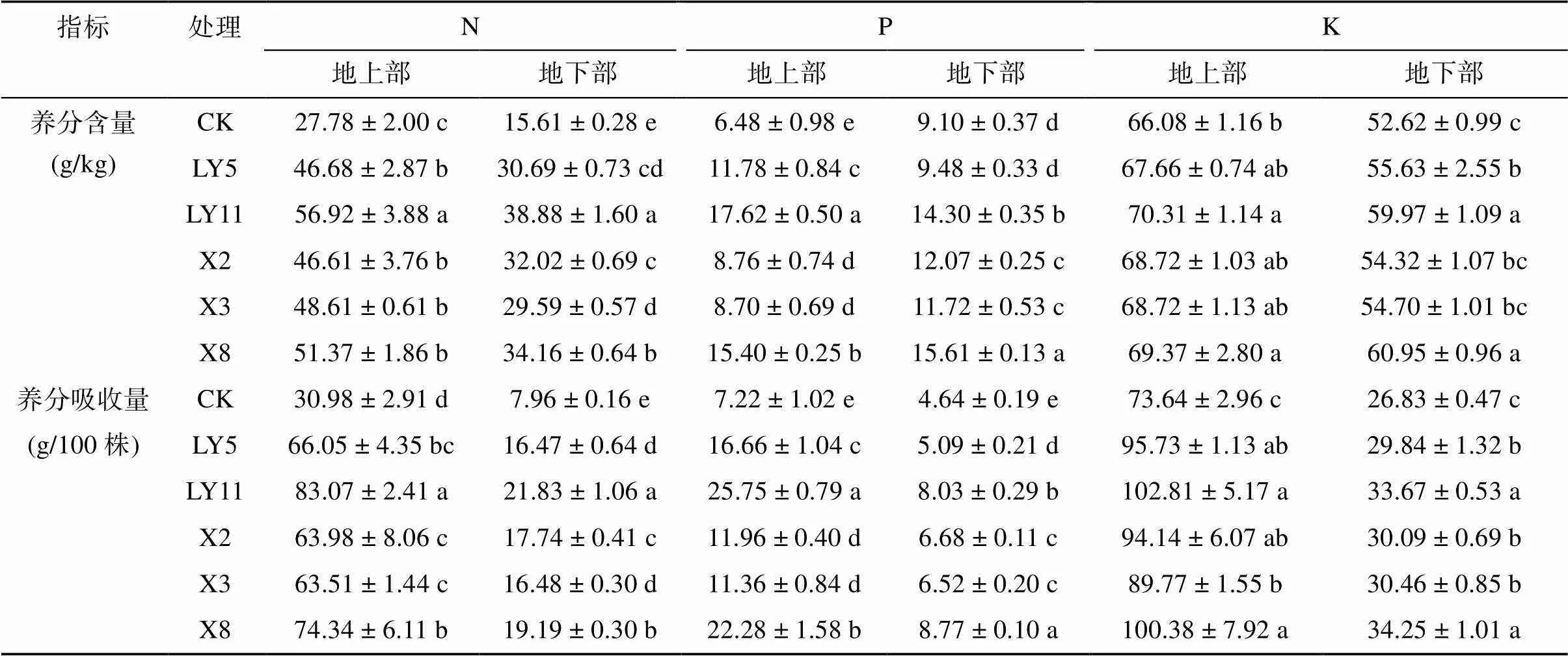
表1 不同处理对植株养分含量和吸收量的影响
注:同列数据小写字母不同表示处理间差异达<0.05显著水平,下表同。

表2 不同处理对植株氮磷钾转运系数的影响
2.4 地上部谷氨酰胺合成酶和蔗糖磷酸合成酶
谷氨酰胺合成酶(GS)和蔗糖磷酸合成酶(SPS)在植物碳氮代谢过程中起着重要作用,与植株生物量的积累和养分的转运过程密切相关。GS酶活性在促生菌的处理下提高了14.61% ~ 39.27%,且LY11、X2和X8处理下酶活性最高(图3A)。另外,SPS酶活性在LY5、LY11、X3和X8处理下分别提高了14.22%、35.61%、21.43% 和7.02%,X2处理下没有表现出显著性差异(图3B)。因此,这可能是影响植株氮素累积和转运,以及生物量积累的因素之一。
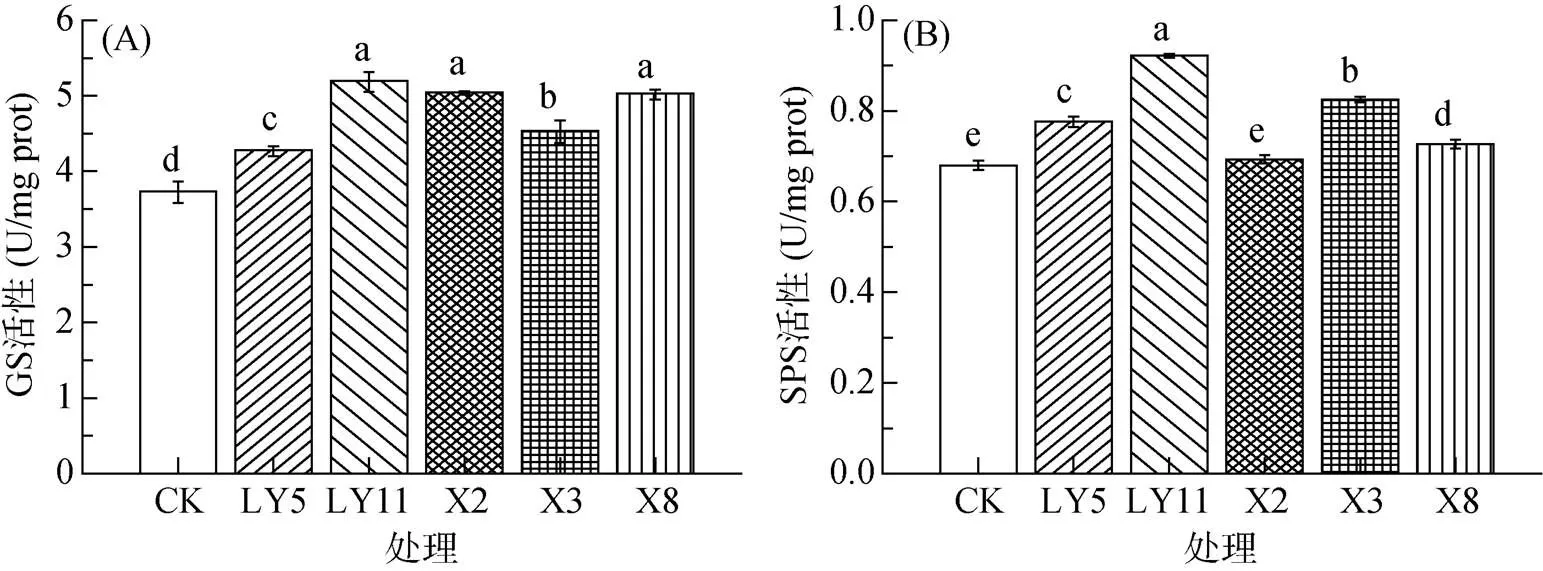
图3 不同处理对植株体内谷氨酰胺合成酶和蔗糖磷酸合成酶的影响
3 讨论
水稻的种植方式以育苗插秧为主,因此秧苗的壮苗指数和根系的形态结构对插秧后水稻定殖,以及后期水稻植株的生长具有非常重要的作用。本研究发现,水稻育苗基质中添加促生菌后株高、茎粗和生物量得到显著提升。促生菌应用于基质对作物幼苗的促生效果在辣椒[22]、白菜[23]和番茄[24]等作物的育苗中均得到验证。促生菌对作物的作用机制首先表现在对作物根系的影响,作物根系的形态结构影响根系从土壤获取水分、养分资源的能力,并且进一步影响作物地上部的生长[25-26]。胡江春等[27]指出,多种根际促生菌自身代谢过程中能够产生吲哚乙酸、赤霉素等植物生长调节物质,增强植物代谢活性,促进作物根系的生长,增加对养分的吸收和同化,并进一步促进植物的生长。本研究结果发现,几种促生菌处理不仅促进了水稻幼苗根系体积的增加,而且根系总长、根尖数和根表面积均显著增加,因此显著改善了根系构型。较好的根系构型有利于增加植株对生长基质中水分、养分的获取,提高植株水肥利用效率,增强植株抗性[28-29]。特别是本研究中发现的根系表面积和根尖数的增加,以及根系活力的提高,表明促生菌通过改善根系构型能够保障作物生长过程中对养分、水分等的吸收。同时,作物根系构型与其所处基质环境,包括水分和养分的有效性密切相关[30]。而本研究中所添加的促生菌均为具有固氮解磷能力的优势菌株[13],能够保障基质中养分的供应,降低养分胁迫。而该结果也反映出通过在水稻育苗基质中添加促生菌具有减少养分投入、提高养分效率的应用潜力。
另外,促生菌对作物生长的影响机制表现在促生菌在作物根围基质、根系表面和根系内部的代谢活动,从而影响基质中养分的活化以及养分在作物体内的转运[31]。本研究中所选用的促生菌具有较强的固氮解磷能力,能够激发育苗基质中养分的活化,保障作物生长过程中的吸收利用。例如解磷微生物可能通过产生磷酸酶水解有机磷并释放出作物可直接吸收利用的生物有效态磷,或者通过分泌有机酸等次生代谢产物,将矿物离子结合态磷直接溶解活化,增加生长基质对磷素的供应[32-33];而固氮微生物的固氮酶活性高于其他微生物,增加生长基质对作物氮素供应[18]。因此根际促生菌的添加可能增加作物对氮磷养分的吸收,本研究结果与此一致,即促生菌处理下水稻秧苗地上地下部氮磷养分含量均显著高于对照处理,而且氮磷钾养分吸收量均显著增加。刘泽平等[34]研究发现,水稻根际促生菌不仅具有溶磷、解磷、解钾效果,且具有分泌生长素、赤霉素、铁载体等植物生长促生物质的能力。特别是对铁镁等中微量元素的吸收,有利于作物叶绿素的形成并促进光合作用的进行,增加有机物质的积累。本研究中SPAD值的增加结果与此相一致。另外,充足的养分供应可能是促进根系生长的原因,同时反过来根系表面积和根系活力等的提高,对养分吸收利用效率也更高,并进一步促进植株幼苗的生长和生物量的积累[35-36]。
水稻育苗基质中添加适宜的促生菌,在促进秧苗生长的同时能够提高作物抗性和代谢活性,保障作物生长,这可能也是促生菌促进作物生长的机制。本课题组前期研究发现本研究所用LY11菌株对水稻纹枯病具有较好的拮抗效果[13]。促生菌对植株抗逆性的增强可能与中微量矿质元素的吸收和利用,以及产生利于植物生长的代谢产物等因素有关[37-39]。Ryu等[40]发现、、及等根际促生菌在代谢过程中产生的有机复合物能够诱导增强植株系统抗性。另外,刘婷等[41]发现赤霉素、生长素和细胞分裂素等多种植物生长促生物质在多种根际促生菌中都被检测到,因此对植物矿质养分的吸收和生长具有促进作用。本研究结果中植物体内碳氮代谢相关酶活性的增强也与此相关。谷氨酰胺合成酶(GS)和蔗糖磷酸合成酶(SPS)等酶类在植物碳氮代谢过程中起着重要作用[42-44]。本研究结果表明,添加促生菌的处理其相应植株体内与碳氮代谢相关的GS、SPS酶活性均显著增加。GS参与氮素的同化而影响植物的生长发育,包括内源性氨基酸的分解及反硝化过程产生的铵的同化,影响作物对氮素的吸收和转运[45],并通过促进植株体内游离铵的同化而减轻铵毒害[46]。SPS是植物体内控制蔗糖合成的关键酶,参与植物的生长和产量形成,并在植物的抗逆过程中起重要作用[47]。本研究中促生菌的添加能够促进水稻幼苗体内氮素的吸收量和生物量的积累的增加结果与此相一致。同时钾素的吸收总量比对照处理显著提高,且LY11处理下水稻地上部以及LY11和X8处理下地下部钾含量均显著提高。钾素吸收的增加能够增强作物抗性[48]。同时表明幼苗抗性的增强,特别是对于移栽后幼苗适应新环境胁迫的能力提高,有利于水稻定植和后期生长。而不同的促生菌对土壤养分的活化能力、植株根系的定植能力,以及对植株新陈代谢活性和抗性的影响不同[49-50],因此需要进一步对不同促生菌的促生机理进行深入研究,以期在不同的条件下能够选择合适的促生菌种类,保障培育出健康优质的水稻秧苗。
4 结论
在水稻育苗基质中添加促生菌使得水稻秧苗地上部生物量与壮苗指数比对照显著增加;根系形态结构得到明显改善;促生菌处理下显著促进了秧苗氮磷养分的积累;水稻幼苗体内谷氨酰胺合成酶(GS)和蔗糖磷酸合成酶(SPS)活性在促生菌处理下均显著提高;其中解淀粉芽孢杆菌(LY11)对水稻育苗基质的促生效果最好。
[1] 国家统计局. 中国统计摘要: 1984[M]. 北京: 中国统计出版社, 1984.
[2] 宋昌梅. LED光源在水稻育苗和组培培养中的应用[D]. 南京: 南京农业大学, 2012.
[3] Ostos J C, López-Garrido R, Murillo J M, et al. Substitution of peat for municipal solid waste- and sewage sludge-based composts in nursery growing media: effects on growth and nutrition of the native shrub Pistacia lentiscus L[J]. Bioresource Technology, 2008, 99(6): 1793–1800.
[4] Moral R, Paredes C, Bustamante M A, et al. Utilisation of manure composts by high-value crops: Safety and environmental challenges[J]. Bioresource Technology, 2009, 100(22): 5454–5460.
[5] 董宇, 马晶, 张涛, 等. 秸秆利用途径的分析比较[J]. 中国农学通报, 2010, 26(19): 327–332.
[6] 杨雪慧, 汤丽娟, 章蓉, 等. 农作物秸秆表面改性处理的研究进展[J]. 南京林业大学学报(自然科学版), 2013, 37(3): 157–162.
[7] Li Y, Yue Q Y, Gao B Y. Adsorption kinetics and desorption of Cu(II) and Zn(II) from aqueous solution onto humic acid[J]. Journal of Hazardous Materials, 2010, 178(1/2/3): 455–461.
[8] Clemmensen A W. Physical characteristics of miscanthus composts compared to peat and wood fiber growth substrates[J]. Compost Science & Utilization, 2004, 12(3): 219–224.
[9] 耿凤展, 李荣华, 高波, 等. 番茄秸秆高温堆肥作为番茄育苗基质的循环利用研究[J]. 中国土壤与肥料, 2016, (1): 102–106.
[10] 张玉树, 丁洪, 王飞, 等. 长期施用不同肥料的土壤有机氮组分变化特征[J]. 农业环境科学学报, 2014, 33(10): 1981–1986.
[11] Luo G W, Li L, Friman V P, et al. Organic amendments increase crop yields by improving microbe-mediated soil functioning of agroecosystems: a meta-analysis[J]. Soil Biology and Biochemistry, 2018, 124: 105–115.
[12] 石博文, 赖欣, 李洁, 等. 尿素与有机肥配施对棕红壤氮素转化的影响[J]. 核农学报, 2017, 31(5): 938– 945.
[13] 张林利. 功能型高效生物水稻育苗基质研制及其应用效果研究[D]. 郑州: 河南农业大学, 2018.
[14] Hamdali H, Hafidi M, Virolle M J, et al. Rock phosphate-solubilizing Actinomycetes: screening for plant growth-promoting activities[J]. World Journal of Microbiology and Biotechnology, 2008, 24(11): 2565–2575.
[15] 刘佳莉, 方芳, 史煦涵, 等. 2株盐碱地燕麦根际促生菌的筛选及其促生作用研究[J]. 草业学报, 2013, 22(2): 132–139.
[16] 姜焕焕, 王通, 陈娜, 等. 根际促生菌提高植物抗盐碱性的研究进展[J]. 生物技术通报, 2019, (10): 189–197.
[17] 张林利, 吴大霞, 刘晔, 等. 酒糟等农业废弃物的堆肥化及水稻育秧基质研发[J]. 土壤, 2019, 51(4): 682– 689.
[18] 胡敏, 贺德先. 小麦根系活力的昼夜变化及最佳取样和测定时间[J]. 麦类作物学报, 2011, 31(6): 1094– 1098.
[19] 鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000.
[20] Zhang C F, Peng S B, Bennett J. Glutamine synthetase and its isoforms in rice spikelets and rachis during grain development[J]. Journal of Plant Physiology, 2000, 156(2): 230–233.
[21] 薛应龙, 上海植物生理学会. 植物生理学实验手册[M]. 上海: 上海科学技术出版社, 1985.
[22] 张杨, 文春燕, 赵买琼, 等. 辣椒根际促生菌的分离筛选及生物育苗基质研制[J]. 南京农业大学学报, 2015, 38(6): 950–957.
[23] 王欢, 韩丽珍. 4株茶树根际促生菌菌株的鉴定及促生作用[J]. 微生物学通报, 2019, 46(3): 548–562.
[24] 文春燕, 高琦, 张杨, 等. 含PGPR菌株LZ-8生物育苗基质的研制与促生效应研究[J]. 土壤, 2016, 48(2): 414–417.
[25] Lynch J. Root architecture and plant productivity[J]. Plant Physiology, 1995, 109(1): 7–13.
[26] Lynch J P. Steep, cheap and deep: An ideotype to optimize water and N acquisition by maize root systems[J]. Annals of Botany, 2013, 112(2): 347–357.
[27] 胡江春, 薛德林, 马成新, 等. 植物根际促生菌(PGPR)的研究与应用前景[J]. 应用生态学报, 2004, 15(10): 1963–1966.
[28] Mu X H, Chen F J, Wu Q P, et al. Genetic improvement of root growth increases maize yield via enhanced post-silking nitrogen uptake[J]. European Journal of Agronomy, 2015, 63: 55–61.
[29] Bengough A G, McKenzie B M, Hallett P D, et al. Root elongation, water stress, and mechanical impedance: a review of limiting stresses and beneficial root tip traits[J]. Journal of Experimental Botany, 2011, 62(1): 59–68.
[30] Yu P, White P J, Hochholdinger F, et al. Phenotypic plasticity of the maize root system in response to heterogeneous nitrogen availability[J]. Planta, 2014, 240(4): 667–678.
[31] 张典利, 孟臻, 亓文哲, 等. 植物根际促生菌的研究与应用现状[J]. 世界农药, 2018, 40(6): 37–43, 50.
[32] Olander L P, Vitousek P M. Regulation of soil phosphatase and chitinase activity by N and P availability[J]. Biogeochemistry, 2000, 49(2): 175–191.
[33] 赵小蓉, 周然, 李贵桐, 等. 低磷石灰性土壤加入四种作物秸秆土壤微生物量磷的变化特征[J]. 华北农学报, 2010, 25(3): 200–204.
[34] 刘泽平, 王志刚, 徐伟慧, 等. 水稻根际促生菌的筛选鉴定及促生能力分析[J]. 农业资源与环境学报, 2018, (2): 119–125.
[35] Osaki M, Shinano T, Matsumoto M, et al. A root-shoot interaction hypothesis for high productivity of field crops[J]. Soil Science and Plant Nutrition, 1997, 43(sup1): 1079–1084.
[36] Zhang H, Xue Y G, Wang Z Q, et al. An alternate wetting and moderate soil drying regime improves root and shoot growth in rice[J]. Crop Science, 2009, 49(6): 2246–2260.
[37] 曾加会, 李元媛, 阮迪申, 等. 植物根际促生菌及丛枝菌根真菌协助植物修复重金属污染土壤的机制[J]. 微生物学通报, 2017, 44(5): 1214–1221.
[38] 马凯, 杨凡, 段亚魁, 等. 植物根际促生菌在瓜菜工厂化育苗中的应用技术研究进展[J]. 中国瓜菜, 2019, 32(1): 1–5.
[39] 马文彬, 姚拓, 王国基, 等. 根际促生菌筛选及其接种剂对箭筈豌豆生长影响的研究[J]. 草业学报, 2014, 23(5): 241–248.
[40] Ryu C M, Farag M A, Hu C H, et al. Bacterial volatiles promote growth in Arabidopsis[J]. PNAS, 2003, 100(8): 4927–4932.
[41] 刘婷, 姚拓, 陈建纲, 等. 固相萃取-高效液相色谱法测定植物根际促生菌发酵产物中3种植物激素的含量[J]. 分析科学学报, 2017, 33(2): 201–206.
[42] 韩英坤. 巨大芽孢杆菌N6谷氨酰胺合成酶酶学性质的研究和改良[D]. 武汉: 华中农业大学, 2017.
[43] 王利. 番茄花后碳水化合物代谢及14-3-3蛋白对蔗糖磷酸合成酶调控效应的研究[D]. 沈阳: 沈阳农业大学, 2013.
[44] 姜海洋. 马铃薯块茎形成期糖类物质代谢机制与产量形成的研究[D]. 大庆: 黑龙江八一农垦大学, 2017.
[45] 李常健, 林清华, 张楚富, 等. NaCl对水稻谷氨酰胺合成酶活性及同工酶的影响[J]. 武汉大学学报(自然科学版), 1999, (4): 497–500.
[46] 韩庆芬, 陈海飞, 张振华. 不同生态型拟南芥耐铵毒害差异的生理机制[J]. 植物营养与肥料学报, 2019, 25(7): 1185–1193.
[47] 田红梅. 甜瓜蔗糖磷酸合成酶基因的功能鉴定与分析[D]. 泰安: 山东农业大学, 2011.
[48] 付延磊, 王祎, 王宜伦, 等. 适宜钾浓度降低小麦蚜虫密度的生理代谢机理[J]. 植物营养与肥料学报, 2017, 23(4): 1006–1013.
[49] 王丹, 赵学强, 郑春丽, 等. 两种根际促生菌在不同氮磷条件下对油菜生长和养分吸收的影响[J]. 土壤, 2017, 49(6): 1078–1083.
[50] Grönemeyer J L, Kulkarni A, Berkelmann D, et al. Identification and characterization of rhizobia indigenous to the Okavango region in Sub-Saharan Africa[J]. Applied and Environmental Microbiology, 2014: AEM. 02417-14.
Effects of Plant Growth-promoting Rhizobacteria Added in Seedling Substrate on Rice Growth
QI Xiuxiu, WEI Chang, LIU Xiaodan, ZHANG Linli, JIANG Ying, ZHANG Dengxiao*
(College of Resources and Environmental Science, Henan Agricultural University, Zhengzhou 450002, China)
A pot experiment was conducted to study the effect of plant growth-promoting rhizobacteria (PGPR) on rice growth after added into seeding substrate, in which five PGPR were selected, included LY5 (), LY11 (), X2 (), X3 () and X8 (), and mixed with an efficient seedling substrate, respectively. The results showed that, compared with the CK (seedling substrate without PGPR added), LY11 was the best in promoting the growth and metabolic activity of rice seedlings, PGRP treatments significantly increased the aboveground biomass and strong seedlings index by 17.24%-31.19% and 11.37%-23.28%, respectively, significantly increased the volume, length and activity of rice roots and improved the morphology and structure of rice roots, significantly increased the uptake of nitrogen, phosphorus and potassium, the transport coefficients of nitrogen and potassium, and GS and SPS activities of rice seedlings. In conclusion, the application of PGPR to rice seedling substrate is benefit to the growth and activity of rice seedlings and can produce high quality rice seedling substrate.
Rice; PGPR; Seedling substrate; Root architecture; Metabolic activity
S511
A
10.13758/j.cnki.tr.2020.05.021
戚秀秀, 魏畅, 刘晓丹, 等. 根际促生菌应用于基质对水稻幼苗生长的影响. 土壤, 2020, 52(5): 1025–1032.
国家自然科学基金项目(41907079)、国家重点研发计划项目(2018YFD0200600)、国家重点研发计划重点专项(2017YFD 0200605)和河南省科技攻关计划(国际科技合作)项目(162102410031)资助。
戚秀秀(1995—),女,河南永城人,硕士研究生,主要从事资源利用与植物保护研究。E-mail: qixiuxiu0318@163.com

