染色体微阵列分析技术产前诊断胎儿先天性肺囊性腺瘤样畸形的应用价值
王荣跃 楼文文 宫剑 黄贤苹 许张晔
先天性肺囊性腺瘤样畸形(congenital cystic adenomatoid malformation,CCAM)是一种以肺组织多囊性肿块伴有支气管结构增生为特征的病变,病变组织由肺循环供血,80%位于单侧,20%位于双侧[1]。CCAM发病率为1/35 000~1/25 000[2],男女发病率相似。产前CCAM可引起胎儿水肿、羊水过多、纵隔移位或消退[3]。染色体微阵列分析(chromosomal microarray analysis,CMA)技术可用来检测染色体微缺失、微重复[4],已应用于发育迟缓、智力障碍患儿的诊断[5]和先天性异常胎儿的产前诊断[6-7],可检测>100 k的拷贝数变异(copy number variation,CNV)[8-9],优于传 统 的 细 胞 遗 传 学 核 型 分 析。为探讨CNV与CCAM之间的关系,本研究采用CMA技术对超声诊断CCAM的胎儿进行全基因组检测,从而指导母儿预后情况的判断。
1 对象和方法
1.1 对象 选取2018年3月至2019年12在本院就诊的产前超声诊断胎儿为CCAM的孕妇23例。孕妇年龄17~42(29±5)岁,胎龄17~30+6(19±3)周。根据胎儿是否合并其他结构异常,分为单纯性CCAM 19例和非单纯性CCAM 4例。本研究经医院医学伦理委员会审查通过,所有胎儿父母均签署知情同意书。
1.2 方法
1.2.1 胎儿CCAM诊断 产前胎儿CCAM诊断由两位经验丰富的超声科医师会诊确诊,必要时行胎儿胸部MRI检查。
1.2.2 产前诊断方法 超声检查提示患有CCAM的胎儿,征得孕妇以及家属同意并签署产前诊断知情同意书,采用羊膜腔穿刺术或脐静脉穿刺术取得胎儿标本进行CMA检测。
1.2.3 DNA提取 采用Qiagen试剂盒(美国Qiagen公司)从脐血(0.5 ml)和羊水(10 ml)中提取基因组 DNA。如需排除母血污染和解释意义不明的CNV时,则提取父母的外周血标本的基因组。
1.2.4 染色体核型分析 对脐血或羊水进行培养、收获、染色、滴片后,再行染色体核型分析。
1.2.5 CMA检测 严格按照美国Affymetrix公司提供的标准流程进行操作,对基因组DNA进行消化、扩增、纯化、片段化、标记、与芯片杂交、洗涤及芯片扫描,所使用的芯片为全基因组CytoScan 750K芯片(美国Affymetrix公司)。该芯片同时具备单核苷酸多态性探针和寡核苷酸探针。
1.2.6 数据分析 应用配套的CHAS软件及相关的生物信息学方法分析CMA的检测结果,根据DNA片段拷贝数的散点图分布判断CNV及染色体微缺失、微重复。根据文献及公共数据库分析>100 kb的CNV的临床意义,CNV比对分析过程中所参考的数据库包括人类基因组结构变异数据库(DGV)数据库(http://dgv.tcag.ca/dgv/app/)、疾病相关 CNV 数据库(DECIPHER)(https://decipher.sanger.ac.uk/)、人类孟德尔遗传数据库(OMIM)(https://www.omim.org)等。根据CNV的性质不同分为良性CNV、致病性CNV和临床意义不明确的CNV(variants of uncertain significance,VOUS)。
1.2.7 CNV的验证 对含有致病性CNV及VOUS胎儿的父母外周血样本行CMA分析,进一步明确CNV是遗传还是新发,协助判断CNV的性质。
1.2.8 随访时间 产前超声诊断CCAM的胎儿并分娩的,随访至出生6个月,了解其出生后CCAM情况。
2 结果
2.1 产前诊断CCAM胎儿的一般情况 4例非单纯性CCAM胎儿合并其他异常,其中合并胎儿生长受限1例,羊水过少2例,心脏移位并羊水过多1例。
2.2 CMA检测结果 23例胎儿的基因组均存在CNV,每例胎儿的基因组含有1~5个CNV,片段大小为300 kb~6.20 Mb。3例胎儿检出致病性CNV,检出率为13.0%;单纯性CCAM胎儿与非单纯性CCAM胎儿的致病性CNV检出率分别为10.5%(2/19)和25.0%(1/4)。3例胎儿相关情况见表1。17q12微缺失区段包含肾囊肿和糖尿病(renal cysts and diabetes,RCAD)综合征的关键区域1.60 Mb的微缺失(图1)。17p12微缺失区段包含遗传性压力易感性周围神经病(hereditary neuropathy with liability to pressure palsies,HNPP)综合征的关键区域1.40 Mb微缺失(图2)。Xq27.1q28微重复区域包含关键基因SOX3基因。经过父母验证后VOUS检出率为8.7%(2/23),VOUS检测情况见表 2。
2.3 妊娠结局情况 19例单纯性CCAM胎儿引产1例,分娩18例;4例非单纯性CCAM胎儿引产1例,分娩2例,失访1例,见表3。20例CCAM胎儿出生后经过 6个月随访,7例(35.0%)自发消退;5例(25.0%)接受了手术治疗,术后恢复良好;8例(40.0%)分娩后CT检查仍有CCAM,但拒绝手术仍在随访中。
3 讨论
2013年美国妇产科协会(ACOG)建议将染色体微阵列基因芯片技术分析应用于产前诊断,指出若超声诊断胎儿结构异常并同意行侵入性产前诊断的,用CMA可替代染色体核型分析[10]。Liao等[11]对超声异常但染色体核型分析正常的446例胎儿中进行CMA检测,发现11.4%的胎儿存在致病性CNV。通过CMA检测可发现出生缺陷相关的致病基因,如在先天性食管闭锁胎儿中通过CMA检测发现了GL13基因变异[12],在骨骼发育异常的胎儿中通过CMA检测发现了PPKAR1A基因、MITF基因变异[13]。本研究使用全基因组CytoScan 750K芯片对23例伴或不伴其他超声结构异常的CCAM胎儿进行检测,结果显示致病性CNV的检出率为13.0%,与Deng等[14]报道基本一致。

表1 致病性CNV的CMA检测结果
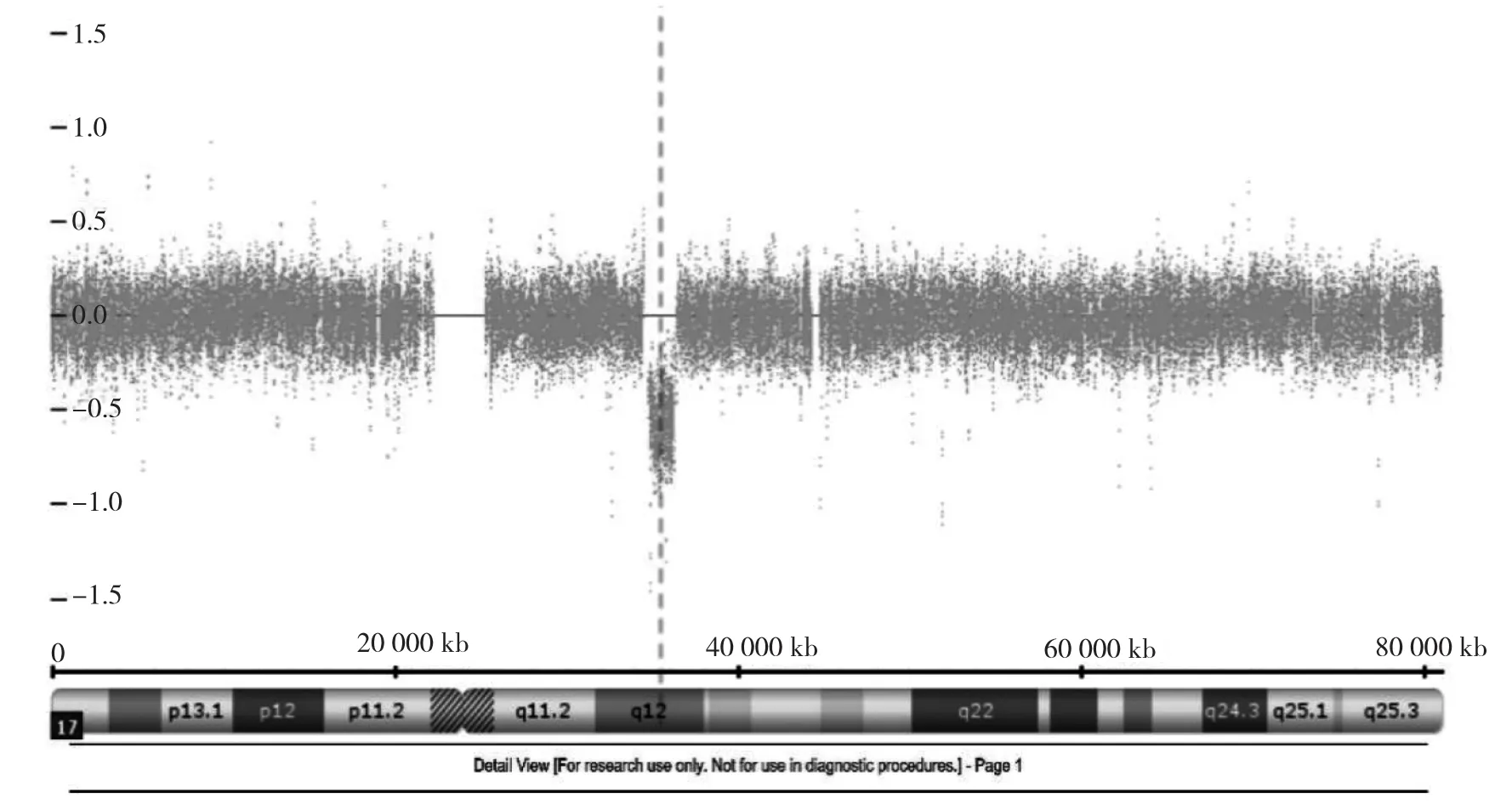
图1 病例1染色体17q12区域发生1.60 Mb的微缺失
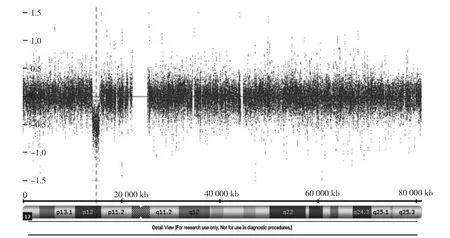
图2 病例2染色体17p12区域发生1.40 Mb微缺失

表2 VOUS检测结果
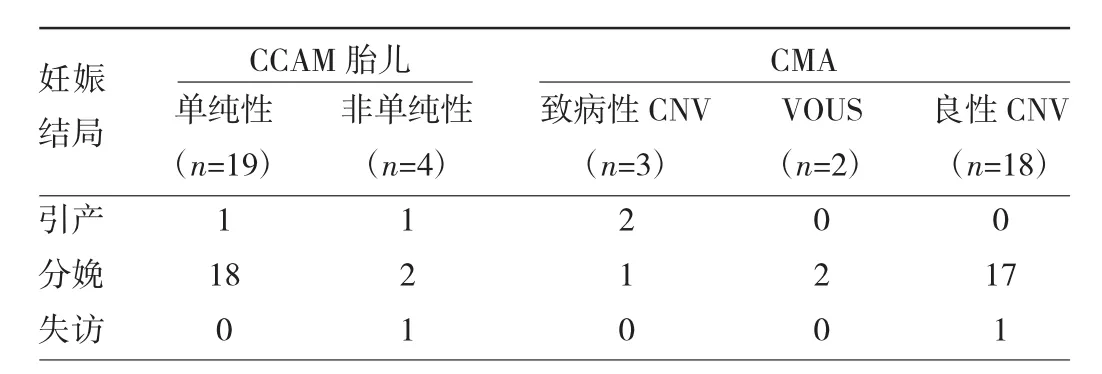
表3 CCAM胎儿妊娠结局情况
本研究显示单纯性CCAM胎儿与非单纯性CCAM胎儿的致病性CNV检出率分别为10.5%和25.0%。单纯性CCAM胎儿中发现的两个致病性CNV与CCAM的发生不一定有关,但有可能是潜在危害健康的原因。
本研究中病例1在17q12染色体上存在1.60 Mb微缺失,与RCAD综合征(OMIM 137920)相关。RCAD综合征是一种常染色体显性遗传病,其特征是肾发育异常(特别是多发性肾囊肿、肾小球囊性病变、肾发育不良)和糖尿病[15]。Donnelly等[16]研究中提示17q12微缺失是产前超声异常中仅次于22q11微缺失综合征的第二常见的基因芯片异常。RCAD综合征的发生与HNF1B(OMIM 189907)基因缺失相关[16]。Jain等[17]在正常胎儿的肺、肝、胰腺和胃中检测到HNF1B mRNA,该夫妇经过充分的遗传咨询后,不愿意接受有可能表现异常的胎儿,回当地医院引产。
本研究中病例2在17p12染色体上存在1.40 Mb微缺失,与HNPP综合征(OMIM 162500)相关,HNPP综合征表现为复发性局灶性运动和感觉性周围神经病[18],呈常染色体显性遗传,轻微外伤可引起局灶性脱髓鞘性神经病发作[19]。该夫妇家庭经济条件差,经过充分遗传咨询后仍坚决要求引产。本研究中病例3在Xq27.1q28染色体上存在9.53 Mb微重复,包含SOX3(OMIM 313430)基因,会引起垂体功能下降,经过遗传咨询后,该夫妇有宗教信仰,要求继续妊娠,分娩后予门诊随访未见新生儿有异常表型,无特殊面容,发育接近正常同龄儿,仍在随访中。
CCAM的预后主要取决于其在宫内是否合并其他相关畸形。大多数病变会在出生后的第1年持续存在,会增加肺部感染的风险,Davenport等[20]推荐积极手术治疗。然而,Calvert等[21]发现在出生后的第1年,CCAM会自发消退,他们主张对无症状婴儿进行密切随访,并对持续性病变进行再次检查。本研究中,25.0%(5/20)的胎儿分娩后进行了手术,术后恢复良好;35.0%(7/20)的胎儿分娩后在生后3~6个月左右病变自发消退。由于本研究病例数较少,需要进一步扩大病例数才能更好得出结论。但是这个结果可能有助于增加孕妇继续妊娠的信心,尤其是对于那些怀有单纯CCAM并且CMA结果阴性的胎儿孕妇。
综上所述,CMA技术能检出部分致病性CNV,即亚显微染色体异常,能更好地指导及提高CCAM病变的产前咨询及管理,避免过度引产。

