牙周基础治疗对慢性肾病伴牙周炎患者炎症因子影响的Meta分析
赖静 白远亮 柏银 梅杰 张芷玮 唐雯静 黄姣
1.重庆医科大学附属口腔医院牙周科,重庆 400015;
2.口腔疾病与生物医学重庆市重点实验室,重庆 400015;
3.重庆医科大学重庆市高校市级口腔生物医学工程重点实验室,重庆 400015
慢性肾病(chronic kidney disease,CKD)是一个全球化的公共健康问题,CKD的主要表现是肾小球和肾小管的滤过率逐渐降低,肾单位便出现了渐进性不可逆转的恶化表现[1]。美国肾脏基金会指南[2]根据肾小球滤过率将CKD划分为5个期,伴随着病程的发生和进展,逐渐出现肾功能降低和解剖结构改变,甚至是尿沉淀物等异常情况,它的治疗包括从Ⅰ期的高危因素控制等到Ⅴ期的腹膜透析、血液透析,甚至是移植等[3]。
炎症作为危险因素可使CKD发展成终末期肾脏病(end stage renal disease,ESRD),引发“尿毒症难题”,并涉及氧化应激和全身炎症,这些指数也和CKD并发心血管疾病(cardiovascular diseases,CVD)所息息相关[4-5]。CKD、ESRD所产生的炎症反应还是导致因CVD致死的关键因素,因此,现已有学者提出了“减少生化炎症标志物”作为该人群的治疗目标结果[6]。
牙周炎是一种微生物相关、宿主介导并导致牙周附着丧失的炎症[7],是成人牙缺失的主要原因。2018年6月,世界联合研讨会正式确定了关于牙周病的新分类方法[8],将1999年分类法[9]中的慢性和侵袭性现均归为牙周炎,并重新划分为4期、3级。研究[10]发现,牙周健康者早期可因个别牙位发生轻度炎症而发展为牙龈炎,再进展成牙周炎,在临床上可见探诊出血、附着丧失,严重者[11]由于牙槽骨的破坏,往往还伴有根分叉病变、牙髓病变、牙松动甚至脱落等。其病程发展缓慢,受多种风险因素的影响,包括年龄、教育水平、吸烟、压力以及影响宿主免疫炎症反应等多种疾病[12]。经过长期的临床实践发现,在牙周炎易感个体中,部分炎症因子可以避开局部防御、侵入循环系统、引起全身炎症反应[13]。
牙周炎和其他全身性疾病(如CVD或代谢综合征)之间的联系在过去已有报道[14-15],而CKD和牙周炎之间的确切关系还在探索中。牙周炎或构成了CKD的一种促进或危险因素,这不只是源于临床研究[16],还包括动物模型[17-18]上的探索,结果显示牙周炎可促进肾功能恶化并造成肾脏的病理损伤,通过炎性机制的这种方式来加重肾脏损害。有研究发现,一方面CKD患者自身牙周炎症负担较重[19],存在持续的炎症状态,表现为C反应蛋白(C-reactive protein,CRP)、白细胞介素(interleukin,IL)-6、肿瘤坏死因子(tumor necrosis factor,TNF)-α等炎症因子的不同程度的升高[20],另一方面,牙周炎患者在炎症活跃期局部可以产生相同的细胞因子加速CKD的进展[21]。那么对于CKD伴牙周炎患者,就会考虑是否能通过牙周基础治疗的方式,在减缓牙周炎进展的同时,还在一定程度上改善CKD患者的全身炎症因子状况,防止微炎症状态的进一步扩张[22]。为进一步评价牙周基础治疗关于炎症因子的影响,本研究拟对国内外的随机对照试验进行Meta分析,为CKD的协同治疗提供循证医学的依据。
1 材料和方法
1.1 文献检索
在中文数据库中国期刊全文数据库(CNKI)、万方数据库(Wan Fang Data)和中国生物医学文献数据库(CBM)中检索“慢性肾病”、“透析”、“牙周炎”、“C反应蛋白”、“白细胞介素-6”、“肿瘤坏死因子-α”、“炎症因子”、“牙周治疗”等关键词。在英文数据库PubMed、EMbase以及Cochrane Library数据库中检索“chronic kidney disease”、“kidney”、“renal”、“dialy sis”、“periodontitis”、“C-reactive protein”、“interleukin-6”、“tumor necrosis factor-α”、“in flammatory factors”、“periodontal therapy”等关键词。检索日期限定为建库至2019年12月31日所有公开发表的文献,语言限定是英文和中文。
1.2 文献纳入与排除标准
1)研究类型:中、英文里是随机对照试验的文献,无论盲法与否。
2)研究对象:需要是同时被确定成CKD以及牙周炎的患者。符合CKD定义的患者标准为肾损伤或者不明原因的肾小球滤过率(glomerular filtra tion rate,GFR)<60 mL·min-1,并持续达3个月以上[23]。因牙周炎新旧分类的过渡,筛选患者时根据牙周炎的临床情况,只需符合以下具体口内条件:口内存留牙数≥12颗,口腔内不同象限至少有2个位点牙周探诊深度(probing depth,PD)>4 mm,临床附着丧失(clinical attachment loss,CAL)≥3 mm。分别满足以上2个关于CKD和牙周炎的选择标准后,并且,同时需要排除的患者有3个月内做过牙周治疗、精神病患者、恶性肿瘤、严重系统性疾病、妊娠及哺乳期妇女。
3)干预措施:试验组和对照组均给予规律且相同的肾病治疗,试验组在此基础上另给予牙周基础治疗。
4)结局指标:对牙周基础治疗前后的CRP、IL-6、TNF-α水平含量有所报道。
5)排除标准:①无原始临床数据;②非随机对照试验;③只有方案尚未定论的;④综述、回顾性研究、病例报告、动物试验和摘要;⑤总样本量<30,随访时间<4周。
1.3 检索策略及资料提取
由2名评价员独立根据纳入与排除标准筛选文献、提取文章的数据并交叉核对资料,如遇到分歧,则通过讨论或者咨询第三方协助判断。筛选文献时先阅读文题和摘要, 排除了明显不相关的文献后,再阅读全文,通过制定完善的数据表对文献信息进行汇总,并确定最终是否纳入。提取的信息包括:1)第一作者;2)发表年份;3)年龄;4)研究时间;5)试验组与对照组样本量;6)样本性别;7)时间点;8)针对CKD的治疗方式;9)结局指标。
1.4 质量评价
筛选文献时应将满足条件的都纳入,再根据“Cochrane偏倚风险评估工具”通过高质量纳入,低质量排除的方法进行质量把控,由2名评价员评价纳入研究的偏倚风险,且须按照Cochrane手册针对随机对照试验的偏倚风险评估工具进行。分别将对以下7个方面进行质量评价:1)随机序列的产生;2)分配隐藏;3)参与者盲法;4)结局评估中的盲法;5)失访或退出报告;6)选择性报告结果;7)其他偏倚。
1.5 统计学分析
使用Review Manager(Revman)统计分析软件(5.3版本)来进行统计学的分析。本分析的结局指标属于计量资料,故采用均数差(mean difference,MD)与95%可信区间(con fidence interval,CI)来作为其效应指标,并设定P<0.05为有统计学意义。并且需要对各个纳入研究结果之间的异质性进行χ2检验,若P<0.1考虑各试验间存在明显的异质性。以I2值代表异质性的大小,当I2值高于50%,采用随机效应模型合并效应量,并探索异质性的来源;反之使用固定效应模式。
2 结果
2.1 文献的检索和纳入研究的一般信息
最初检索文献3 315篇,阅读题目,排除无关研究2 698篇,另有重复文献46篇。阅读摘要后再排除文献488篇,进一步阅读全文后排除文献77篇,最终6项随机对照试验被纳入[24-29],包含中、英文各3篇,具体文献的筛选过程见图1。
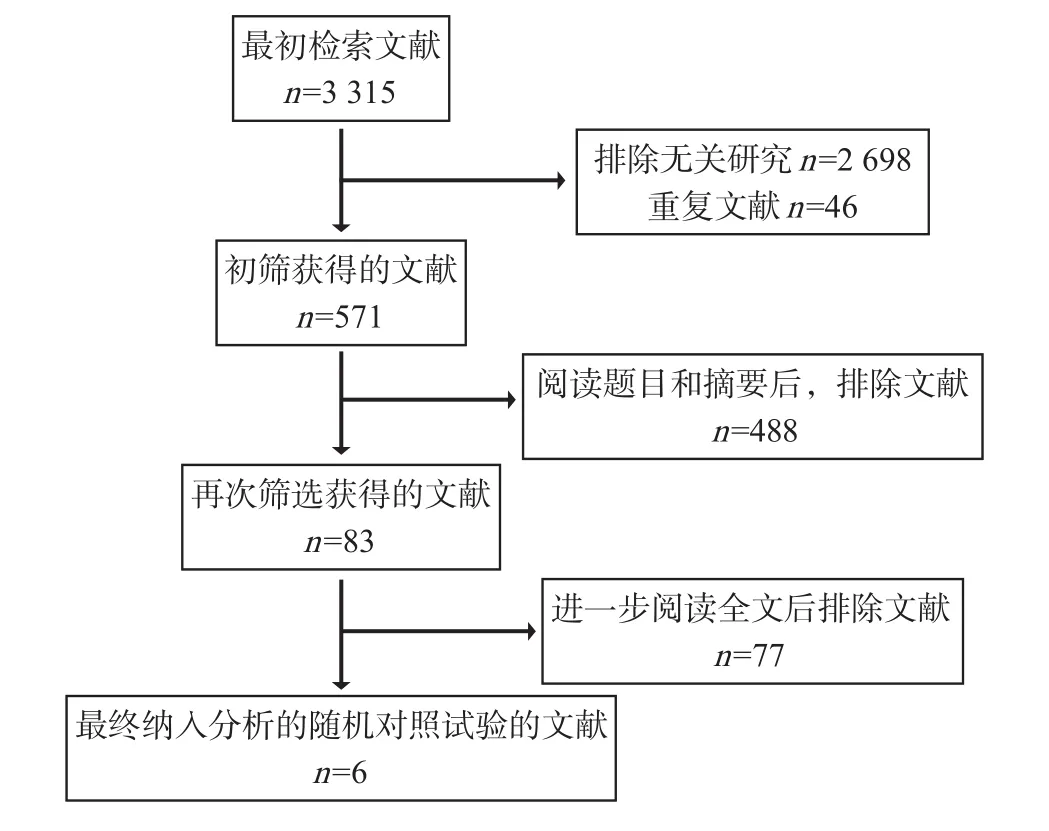
图1 文献筛选过程Fig 1 Literature screening process
2.2 纳入研究的一般特征
6篇纳入文献的一般信息见表1。在这6项研究中,2项[24,27]进行腹膜透析治疗,3项[25,28-29]进行血液透析治疗,1项[26]提及使用常规肾病治疗。另外,4项[25-26,28-29]均报告了CRP、IL-6、TNF-α水平,1项[24]只报告了IL-6水平,1项[27]只报告了CRP水平。共计总样本量为427例,其中试验组216例,对照组211例,患者的年龄范围约为34~64岁,男女比例约为1.2∶1,随访时间为1~6月不等。本分析采集各项研究时间≤3个月时间截点的数据进行分析。
2.3 方法学质量评价
纳入研究的偏倚风险评价结果见图2、3:以上6篇文章的研究采用“Cochrane偏倚风险评估工具”来进行质量评价,其中3篇[24-25,27]提及使用简单随机数字;2篇[24-25]提及研究员盲法;2篇[24-25]提及分配隐藏;2篇[24-25]提及8例失访,失访率为1.9%,其余4项研究没有失访及退出。4项[26-29]研究被认为具有中等偏倚风险,2项[24-25]研究被认为具有低等偏倚风险。

表1 纳入研究的一般特征Tab 1 General characteristics of included studies

图2 纳入研究的偏倚风险评价Fig 2 Bias risk assessment for included studies
2.4 Meta分析
2.4.1 CRP水平 有5项研究[25-29]报道了3个月时间点内(≤3个月)的CRP水平值,其中试验组193例,对照组188例,各项研究间存在有异质性(I2=97%,P<0.05),因此使用随机效应模型。Meta分析结果显示,相比于对照组,牙周基础治疗能减少CKD伴牙周炎患者血清中的CRP水平,差异具有统计学意义[MD=-0.58,95%CI(-1.13,-0.02),P=0.04](图4)。
2.4.2 IL-6水平 有5项研究[24-26,28-29]报道了3个月时间点内(≤3个月)的IL-6水平值,其中试验组185例,对照组181例,各项研究间存在有异质性(I2=92%,P<0.05),使用随机效应模型。Meta分析结果显示,相比于对照组,牙周基础治疗能减少CKD伴牙周炎患者IL-6水平,差异有统计学意义[MD=-2.76,95%CI(-5.15,-0.37),P=0.02](图5)。
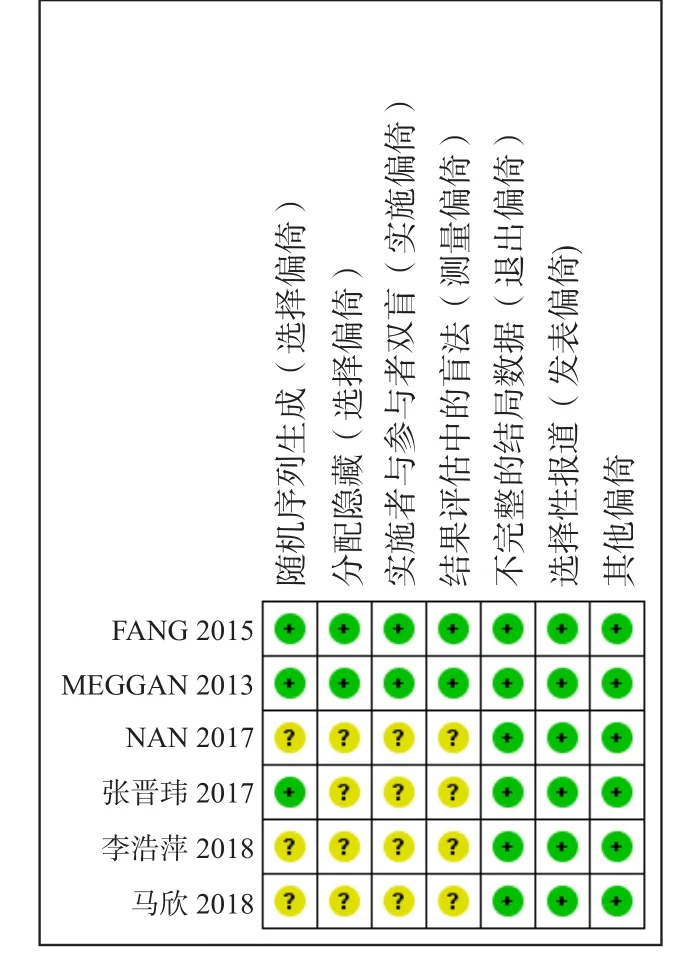
图3 偏倚风险总结Fig 3 Summary of bias risk

图4 试验组与对照组患者的CRP值的Meta分析森林图Fig 4 Meta-analysis forest map of CRP values in trial and control groups
2.4.3 TNF-α水平 有4项研究[25-26,28-29]报道了3个月时间点内(≤3个月)的TNF-α水平值,其中试验组162例,对照组158例,各项研究间存在有异质性(I2=97%,P>0.05),使用随机效应模型。Meta分析结果显示,相比于对照组,牙周基础治疗不能明显减少CKD伴牙周炎患者TNF-α水平,两组间差异无统计学意义[MD=-3.87,95%CI(-8.79,1.05),P=0.12](图6)。
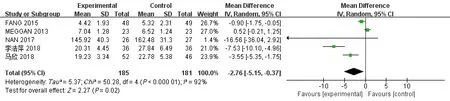
图5 试验组与对照组患者的IL-6值的Meta分析森林图Fig 5 Meta-analysis forest map of IL-6 values in trial and control groups
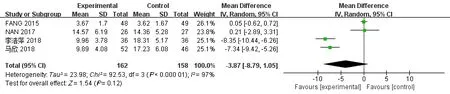
图6 试验组与对照组患者的TNF-α值的Meta分析森林图Fig 6 Meta-analysis forest map of TNF-α values in trial and control groups
2.5 异质性分析
本研究的异质性评估中,I2>50%,考虑异质性较大,考虑原因可能是因为部分纳入研究的样本量较少、各个研究的基线水平、随访时间以及检测使用的仪器不同等不一致从而出现临床异质性。此时,采用随机效应模型来作Meta分析可校正其异质性,也使结果更加可信。
2.6 敏感性分析
对结局指标在进行分析的时候,依次排除每一个研究后,再次作Meta分析,发现尽管每次少纳入一个研究指标却对结局的影响没有明显的变化,这说明本研究的系统评价稳定,结果可靠。由于此次研究最终只纳入了6篇研究文献,尚不能够进行漏斗图分析,故无法判断是否存在发表偏倚。
3 讨论
牙周炎作为慢性炎症的重要来源,以牙龈卟啉单胞菌、福赛坦菌、具核梭杆菌等为主的牙周致病菌能耐受吞噬作用,逃避免疫攻击[30],它们释放的内毒素可引起局部及外周血中产生某些细胞炎症因子,引发局部牙周组织的慢性炎症,存在促进全身性的炎症发展的可能[31]。也因此有研究[32]认为牙周致病菌是肾功能损害的非传统因素之一。当对CKD患者的口内微生物环境进行研究[33]后发现,牙周致病菌含量较高,可释放和聚集炎症细胞因子。牙周病原体还有黏附、侵入的能力,可使冠状动脉内皮细胞增殖、加速动脉粥样硬化形成、引起血小板聚集形成血栓而进一步造成肾病患者的肾血流障碍,或致慢性肾衰竭[34]。
在本研究纳入的6篇随机对照试验中,各只有1项研究显示IL-6[24]和TNF-α[25]为阴性结局,经过Meta分析后显示,和对照组相比,试验组的CRP、IL-6减少具有统计学意义(P<0.05),而TNF-α的减少的差异无统计学意义(P>0.05)。经过牙周干预后,CRP、IL-6下降的机制尚不明确,可能为牙周致病菌的脂多糖和其他细菌成分可以激活一系列炎性因子,或诱发肝细胞产生急性期反应,牙周基础治疗能够清除牙周致病菌,缩小炎症范围,进入血液的炎症介质降低,使其水平明显降低[35]。而TNF-α参与炎症和组织破坏有关,它的下降却表现不明显,原因可能是本分析中其样本含量最少引起偏差,还有可能是选取的时间点为3个月内,牙周炎症消退尚不充分,加之TNF-α本身敏感性不够高[22]。有纵向干预研究[35]认为,牙周基础治疗的最佳效果时间为从基线起后的6个月。
在肝脏合成的CRP是最重要的急性期蛋白,被视为炎症和内皮功能障碍的系统标志物,也是CVD的预测因子,其敏感性好,半衰期长,因此作为评价微炎症的可靠性标志[36]。横断面调查[20]显示,牙周破坏程度与CRP水平呈正相关,其表达尤其受到IL-6的调控。一方面,IL-6在牙周炎中主要参与了牙槽骨的吸收,随着炎症加重而逐渐活跃;另一方面,IL-6在CKD患者中可由肾脏系膜细胞持续分泌产生,加剧肾小球的病理改变[37]。有大量文献表明,CKD伴牙周炎患者的炎症程度和CRP、IL-6密切相关[38],牙周基础治疗的效果评价除减轻CRP[39-40]和IL-6[41]等标志物外,还有部分指标,如变化不明显的TNF-α[42]、肌酐[43]以及改善显著的24 h尿蛋白含量、GFR等[35,44]都具有临床指导意义。在牙周炎患者和CKD患者的血清中炎症因子水平都有增加,通过炎症反应它们之间呈现出了双向关系[45],CRP、IL-6和TNF-α等炎症介质可以通过牙周袋溃疡进入血液循环,扩散至其他远隔器官,增加炎症负荷[46]。通过分析表明,牙周基础治疗的方法尽管使得不同的炎症因子消除情况表现不一,但不妨碍人们探讨牙周炎与CKD在炎症问题上具有叠加作用[47],该干预方法对于CKD伴牙周炎患者不仅仅改善了口内的牙周临床指标,还适量减轻了微环境中的炎症负担。这和Graziani等[48]认为的牙周基础治疗除了对全身炎症标志物有积极作用,还对GFR有一定正面影响的研究结果也是一致的,其中GFR作为评价肾排泄功能的最佳综合指标,提示了牙周基础治疗的重要性,它在一定程度上可降低CKD患者进展至ESRD的风险。
对大众而言,应当早期认识和预防CKD的发展,不断有研究试图通过牙周炎与CKD呈正相关的信息[49]来探讨CKD的另一面,自2005年Kshirsagar等[50]首次提出了牙周炎是CKD的危险因素,相继有队列研究[51-52]、系统评价[53-55]报道了它们之间的关系。对于CKD患者而言,细菌感染在临床上很常见,随之而来的免疫功能的抑制,糖尿病发病率的增加,营养状况的恶化,使它成为了死亡的一个主要原因[56-58]。控制感染便成为了研究的重点。
本研究的局限性有:1)本研究中出现临床异质性难以消除;2)文献纳入数量相对不足,只检索了中英文献,忽视了其他语种的文献研究,另有4篇[6,59-61]方案虽符合纳入标准,却尚处于研究阶段;3)部分文献未报告盲法,可能导致偏倚。
综上所述,目前证据显示牙周基础治疗对于CKD伴牙周炎患者是有效的,它有利于缓解局部和全身的炎症状态,改善肾功能的一些相关炎症指标,并且有可能降低CKD患者并发CVD的风险,对于临床疗效是具有积极作用的。本研究因受到纳入文献数量和质量的限制,结果分析存在一定的不足,因此,更多的高质量、大样本和长期随访的随机对照试验结果是有必要展开来佐证研究分析。
利益冲突声明:作者声明本文无利益冲突。

