不同引诱剂对大蜡螟幼虫的引诱效果研究
曹兰 谢和芳 刘佳霖 高丽娇 杨金龙 王小平 王瑞生 罗文华


摘要 为更好地防治中蜂主要敌害大蜡螟(Galleria mellonella),本试验研究不同引诱剂对大蜡螟幼虫的引诱效果,以达到引诱大蜡螟幼虫、减少对蜂群危害为目的。根据大蜡螟幼虫在蜂箱内的食物嗜性,以酯类、能量、蛋白质及其他等四类食物设计9种引诱剂,筛选大蜡螟幼虫的最优引诱剂。结果表明,以巢脾、花粉、蜂蜜和蜡渣为原料制作的引诱剂诱导大蜡螟幼虫的效果最好。此外,引诱剂中的水分含量也能显著影响其对大蜡螟幼虫的诱导效果。引诱剂水分含量低于11.31%的引诱率均为0%,水分含量为15.57%~18.32%的引诱剂41 h后引诱率达(2.9±1.1)%~(62.9±13.0)%。
关键词 大蜡螟幼虫;引诱剂;食物诱导;筛选;引诱效果
中图分类号 S433 文献标识码 A
文章编号 1007-5739(2020)19-0198-04
中华蜜蜂(简称“中蜂”)是我国特有的畜禽遗传资源保护品种[1],中蜂产业已成为我国山区脱贫攻坚的特色效益畜牧产业。蜂群内巢脾上储存的营养物质如蜂蜜、花粉以及蜂蜡,易吸引蜜蜂敌害的青睐[2],特别是规模化蜂场。在西南地区,大蜡螟是本地中蜂的主要敌害,其幼虫在巢脾上取食,造成大量蜜蜂蛹死亡[3-4]。对于大蜡螟幼虫的防治,国外主要采用生物防治方法[5-9],通过茧蜂、线虫和苏云金芽孢杆菌等寄生性天敌防治大蜡螟,这些生物防制剂对大蜡螟有较强的毒性。国内主要靠特殊管理技术防治大蜡螟幼虫[10],如经常更换新脾、对蜂箱蜂具消毒、打扫群内卫生等,或者用硫磺、醋酸和甲酸熏蒸。杨 柳等[11]将王台茧衣、蜂蛹、酒精、蜜盖蜡、王台蜡等材料制蜡后,放在蜂箱底部作引诱剂,观察蜂群的病害变化情况,结果发现,该引诱剂最早30 d见效,一般需要60 d蜂群能被治愈。本研究主要针对大蜡螟幼虫在蜂箱内的食物嗜性,利用均匀设计法设计引诱剂,在室内对大蜡螟刚孵化幼虫进行食物引诱试验,筛选对大蜡螟幼虫诱导效果好的引诱剂。
1 材料与方法
1.1 试验地点
试验于2017年8—10月在重庆市畜牧科学院蜜蜂保护实验室进行,试验期间室内平均温度(28±2)℃,相对湿度为(80±5)%。人工氣候箱设置温度为(32±2)℃,湿度为(65±5)%。
1.2 试验材料
1.2.1 试验虫源。大蜡螟成虫在面积为3 cm2的薄木块上产卵形成的卵片,每块木块有卵100粒左右。卵片由重庆市畜牧科学院实验室提供。
1.2.2 试验器材。RXZ-500B型人工气候箱、多功能粉碎机、电子天平和饲养杯等。
1.2.3 引诱剂原料。大蜡螟幼虫引诱剂组方由鲜巢脾和老巢脾2种酯类原料,蜂蜜、葡萄糖和蔗糖等3种糖类原料,花粉、大豆粉和奶粉等3种蛋白质原料,以及蜡渣、塑料和糠麸等其他类原料组成。鲜巢脾(使用1年内巢脾)、老巢脾(使用的2年或2年以上的巢脾)、中蜂蜂蜜、蜡渣,均由重庆市畜牧科学院中蜂试验蜂场提供。葡萄糖、蔗糖、西蜂油菜花粉、膨化大豆粉及成人奶粉,市场购买。原料中的老巢脾、花粉、糠麸、塑料[12]、王台茧衣、蜂蛹和蜜盖蜡等,由重庆市畜牧科学院中蜂试验蜂场提供;食品级酵母粉、面粉、玉米粉、酒精、饲料级麦麸、甘油,市场购买。
1.3 引诱剂组方设计
试验共设置9种引诱剂处理,A~F为各引诱剂组方,分别为新鲜巢脾50 g、蜂蜜50 g、花粉100 g、蜡渣40 g(A),新鲜巢脾70 g、蔗糖50 g、大豆粉100 g、塑料0.02 g(B),新鲜巢脾90 g、葡萄糖50 g、奶粉50 g、糠麸40 g(C)、老巢脾30 g、葡萄糖80 g、花粉50 g、塑料0.01 g(D),老巢脾50 g、蔗糖80 g、奶粉100 g、糠麸20 g(E),老巢脾70 g、蜂蜜30 g、大豆粉50 g、蜡渣20 g(F),以奶粉25 g、酵母粉10 g、面粉50 g、麦麸50 g、玉米粉500 g、蜂蜡25 g、蜂蜜25 g及甘油30 g(CK1),王台茧衣10 g、蜂蛹40 g、食用酒精200 g、王台蜡10 g和蜜盖蜡10 g(CK2),老巢脾30 g和花粉30 g(CK3)为对照。
1.4 制料方法
引诱剂A和引诱剂F的制料:将粉碎的巢脾、蜡渣、花粉混匀后,将溶化的蜂蜜倒入混合料中,边倒边搅匀,装入密闭容器内备用。
引诱剂B~E和CK3的制料:将各种粉碎的原料按一定方法配制[13-14],并混匀装入密闭容器内备用。
CK1的制料:将奶粉、面粉、酵母粉、麦麸和玉米粉混匀,将蜂蜡放于蜂蜜中,加热蜂蜡使之融化成液体,再迅速倒入事先混匀的干饲料中,快速搅拌,直至颗粒均匀细小,最后加入甘油并搅匀,装入密闭容器内备用[15]。
CK2的制料:取蜂王王台茧衣l份、蜂蛹4份浸入20份食用酒精中,加温到60 ℃,保温5 h后,常温下放置3~6 d,过滤40目,得到提取液装瓶密封备用。用蜜盖蜡和王台蜡制取纯蜂蜡。将纯蜂蜡初步敲碎,放入冰柜中冷冻24 h,取出放入粉碎机中粉碎至40目,或不经冷冻直接将纯蜂蜡制成薄片。将提取液均匀地喷洒到粉碎蜂蜡中,装入密闭容器内备用[16]。
1.5 试验方法
引诱剂的筛选试验分初选和终选。初选时,每3种引诱剂为1组,置于一个自制昆虫饲养杯中,9种引诱剂分 3杯,选出有较多存活幼虫的引诱剂,重复3次。然后将初选得到的引诱剂重新组合进行终选试验,重复3次,从中选出引诱大蜡螟幼虫数量最多的引诱剂为最佳引诱剂。
1.5.1 初选引诱剂试验。取3个大蜡螟幼虫饲养杯,每个杯内底部靠边隔开放置3种不同的引诱剂,取出面积为3 cm2的木块卵片,置于杯底中部,然后将大蜡螟幼虫饲养杯置于温度为32 ℃、相对湿度为65%的恒温培养箱中,培养至卵完全孵化成幼虫。幼虫寻找食物时会向杯内的引诱剂食物堆里取食并扎营,最后用10倍放大镜检查每种引诱剂内是否有大蜡螟幼虫,将引诱剂内扎营的大蜡螟幼虫判定为引诱成功的幼虫,而引诱剂内没有扎营的大蜡螟幼虫则判定为引诱失败,观察3 d左右。试验重复3次。
1.5.2 终选引诱剂试验。将初选试验中每个自制昆虫饲养杯内吸引幼虫数较多的引诱剂重组进行终选试验。取1个自制昆虫饲养杯,将初选到的3种较优秀的引诱剂隔开靠边置于杯底部,将欲孵化的卵片置于杯中央,按照初选大蜡螟幼虫的培养方法进行培养,置于32 ℃、相对湿度为65%的恒温培养箱中,从大蜡螟卵全部孵出幼虫静置5 h后开始观察,每隔12 h计数1次,约至132 h,在10倍放大镜下对每种引诱剂下面的幼虫数进行计数,重复3次。以引诱剂内扎营的大蜡螟幼虫数量占饲养杯中大蜡螟总幼虫数的百分比大小来判断引诱剂优劣。
1.6 指标测定
1.6.1 大蜡螟幼虫引诱率。首先,用放大镜对准透明的自制昆虫饲养杯杯底,计数每种引诱剂下的幼虫数,然后计算出每个饲养杯内引诱的大蜡螟幼虫总数。大蜡螟幼虫引诱率为每种引诱剂内吸引大蜡螟幼虫数占该饲养杯内存活大蜡螟幼虫总数的百分率。
1.6.2 引诱剂的营养成分。将配置的大蜡螟幼虫引诱剂送至重庆市畜牧科学院饲料检测中心进行水分、粗脂肪、粗蛋白和pH值测定。水分依据GB/T 6435—2014测定,粗脂肪依据GB/T 6433—2006测定,粗蛋白依据 GB/T 6432—1994测定,以及pH参考PH-3C仪器说明书测定。
1.7 数据处理
试验结果用3次重复试验的大蜡螟幼虫引诱率的平均数±标准误表示,采用单因素方差分析进行差异显著性检验,取显著性水平为0.05。利用SPSS 21统计软件分析。
2 结果与分析
2.1 不同引诱剂对大蜡螟幼虫的引诱效果
对9种引诱剂对大蜡螟幼虫的吸引程度进行了引诱评价,对引诱剂进行初选。由表1可知,9种引诱剂对大蜡螟幼虫的引诱表现不同,其中引诱剂A、CK2和CK3均能成功引诱大蜡螟幼虫,其对大蜡螟幼虫引诱率分别为(100.00±0.00)%、(22.30±21.30)%和(77.70±21.30)%,其他处理引诱剂没有引诱效果。
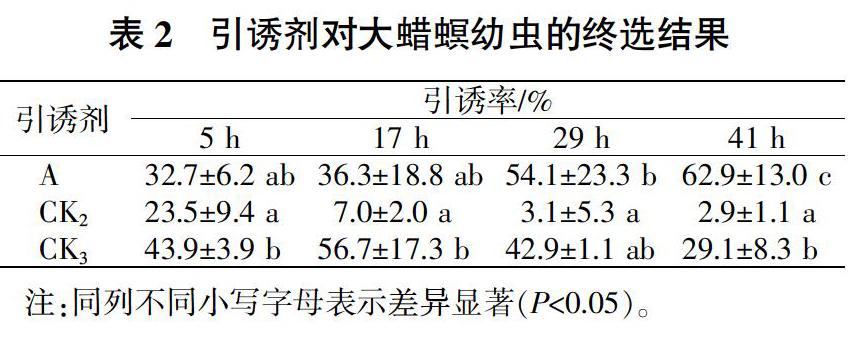
将初选试验中筛选到的较优秀的引诱剂A、CK2和 CK3进行终选试验。由表2可知,在卵片孵化成幼虫后5 h时,引诱剂A、CK2和CK3引诱剂均能吸引大蜡螟幼虫,引诱剂CK3吸引率最高,为(43.9±3.9)%;引诱剂A次之,为(32.7±6.2)%;引诱剂CK2最少,为(23.5±9.4)%。统计分析表明,引诱剂CK3显著优于CK2(P<0.05),与引诱剂A差异不显著(P>0.05);17 h时,引诱剂CK3对幼虫的引诱率最高,达(56.7±17.3)%,显著优于CK2的(7.0±2.0)%(P<0.05),但与引诱剂A的(36.3±18.8)%差异不显著(P>0.05);29 h时,引诱剂A的引诱率最高,达(54.1±23.3)%,显著優于CK2的(3.1±5.3)%(P<0.05),优于CK3的(42.9±1.1)%,但差异不显著(P>0.05);41 h时,引诱剂A的引诱率为(62.9±13.0)%,显著优于CK3的29.1±8.3%和CK2的(2.9±1.1)%(P<0.05),CK3的引诱率显著优于CK2(P<0.05)。由此可知,引诱剂A为本试验筛选的最佳引诱剂。
2.2 不同引诱剂部分常规营养指标
引诱剂常规营养指标检测结果见表3,大蜡螟幼虫喜欢的引诱剂A、CK2和CK3的水分含量为15.57%~18.32%,水分含量均较大蜡螟幼虫不喜欢的引诱剂 B、C、D、E、F及CK1多。引诱剂B、C、D、E、F的水分含量分别为5.53%、5.56%、9.08%、3.65%、10.95%。由此推测,引诱剂的水分对大蜡螟幼虫的引诱效果有影响。
3 结论与讨论
3.1 水分是构成大蜡螟引诱剂的关键成分
本试验中,能诱导大蜡螟幼虫的引诱剂的水分含量为15.57%~18.32%,水分含量均较没有效果的引诱剂多。由此推测,引诱剂的水分含量对大蜡螟幼虫引诱效果有影响。引诱剂水分含量高低与大蜡螟幼虫的存活有很大关系,水分含量太低可能不适合幼虫生存生长。此外,引诱剂成分对大蜡螟幼虫的引诱率也有影响,带有大量花粉、巢脾、蜂蜜和蜡渣的食料更能吸引大蜡螟幼虫。
3.2 大蜡螟对蛋白饲料有偏嗜性
本试验中,大蜡螟小幼虫能存活的诱导剂,其蛋白含量分别为15.13%、1.52%和14.90%;在大蜡螟幼虫出壳41 h后,大蜡螟幼虫最终选择带有新鲜巢脾、蜂蜜、花粉和蜡渣的诱导剂。41 h后带有巢脾、花粉、蜂蜜和蜡渣的引诱剂较仅由老巢脾和花粉制成的引诱剂更能引诱大蜡螟幼虫,其吸引率为(62.9±13.0)%。孵化2 d后大蜡螟幼虫喜欢蛋白含量较高的诱导剂。推测大蜡螟幼虫在生长过程中对蛋白质引诱剂具有偏嗜性。
3.3 大蜡螟卵幼虫存活率可能与引诱剂的水分含量有关
在初选引诱试验过程中,水分含量高的引诱剂能成功吸引大蜡螟幼虫让幼虫扎营,而6种水分含量低于15%的引诱剂不能成功引诱大蜡螟幼虫,也不能让大蜡螟卵成功孵化。由此推测,大蜡螟幼虫,特别是刚孵化出的小幼虫,需要在一定水分含量的引诱剂中才能存活。低水分引诱剂不易让大蜡螟幼虫存活,这表明大蜡螟幼虫的存活对食物水分较依赖。使大蜡螟幼虫存活的食物水分含量界限还需进一步试验研究。
蜜蜂卵孵化的最适相对湿度范围为90%~95%,低于50%时不孵化[17,3]。因此,仔脾空间上的湿度较其他巢脾高,这可能与大蜡螟幼虫喜欢上仔脾有一定关系。防治蜂群大蜡螟幼虫可以从箱底湿度和食物水分方面进行考虑,但调控湿度和食物水分来防治大蜡螟幼虫还需进一步思考和试验。
3.4 引诱剂脂肪含量和pH值对大蜡螟幼虫喜好的影响
大蜡螟幼虫喜欢的引诱剂中粗脂肪含量为27%~39%。在引诱剂中粗脂肪含量为12%~44%范围内,其食物的粗脂肪与大蜡螟幼虫的喜好的关系有待进一步研究。大蜡螟幼虫成活可能与引诱剂水溶液pH值有关,刘位芬等[18]、杨 爽等[19]报道,大蜡螟幼虫喜欢中蜂巢脾,不喜欢西蜂巢脾。周 萍等[20]检测中、西蜂巢脾理化指标发现,二者酸值差异较大,中蜂蜂蜡的酸值较低,只有4.60~7.23;西蜂蜂蜡的酸值较高,达17.30~20.60。本试验结果显示,能成功引诱大蜡螟幼虫的引诱剂 pH值为3.39~4.78,这时孵化出的幼虫易存活;不能成功引诱大蜡螟幼虫的引诱剂pH值在4.78以上,这时孵化出的幼虫不易存活。由于蜂蜡酸值与引诱剂水溶液pH值尚无明确的直接关系,大蜡螟幼虫存活是否与pH值有关,这与文献报道的大蜡螟幼虫喜欢酸值更低的中蜂巢脾而不喜欢酸值更高的西蜂巢脾结果是否有关则有待进一步研究。
4 参考文献
[1] 国家畜禽遗传资源委员会.中国畜禽遗传资源志(蜜蜂志)[M].北京:中国农业出版社,2010.
[2]梁勤,陈大福.蜜蜂保护学[M].北京:中国农业出版社,2009.
[3] JAMES D E,JASON R G,ASHLEY M.Standard methods for wax moth research[J].Journal of Apicultural Research,2013,52(1):1-17.
[4] 杜辉煌.如何解决蜂群的巢虫危害[J].中国蜂业,2015(5):42.
[5] 黄少康,王建鼎.大蜡螟的生物学研究[J].中国养蜂,2001(5):8-10.
[6] 刘奇志,田里.国内外大蜡螟防治方法研究现状[J].安徽农业科学,2008(13):5495-5496.
[7] KWADHA C A,ONG′AMO GEORGE O,NDEWGWA P N,et al.The biology and control of the greater wax moth,Galleria mellonella[J].Insects,2017,8(2):61.
[8] MISHRA S N,PADHI J,JENA B C,et al.Biology of greater wax moth Galleria mellonella in honey bee colonies[J].Journal of Plant Protection & Environment,2018,6(1):40-42.
[9] TASZ?覵OW P,VERTYPOROKH L,WOJDA I.Humoral imm-une response of Galleria mellonella after repeated infection with Bacillus thuringiensis[J].Journal of Invertebrate Patholo-gy,2017,2:149.
[10] 徐祖蔭,和绍禹,杨志银.改良式巢虫阻隔器的安装使用方法及防治效果[J].蜜蜂杂志,2013(4):24-26.
[11] 杨柳,漆文芳,张串联.诱杀巢虫技术研究报告[J].中国蜂业,2015(3):28-30.
[12] YANG J,YANG Y,WU W M,et al.Evidence of polyethylene biodegradation by bacterial strains from the guts of plastice-ating waxworms[J].Environmental Science & Technology,2014,48(23):13776-13784.
[13] 谢和芳,朱汉春,袁树楷,等.生物试验设计(畜牧版)[M].重庆:西南师范大学出版社,2013.
[14] 刘安芳,伍莲.生物统计学[M].重庆:西南师范大学出版社,2013.
[15] 吴艳艳,周婷,王强,等.大蜡螟饲料配方的优化[J].昆虫知识,2010(2):409-413.
[16] 杨爽,刘位芬,梁铖,等.蜂群中大蜡螟蛹及成虫雌雄的鉴别方法[J].蜜蜂杂志,2017,37(3):8-10.
[17] 汪天澍,刘芳,余林生,等.蜜蜂蜂群温湿度调节研究进展[J].生态学报,2015(10):3172- 3179.
[18] 刘位芬.不同巢脾对大蜡螟幼虫生长发育的影响[J].蜜蜂杂志,2016(7):9-11.
[19] 杨爽,梁铖,宋文菲,等.大蜡螟幼虫和成虫对不同蜜蜂巢脾的选择[J].江苏农业科学,2014(8):254-255.
[20] 周萍,胡福良,胡元强,等.中、西蜂蜂蜡理化指标分析及蜂蜡标准化建议[J].中国蜂业,2007(10):7-9.
基金项目 重庆市技术创新与应用示范(cstc2018jscx-msyb0
279,cstc2019jscx-lyjsAX0006);国家现代农业(蜜蜂)产业技术体系建设专项(CARS-44-SYZ14)。
通信作者
收稿日期 2020-05-19

