农田防护林对田间地表节肢动物分布的影响*——以昌图县为例
边振兴, 杨祎博, 果晓玉, 张宇飞, 于 淼
农田防护林对田间地表节肢动物分布的影响*——以昌图县为例
边振兴, 杨祎博, 果晓玉, 张宇飞, 于 淼**
(沈阳农业大学土地与环境学院 沈阳 110866)
提升农田生物多样性是当前生态农业研究的热点问题。为探讨农田防护林的生物多样性保护功能, 本研究在辽宁省昌图县金家镇选取8个农田-防护林单元(每个单元即为1个田块), 使用陷阱法调查了不同类型林带(完整型、残缺型、消亡型)相邻的农田中, 距林带不同距离处(0 m、50 m、100 m、150 m、200 m)地表节肢动物的分布情况, 同时记录林带内的植被群落特征。采用方差分析以及群落排序的方法, 分析了林带类型、距离梯度以及林带植被结构对农田地表节肢动物分布的影响。研究结果表明: 1)与消亡型相比, 完整型和残缺型林带相邻的农田物种多度显著较高, 物种多样性在各类型林带农田间无显著差异, 与完整型及残缺型林带相邻的农田维持着区别于消亡型林带的地表节肢动物群落结构。2)完整型和残缺型林带相邻的农田物种多度梯度变化显著, 随距林带距离的增加均呈由低到高的变化趋势; 不同类型林带农田中, 物种多样性随距林带距离的增加逐渐递减, 边缘效应显著。3)林带中草本层物种多度和乔木层盖度是影响农田地表节肢动物群落分布的主要因子, 共解释了35.4%的节肢动物数量变异; 不同节肢动物物种对林带植被结构的响应存在差异, 步甲和蜘蛛作为当地农业景观中主要的天敌类群, 与上述林带植被结构因子关系密切: 林带内较高的草本层物种多度有利于增加农田中某些步甲常见种的多样性, 而较高的乔木层盖度有利于增加蜘蛛目常见科的多样性。研究结果表明, 农田防护林作为研究区主要的非耕作生境类型, 能够显著提升相邻农田中地表节肢动物的多度, 对于物种多样性的提升作用则不明显; 林带内草本层物种多度以及乔木层盖度对蜘蛛、步甲等多类天敌多样性保护具有积极作用。因此, 加强农业景观中现有林地的改造和提升, 如营造适宜盖度的上层林木以及丰富的林下植被, 能够提升现有林地的生境质量, 进一步发挥其对农田生物多样性的保育功能。
农田防护林; 昌图县; 地表节肢动物; 分布; 群落结构
在过去的一个多世纪中, 农业集约化水平随粮食需求的增加不断提升, 大量的自然、半自然用地因此丧失或破碎。以往研究表明, 农业生产已成为其背景景观中生物多样性降低的关键驱动因素[1-2], 并导致了多种生态系统服务的退化, 如传粉播种、水土涵养、害虫管控等[3]。在农业景观中, 非耕作生境因其所受干扰较小, 植被多样性丰富, 可为生物提供庇护场所、越冬场所、食物源、物种源等[4-5]。有研究指出, 高异质性、高比例的非耕作生境往往能够维持较高水平的生物量, 进而削弱农业集约化对生物多样性产生的负面影响[6-8]。通过对非耕作生境的高效管理, 进一步维持农业景观生物多样性, 对于生态农田的建设以及农业景观的优化配置具有重要意义。
三北防护林工程是伴随我国改革开放同步开启的重大林业生态工程, 农田防护林作为防护林体系的主要林种[9], 是我国北方地区防风系统的重要组成部分。国内众多学者对于农田防护林在减缓风速、提高作物产量、水土涵养等方面的防护效益开展了积极探讨。如张帅等[10]研究表明, 在不同风速条件下农田防护林的防风效能均达50%以上, 平均有效防护面积最高达90.1%; 史晓亮等[11]研究认为, 农田防护林对高、中、低不同生产潜力区的玉米()增产率分别为2.4%、6.81%和8.85%; 孟平等[12]研究表明, 农田防护林可降低12.3%的农田蒸散量。近年来, 农业景观中林地生境所发挥的生物多样性保护功能也逐渐受到关注。相比于集约化农田, 这些异质性的林地斑块、线状林地为众多生物提供了栖息地、替代食源等必要的生存资源[13-14], 有利于大部分农田物种多样性的维持, 如无脊椎动物、植物、小型哺乳动物等[15-16]。同时, 线状林地(如树篱)可作为多种分类群的扩散廊道[17], 通过增加生物获取关键资源的可能性[18], 促进生物防治、传花授粉等生态系统服务功能的发挥[19-20]。其中, 地表节肢动物是农田生态系统的重要组成部分, 在维持生态系统结构与功能方面扮演着十分重要的角色[21], 系统认识农田中的物种分布格局及其影响因素是进行非耕作生境合理布局的基础。然而, 针对我国三北地区大量存在的农田防护林, 以往结合地表节肢动物探讨其生态效益的研究相对薄弱, 部分退化林地对节肢动物空间分布及群落结构的影响尚不明晰。
基于此, 本文以我国三北防护林体系工程建设的典型县域——辽宁省昌图县为例, 对区内典型农田-防护林单元开展生物多样性调查, 探讨研究: 1)林带类型对相邻农田地表节肢动物分布的影响; 2)各类型林带农田不同距离梯度处地表节肢动物空间分布特征; 3)林带植被特征对相邻农田地表节肢动物群落分布的影响。本文旨在未来不新增非耕生境的前提下, 为农田防护林的合理配置及布局优化提供依据, 以期改善现有林地的生境质量, 促进农田生物多样性保护和生态系统服务功能提升。
1 材料与方法
1.1 研究区概况
辽宁省铁岭市昌图县地处123°32′~124°26′E, 42°33′~43°29′N, 主要作物为玉米(), 是东北平原典型的玉米种植区。研究样地位于昌图县西南部, 地处辽河冲积平原, 平均海拔100~200 m。该区属温带湿润季风大陆性气候, 年均气温6.7 ℃, 极端最高气温35.6 ℃, 极端最低气温-31.5 ℃, 年平均降水量654.6 mm。风沙和春旱是该地区的主要灾害因子, ≥8级大风日76 d, 最多风向为南西南(SSW)。防护林主带方向为西西北(WNW)~东东南(ESE), 主副林带垂直。土壤为草甸棕壤, 质地较黏重, 但肥力较高。经实地调查, 研究样地林网防护下的农作物均为玉米。基于研究区2011年土地利用现状数据, 运用GIS软件以及无人机技术, 分析研究区内农田防护林网的空间分布特征, 在此基础上筛选出林网形态相对完好的农田-防护林单元。本文共选取8个采样单元(图1), 规格均为500 m×500 m, 编号为S1#-S8#。各单元内林带形态多样, 以期反映该区域防护林整体特征。
1.2 林带类型划定
随着三北防护林体系建设工程的不断深入, 受造林密度不佳、树种选择不当、防护意识淡薄等人为因素以及生理过熟、病虫害、立地条件恶劣等自然因素的影响, 大面积的农田防护林出现了衰退现象[9,22]。尤其是不合理的人为干扰, 导致原有林带发生明显分化, 严重影响了防护效能的发挥[23]。在探讨防护林带的生态效益之前, 有必要对现有林带进行类型区分。
基于此, 本文以林带连续性(林带占边界百分比)作为分类的依据, 针对林带已经消亡的边界, 根据其是否具备草地带来进行分类。考虑到数据完整性, 共对8个采样单元中的30条林带进行分类, 划定结果如表1所示。
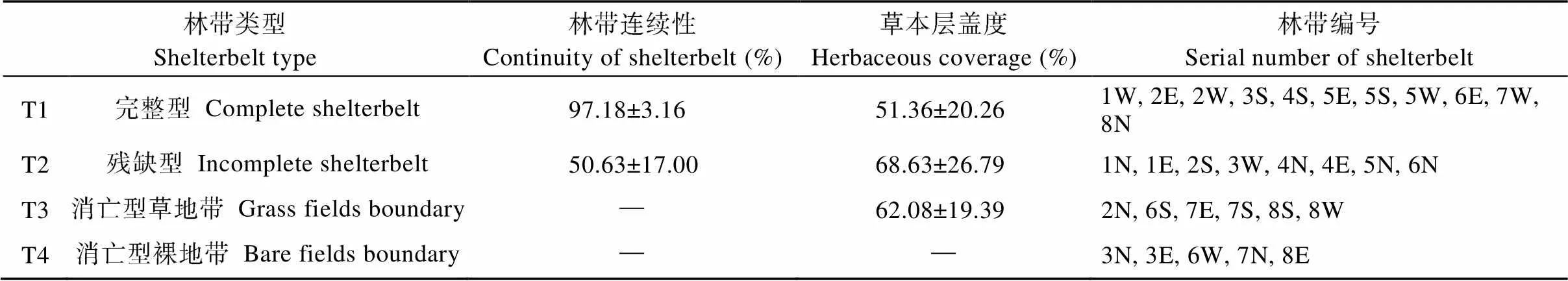
表1 林带类型划定表
数字1-8代表图1中的8个取样单元; 字母E、W、S、N分别代表取样单元内东侧、西侧、南侧、北侧林带。The numbers 1-8 represent 8 sampling units shown in the figure 1; the letters E, W, S, and N represent the east, west, south, and north shelterbelts within the sampling unit, respectively.
经实地调查, 该区域内的农田防护林网已基本成型, 网眼整齐, 造林密度偏大, 主要林带树种为杨树(L.)。各类型林带的垂直植被结构如下:
完整型林带(T1)长450~500 m, 宽5~16 m。乔木层均为杨树(sp.)纯林, 多为3~6行, 平均胸径8.09 cm, 平均树高11.5 m, 林分紧凑, 形态完整。林下草本层平均盖度为51%, 物种数为16种。
残缺型林带(T2)长150~350 m, 宽4~13 m。乔木层除2S为旱快柳(Koidz)外, 其余林带均为杨树纯林, 多为1~4行, 平均胸径13.84 cm, 平均树高14.5 m, 缺株断空现象普遍。林下草本层植被丰富, 平均盖度为69%, 物种数为18种。
消亡型草地带(T3)长500 m, 宽3~8 m。无乔木存在, 草本层平均盖度为62%, 物种数为20种。
消亡型裸地带(T4)长500 m, 宽2~3 m。无植被覆盖, 紧邻硬化完善的农村道路, 道路宽度多在3~6 m。
1.3 地表节肢动物取样鉴别
于2018年8月15—30日开展实地调查, 使用陷阱法采集地表节肢动物。各单元内布样方案如图2所示: 垂直于林带布设采样样带, 均于对应林带中心位置(250 m)起始, 以50 m为步长向农田内部布设陷阱。每条样带设置5个距离梯度(距林带0 m、50 m、100 m、150 m、200 m), 每个梯度包含3个陷阱且方向平行于对应林带, 同一距离梯度陷阱间距为10 m。陷阱布设方法为: 将pp塑料杯(底部直径4.5 cm, 顶部直径9.5 cm, 高11 cm, 容积500 mL)埋入土壤中, 杯口与地表平齐, 在杯中放入150~ 200 mL乙二醇溶液(20%)和一滴洗涤剂, 将杯盖用3根铁丝加以固定, 以防雨水干扰。使用手持GPS采集陷阱位置信息, 方便后续收样。
陷阱共布设480个, 在野外放置6 d后取回, 将陷阱瓶中的地表节肢动物放到预先编好编号的PE瓶中, 加入浓度为75%的酒精进行保存, 尽快带回实验室进行鉴定分类。鉴定时使用ZEISS Stemi2000- C体式显微镜, 并参考《中国土壤动物检索图鉴》等[24-28]。除蜘蛛鉴定到科以外, 其他地表节肢动物鉴定到种。
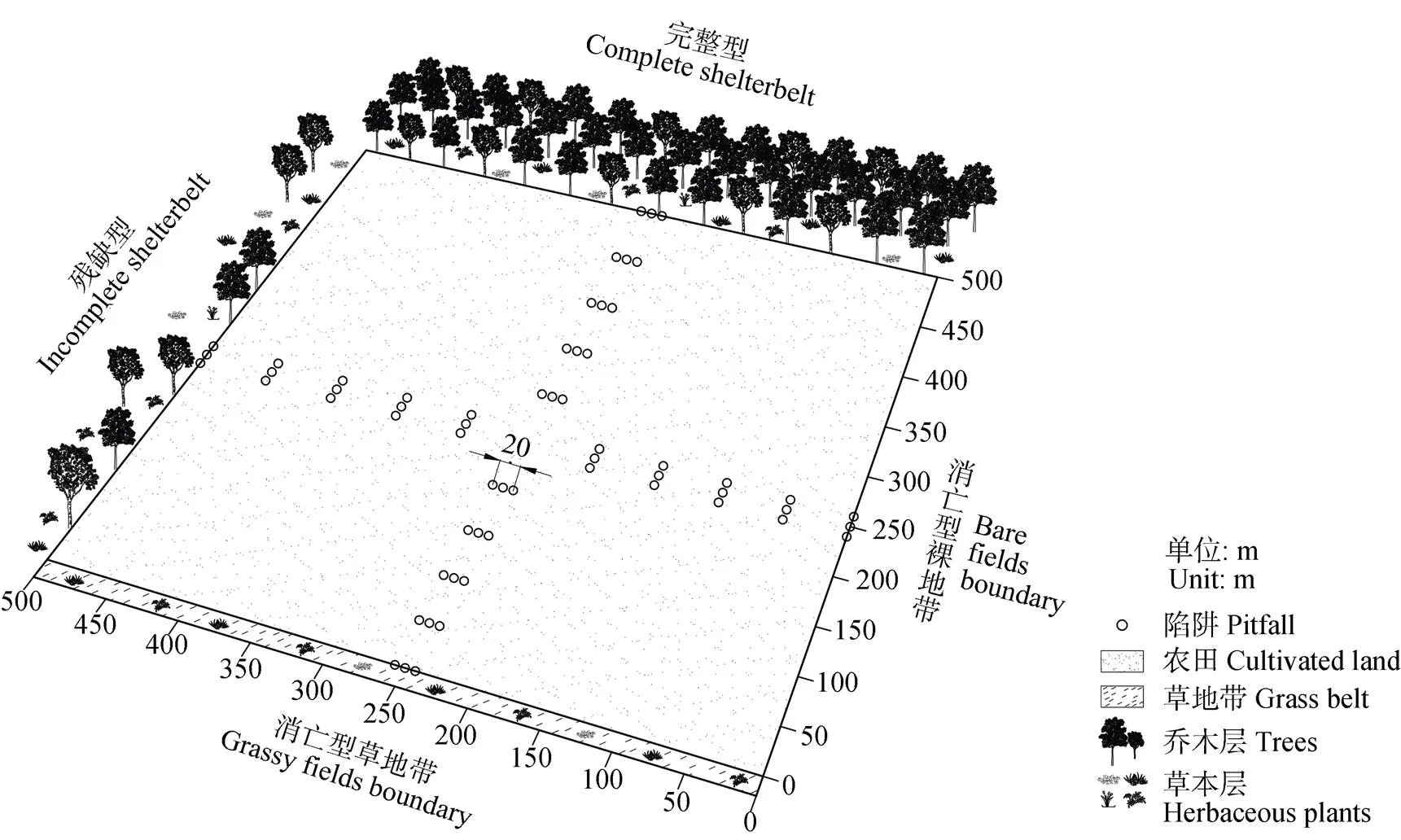
图2 不同类型林带示意及采样单元内陷阱布设方案
1.4 植被类型调查
对各林带开展植被调查, 记录边界带宽度(BW)以及乔木层盖度(TC); 在各林带起始陷阱布设点附近随机设置两个1 m×1 m的草本层植物采集样方, 记录样方内草本层植物的盖度、种名、株(丛)数以及高度。合并各林带两个样方的物种信息, 计算草本层物种多度(HA)、丰富度(HR)以及草本层盖度(HC), 以上述5个指标表征林带植被结构特征。
1.5 分析方法
地表节肢动物群落多样性指数通过以下几个参数进行描述, 包括物种多度、物种数、Shannon- Wiener多样性指数()和Simpson优势度指数(), 计算公式分别为:
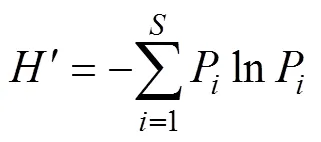

式中:为样点内物种数;P为每个样点中第个物种的多度占该样点地表节肢动物总多度的比例。各多样性指数使用PAST软件[29]进行计算。合并同一距离梯度处的3个陷阱数据作为该样点的取样数据[30], 采用双因素方差分析(Two-way ANOVA)检验林带类型、距离梯度及其交互作用对地表节肢动物多度、物种数、多样性和优势度的影响。为检验样本数据的独立性, 对各采样单元不同类型林带对应的地表节肢动物分布数据进行Pearson相关分析, 采用的数据为林带对应田间各样点处的节肢动物多度, 对于不符合正态分布的样本采用Spearman相关分析。结果显示, 各采样单元内不同类型农田节肢动物多度分布均不存在相关关系, 即各类型样本满足独立性条件假定。
合并每条林带对应田间的5个样点(共计15个陷阱)数据, 采用单因素方差分析(One-way ANOVA)比较不同类型林带地表节肢动物多度及多样性的差异。采用基于CNESS (Chord-Normalized Expected Species Shared)相似系数的非度量多维尺度法(Non-metric Multi-dimensional Scaling, NMDS)比较不同类型林带田间地表节肢动物群落结构的差异性。合并同一类型、同一距离梯度的陷阱数据, 采用单因素方差分析比较相同类型林带不同距离梯度处地表节肢动物多度及多样性的差异, 采用最小显著法(LSD)进行两两比较, 对于不符合正态分布的数据采用非参数检验。方差分析通过SPSS 20.0软件完成, 非度量多维尺度法(NMDS)分析使用PAST软件完成。
去趋势对应分析(detrended correspondence analysis, DCA)显示物种群落排序结果呈线性(排序轴梯度长度为1.2<3), 因此选用线性模型的RDA分析。使用CANOCO 5软件中的冗余分析(redundancy analysis, RDA)探讨地表节肢动物群落与林带植被结构因子间的关系。参与冗余分析的样本共计30份, 每份样本对应一条林带。物种数据采用地表节肢动物多度数据, 通过合并林带对应田间5个样点(共计15个陷阱)数据获得, 并经平方根转换[31]; 表征林带植被特征的结构因子包括边界带宽度、乔木层盖度、草本层盖度、草本层物种多度以及丰富度。
2 结果与分析
2.1 地表节肢动物群落特征
8个单元共捕获地表节肢动物12 230头, 隶属于3纲, 8目, 26科, 38种。其中优势物种为蟋蟀科(Gryllidae)黄脸油葫芦()、步甲科(Carabidae)中华婪步甲()和麻青步甲(), 共计9 412头, 占地表节肢动物总个体数的76.96%。常见物种(科)包括步甲科附边青步甲()、大星步甲()和金星步甲(), 蜘蛛目(Araneae)幽灵蛛科(Pholcidae)和转蛛科(Trochanteriidae)以及红蝽科(Pyrrhocoridae)地红蝽(), 总计2 351头, 占地表节肢动物总个体数的19.22%。优势及常见物种(科)占地表节肢动物总个体数的96.18%; 其余29种物种为稀有物种, 占地表节肢动物总个体数的3.82%。地表节肢动物类型及数量见表2。
2.2 林带类型、距离梯度对农田地表节肢动物分布的影响
双因素方差分析显示(表3), 林带类型对农田地表节肢动物多度、物种数、Shannon-Wiener指数以及Simpson优势度指数均有显著影响。距离梯度对农田地表节肢动物物种数以及Shannon-Wiener指数有显著影响。二者交互作用对农田地表节肢动物各指数均无显著影响。
2.2.1 林带类型对农田地表节肢动物分布的影响
就物种多度而言(图3a), 完整型(T1)及残缺型(T2)林带相邻的农田显著高于消亡型(T3、T4), 且T1与T2、T3与T4间均无显著差异。物种数则仅表现为残缺型(T2)林带显著较高, 其他类型林带(T1、T3、T4)间无显著差异。由图3b可知, Shannon-Wiener指数以及Simpson优势度指数在各类型林带(T1、T2、T3、T4)间均无显著差异。
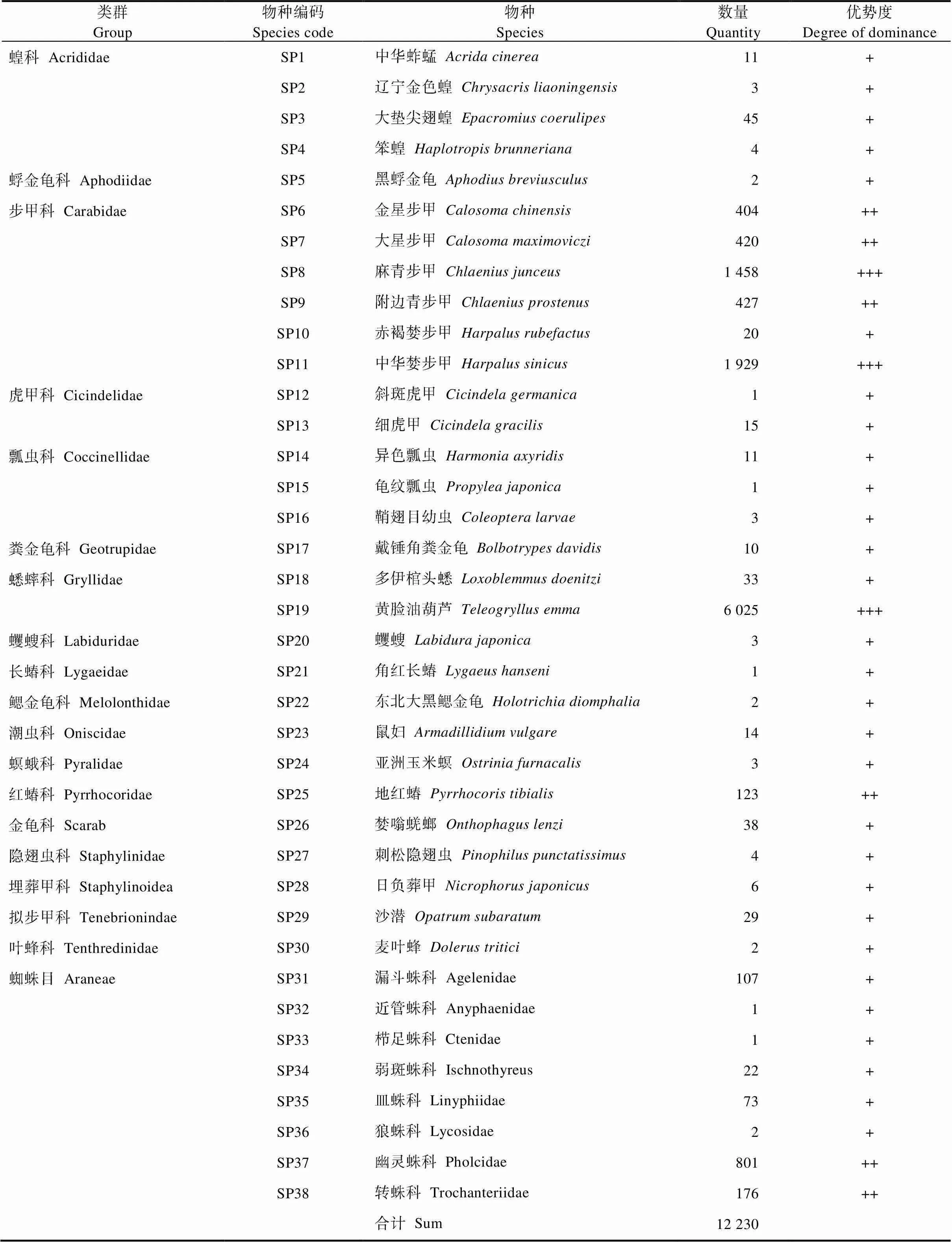
表2 农田防护林内农田地表节肢动物类型及数量统计表
+++表示个体数占总捕获量的10%以上, ++表示个体数占总捕获量的1%~10%, +表示个体数占总捕获量的1%以下。+++ indicates that the number of individuals accounts for more than 10% of the total captures; ++ indicates that the number of individuals accounts for 1%-10% of the total captures; + indicates that the number of individuals accounts for less than 1% of the total captures.

表3 林带类型及距离梯度对农田地表节肢动物分布影响的双因素方差分析
*和**分别表示<0.05和<0.01水平上影响显著。* and ** indicate significant effects at<0.05 and<0.01 levels, respectively.
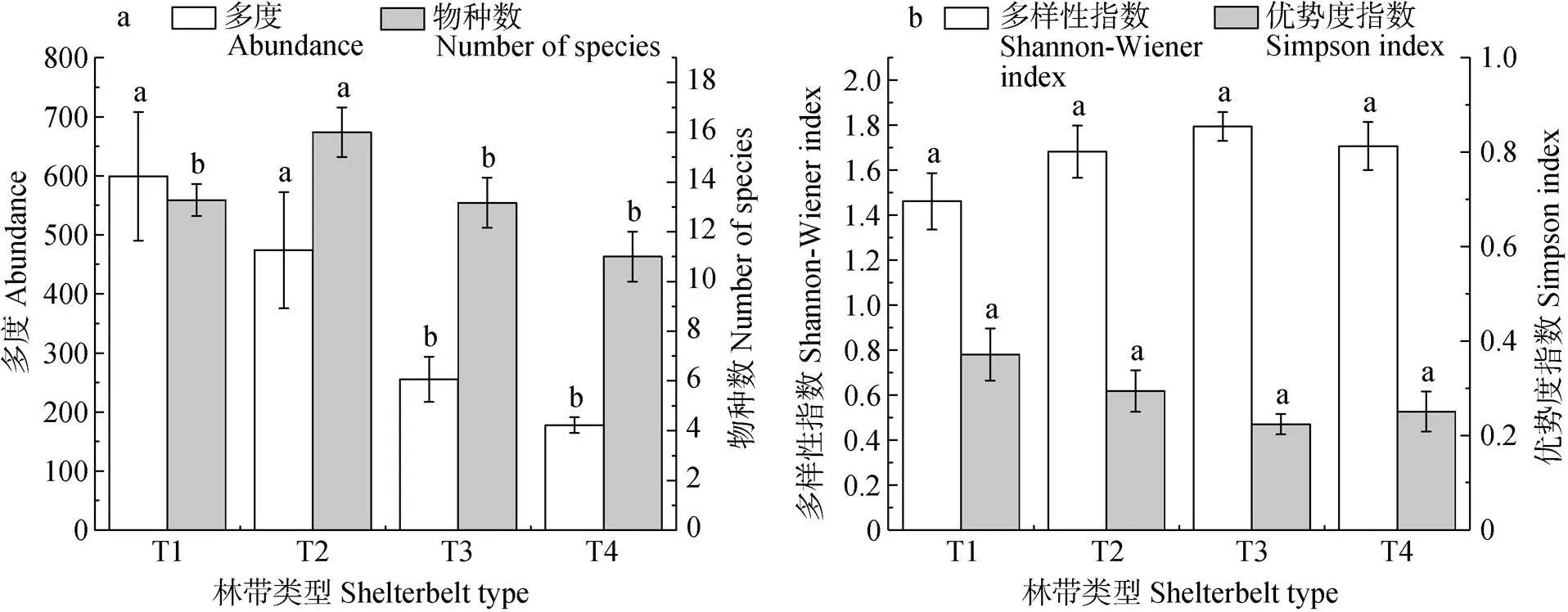
图3 不同类型林带农田地表节肢动物多度、物种数以及多样性
T1: 完整型; T2: 残缺型; T3: 消亡型草地带; T4: 消亡型裸地带。不同小写字母表示不同处理间在<0.05水平差异显著。T1: complete shelterbelt; T2: incomplete shelterbelt; T3: grass fields boundary; T4: bare fields boundary. Different lowercase letters indicate significant differences among treatments at<0.05 level.
非度量多维分析结果表明(图4), 4种类型林带田间地表节肢动物群落存在着较高的异质性。从整体来看, 与完整型(T1)及残缺型(T2)林带相邻的农田更多地分布于第2排序轴下侧; 与消亡型(T3、T4)林带相邻的农田则更倾向分布于第2排序轴上侧。
2.2.2 距离梯度对农田地表节肢动物分布的影响
就物种多度而言, 仅在完整型(T1)和残缺型林带(T2)相邻的农田中发现距离梯度间显著差异, 皆表现为0 m处显著低于其他距离梯度(<0.05), 物种多度随距林带距离的增加总体呈上升趋势。在与消亡型林带(T3、T4)相邻的农田中, 物种多度随距林带距离的增加呈先减少后增加再减少的趋势, 距离梯度间差异未达显著水平(图5)。
Shannon-Wiener指数在各类型林带(T1、T2、T3、T4)农田中皆呈现随距林带距离的增加整体递减的趋势, 验证了边缘效应的存在(图6)。其中, 与完整型(T1)、残缺型(T2)林带以及消亡型草地带(T3)相邻的农田不同距离梯度处存在显著性差异。具体表现为: 与完整型林带(T1)相邻的农田中0 m处显著高于200 m处(=0.033); 与残缺型林带(T2)相邻的农田中0 m处显著高于50 m (=0.004)、150 m (=0.034)以及200 m处(=0.005); 与消亡型草地带(T3)相邻的农田中0 m处显著高于100 m (=0.03)以及200 m处(=0.005), 150 m处显著高于200 m处(=0.026)。
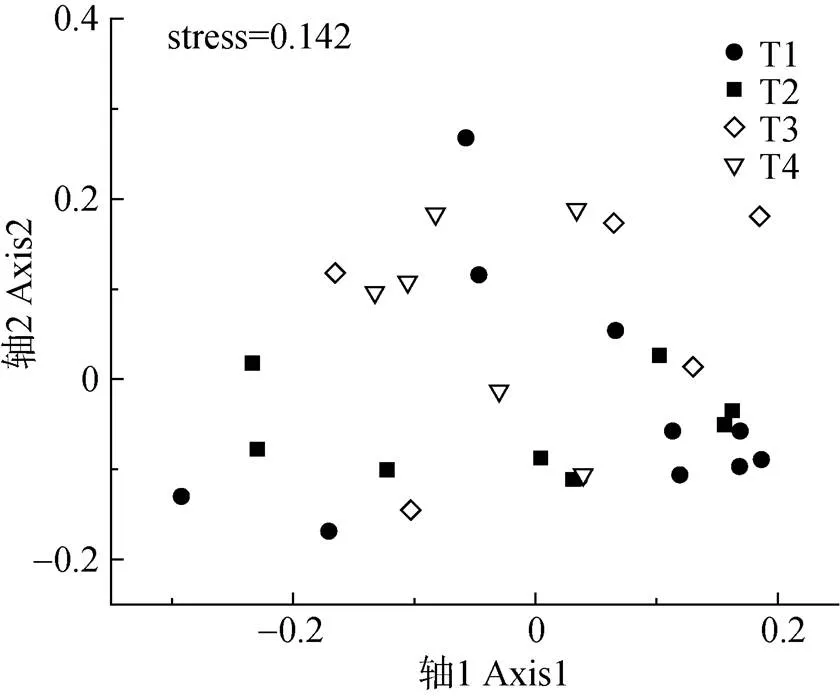
图4 不同类型林带农田地表节肢动物群落非度量多维度分析(NMDS)
T1: 完整型; T2: 残缺型; T3: 消亡型草地带; T4: 消亡型裸地带。T1: complete shelterbelt; T2: incomplete shelterbelt; T3: grass fields boundary; T4: bare fields boundary.
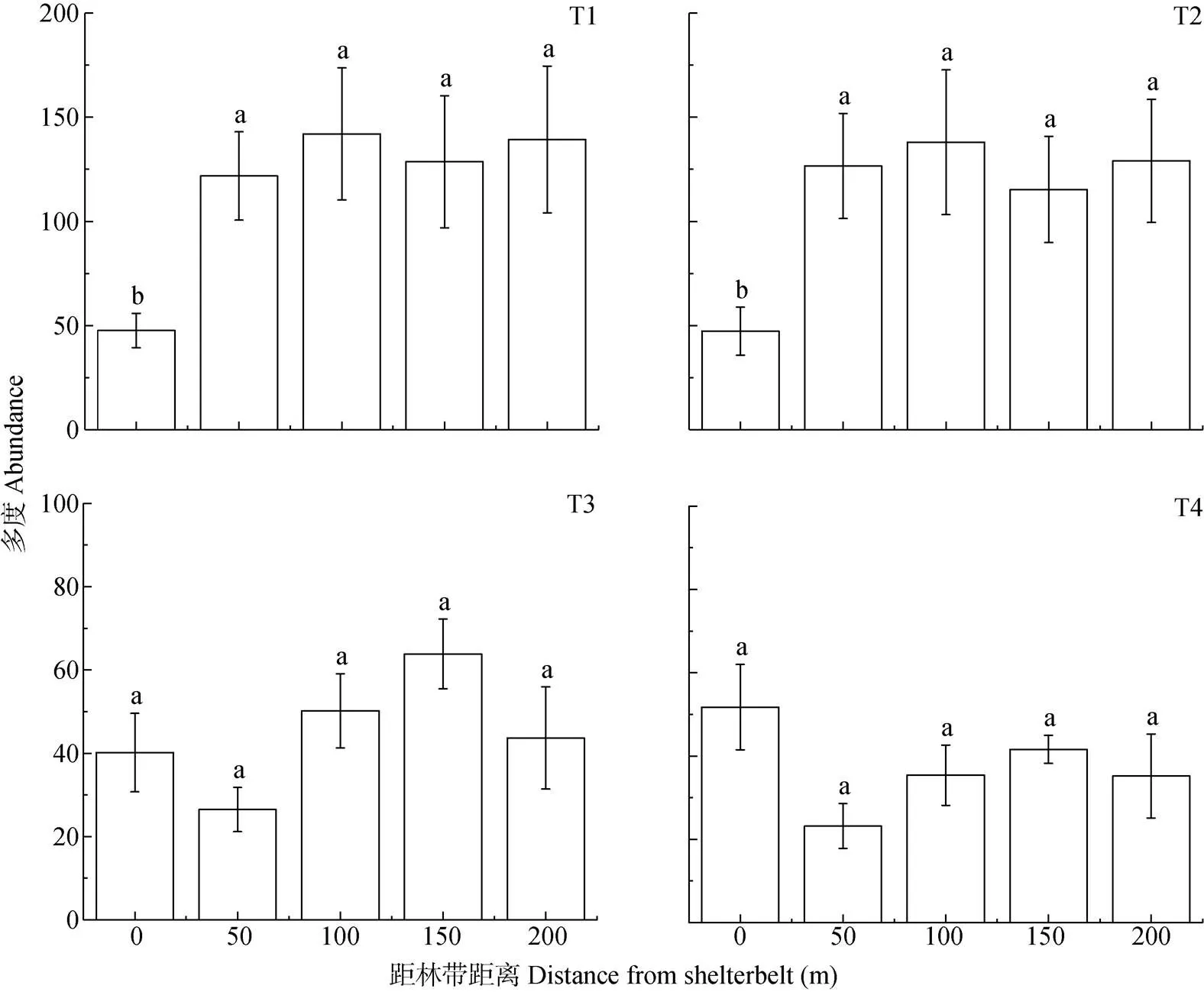
图5 不同类型林带农田不同距离梯度处地表节肢动物多度分布
T1: 完整型; T2: 残缺型; T3: 消亡型草地带; T4: 消亡型裸地带。不同小写字母表示不同处理间在<0.05水平差异显著。T1: complete shelterbelt; T2: incomplete shelterbelt; T3: grass fields boundary; T4: bare fields boundary. Different lowercase letters indicate significant differences among treatments at<0.05 level.
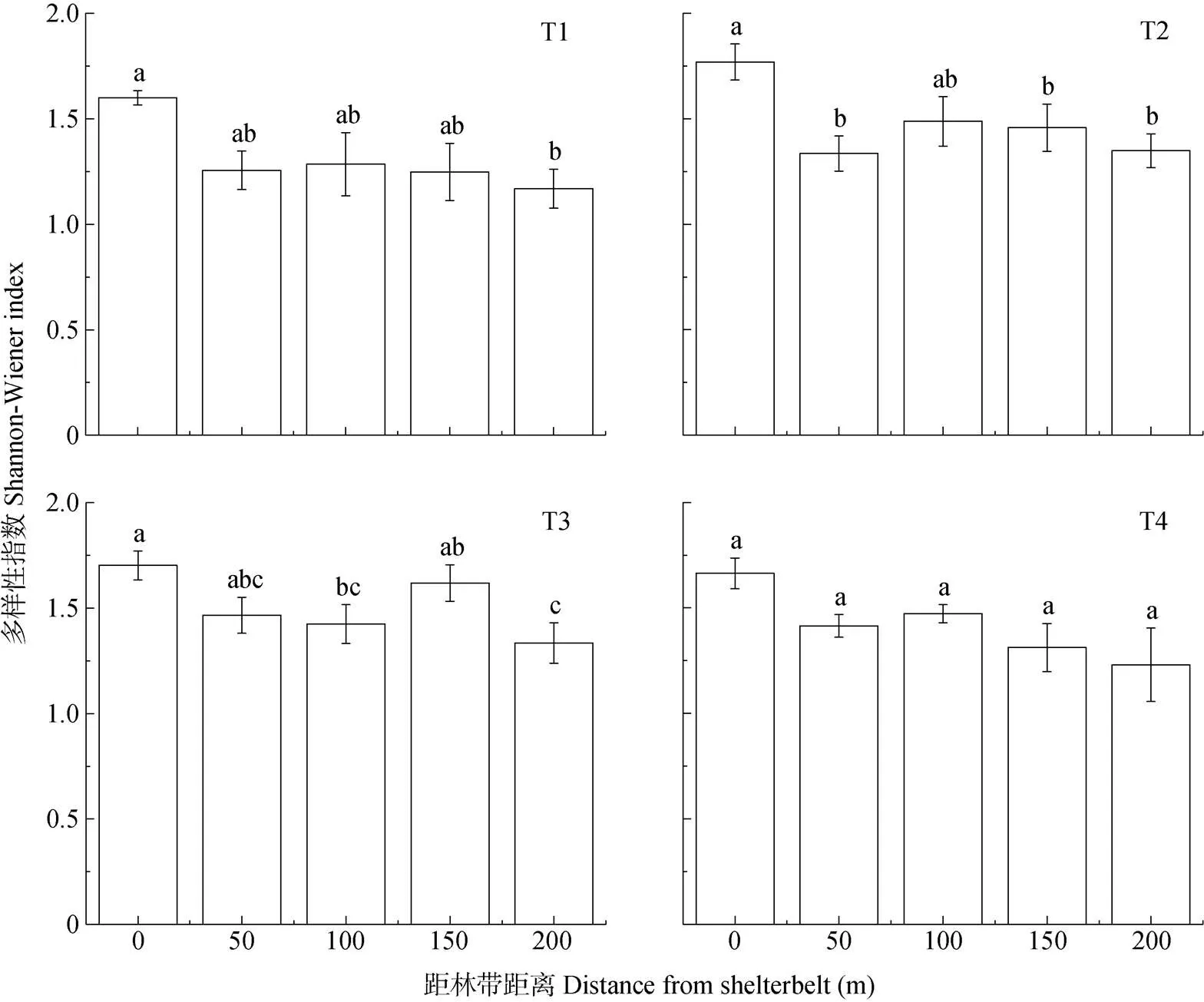
图6 不同类型林带农田不同距离梯度处地表节肢动物多样性指数
T1: 完整型; T2: 残缺型; T3: 消亡型草地带; T4: 消亡型裸地带。不同小写字母表示不同处理间在<0.05水平差异显著。T1: complete shelterbelt; T2: incomplete shelterbelt; T3: grass fields boundary; T4: bare fields boundary. Different lowercase letters indicate significant differences among treatments at<0.05 level.
2.3 林带植被特征对相邻农田地表节肢动物群落分布的影响
RDA排序结果如表4所示。前两轴特征值之和为0.427 2, 累积解释了物种-环境关系的93.19%, Monte Carlo检验显示第1轴和前4轴在统计学上均达极显著水平(<0.01), 表明排序结果可以较好地解释林带植被结构因子与节肢动物群落分布间的关系。
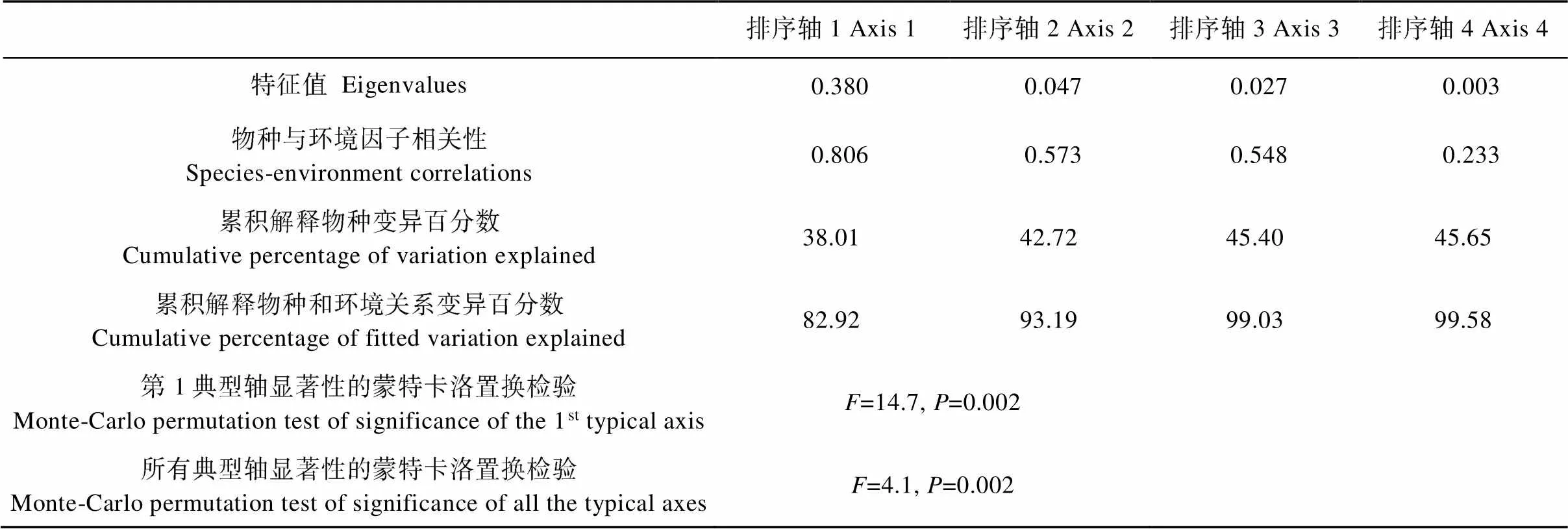
表4 不同类型林带农田地表节肢动物RDA各排序轴的特征值、物种与环境因子的相关系数
偏RDA (partial RDA)分析结果显示(表5), 草本层物种多度以及乔木层盖度对地表节肢动物群落分布的影响达显著性水平, 单独解释率分别为28.8%和6.6%, 选择这两个关键解释变量绘制RDA二维排序图(图7)。由表4可知, 第1排序轴特征值为0.380, 物种与环境梯度的相关性达0.806, 草本层物种多度和乔木层盖度在第1轴均有较高的正得分。第2轴的特征值为0.047, 与环境梯度的相关性为0.573, 草本层物种多度在此轴具正得分, 乔木层盖度则具较高的负得分。
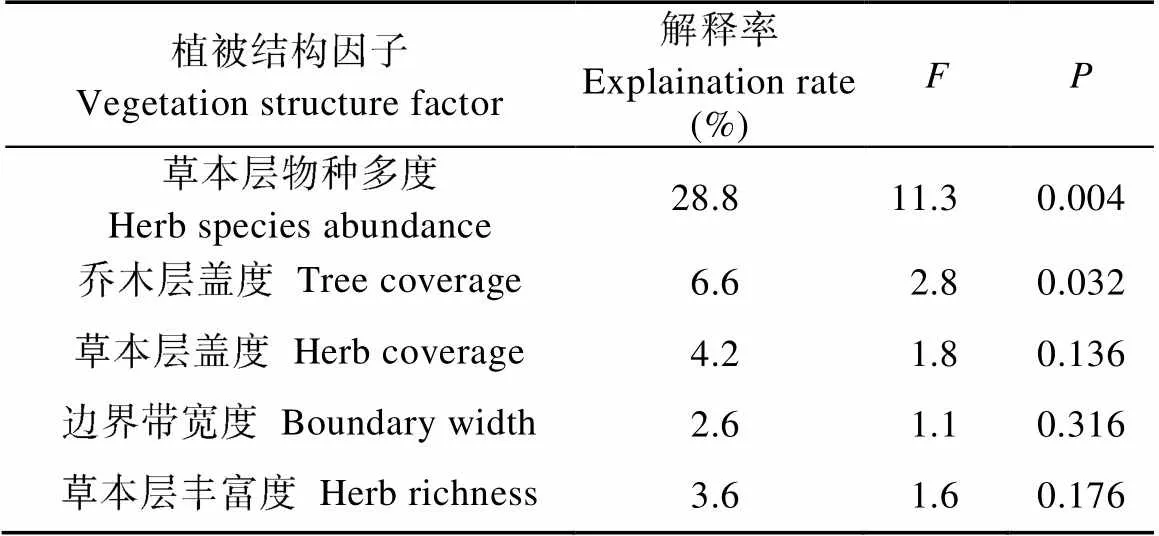
表5 林带植被结构因子对农田地表节肢动物群落分布独立影响作用的偏RDA分析
图7b显示, 优势种黄脸油葫芦(SP19)、常见科幽灵蛛科(SP37)与各植被结构因子所成夹角均较小, 说明上述物种与草本层多度以及乔木层盖度均呈正相关。步甲科常见种麻青步甲(SP8)、金星步甲(SP6)与草本层多度呈正相关, 受乔木层盖度影响较小。步甲科优势种中华婪步甲(SP11)、常见种大星步甲(SP7)、蜘蛛目常见科转蛛科(SP38)与乔木层盖度呈正相关, 受草本层多度影响较小。步甲科常见种附边青步甲(SP9)与草本层多度负相关, 乔木层盖度对该物种的影响相对较小。半翅目地红蝽(SP25)则与草本层多度、乔木层盖度皆成负相关。
3 讨论
3.1 林带类型对相邻农田地表节肢动物分布的影响
比较不同类型林带下农田地表节肢动物多度及多样性差异, 结果显示, 与消亡型林带相比, 完整型及残缺型林带相邻农田维持着显著较高的物种多度。这可能是由于防护林带通常具有更大的生境面积, 而且其复杂的垂直植被和丰富的凋落物层可以提升生物获取替代食源、庇护场所等资源的可能性[18]。同时, 林带作为农业生态系统中重要的植被类群, 其多年生特性决定了它成为农区环境中最为稳定的生物群落[32], 可为农田生物提供更稳定的生存环境以及更长效的资源供给[33]。以往研究也多证实边界带的植被群落越复杂, 农田内土壤动物多度越丰富[34-35]。张旭珠等[36]的研究同样表明, 相比于其他类型植被边界带(人工种植草带、自然演替草带),人工林地相邻的小麦()田中维持着显著较高的步甲、蜘蛛和蚜虫发生密度。
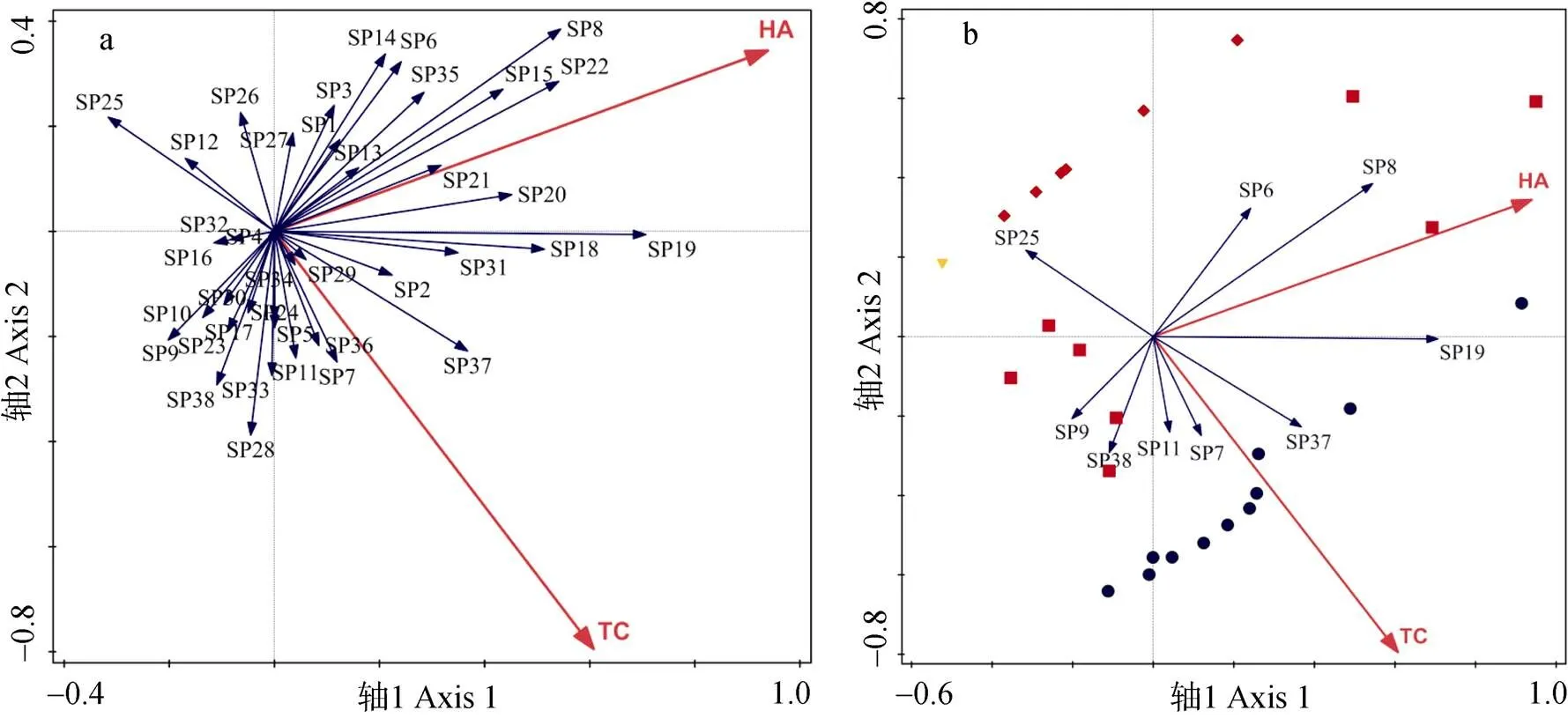
图7 农田地表节肢动物群落分布与2个关键解释变量[草本层物种多度(HA)和乔木层盖度(TC)]的RDA二维排序图
7a为所有物种与关键解释变量之间关系的二维排序图; 7b为优势及常见物种、关键解释变量以及样本三者关系的二维排序图。物种编号SP1-SP38同表2。图中●代表与完整型林带相邻的农田; ■代表与残缺型林带相邻的农田; ◆代表与消亡型草地带相邻的农田; ▼代表与消亡型裸地带相邻的农田。7a is the two-dimensional ordination diagram of the relationships between all species and key explanatory variables; 7b is the two-dimensional ordination diagram of the relationships among dominant and common species, key explanatory variables, and samples. The species numbers SP1-SP38 are shown in the table 2. ● indicates the farmland adjacent to complete shelterbelt; ■ indicates the farmland adjacent to incomplete shelterbelt; ◆indicates the farmland with grass fields boundary; ▼ indicates the farmland with bare fields boundary.
另一方面, 虽然物种多样性在各类型林带农田间未表现出显著性差异, 但NMDS分析显示, 与完整型及残缺型林带相邻的农田维持着异于消亡型林带的地表节肢动物群落结构。对这一现象可能的解释是, 受研究区集约化生产的长期影响, 能够存活至今的通常是适应能力强或已经适应农田生境的物种[37-38], 现有的防护林带虽能显著提升相邻农田中地表节肢动物的多度, 维持着不同于消亡型林带的节肢动物群落结构, 但受限于该地区有限的物种池, 无法对物种多样性的提升与恢复起到有效作用。
3.2 距离梯度对地表节肢动物分布的影响
比较相同类型林带下不同距离梯度处地表节肢动物多度及多样性差异, 结果显示: 随距林带边缘距离的增加, 地表节肢动物多度在与完整型及残缺型林带相邻农田中呈明显上升趋势; 而在与消亡型林带相邻的农田中, 物种多度则呈现出一致的波动趋势(均为先降低再升高最后降低)。以往研究表明, 由于不同时期相对生产力状况的转变, 生物在耕作及非耕作生境间不断迁移以寻求食物、栖息地等生存资源[39]。本研究采样期设定在8月下旬, 此时段正值雨季以及玉米的关键生长期, 农田内土壤水热条件适中、食物资源高度集中, 因而有利于地表节肢动物由非耕边界向农田生境的迁入活动。同时, 消亡型林带因具备较简单的生境结构, 其贫乏的种库容量可能是导致毗邻农田中节肢动物多度未呈明显上升趋势的原因。
另一方面, 随距林带距离的增加, 节肢动物物种多样性在各类型林带农田中皆呈递减趋势, 验证了边缘效应的存在。该结果与以往的研究成果相符, 即物种多样性随距非耕边界距离的增加逐渐递减。Fournier等[40]的研究得到了相似的规律, 在调查了树篱对农田内不同距离梯度处步甲群落分布的影响后, 发现步甲多样性于边界处达到峰值, 并随距树篱距离的增加逐渐减小。赵紫华等[20]的研究同样表明, 在与农田防护林、苜蓿()草地以及田埂相邻的麦田中, 步甲、蜘蛛等类群的分布存在着明显的边缘效应。
3.3 林带植被特征对相邻农田地表节肢动物群落分布的影响
冗余分析结果表明, 草本层物种多度以及乔木层盖度是影响农田地表节肢动物群落分布的主要因子, 共解释了35.4%的节肢动物群落数量变异。作为生境主要控制因素, 非耕作生境中的植被结构被认为是影响农田土壤动物多样性的重要因素[41]。农田边界处植被群落结构的变化可明显改变土壤水热条件, 显著改变节肢动物的生存环境及其资源利用效率, 从而影响着节肢动物的分布模式及群落结构。Garratt等[35]的研究也认为, 线状林地的植被结构(林分组成、林下植被)决定着生境质量, 结构复杂、形态连续的树篱能够显著提高相邻农田中传粉者和天敌类群的多样性。
不同节肢动物物种对林带植被特征的响应存在差异。步甲(占捕获量的38.1%)和蜘蛛(占捕获量的9.7%)作为当地农业景观中主要的天敌类群, 与上述林带植被结构因子关系密切。就蜘蛛而言, 常见科幽灵蛛科、转蛛科皆呈现出与乔木层盖度正相关的关系,该结果与张旭珠等[36]的研究一致, 即边界较高的乔木层盖度有利于农田内多数蜘蛛类群多样性的提升; Garratt等[35]的研究同样表明, 农业景观中的线状林地是蜘蛛类群的重要种库, 为该类群迁入相邻农田提供了有利条件。而就步甲而言, 优势种中华婪步甲、常见种大星步甲与乔木层盖度呈正相关, 常见种麻青步甲、金星步甲与草本层多度呈正相关。这可能是由于不同物种在取食类型、移动能力、群聚方式以及发育周期等生物学特性上存在着一定的差异, 导致它们对非生物环境因子的响应模式明显不同[42]。
4 结论
农田防护林作为研究区主要的非耕作生境类型,能够显著提升相邻农田中地表节肢动物的多度, 对于物种多样性的提升作用则不明显, 具备防护林带的农田维持着区别于消亡型林带的节肢动物群落结构。因此, 在未来的农业景观构建以及生物多样性保护中, 不仅需要注重现有林地的改造与提升, 还应进一步探索恢复农田生物多样性的景观措施。随距林缘距离的增加, 物种多样性在各类型林带农田中均呈递减趋势,物种多度则在与防护林带相邻的农田中呈明显上升趋势。林带内的草本层物种多度以及乔木层盖度是影响田间地表节肢动物群落分布的主要因子, 有利于增加蜘蛛、步甲等多类天敌的多样性, 因此, 通过营造适宜盖度的上层林木以及丰富的林下植被, 能够提升现有林地的生境质量, 进一步发挥其对农田生物多样性的保育功能。
[1] MATSON P A, PARTON W J, POWER A G, et al. Agricultural intensification and ecosystem properties[J]. Science, 1997, 277(5325): 504–509
[2] 吴倩倩, 梁宗锁, 刘佳佳, 等. 中国生境片段化对生物多样性影响研究进展[J]. 生态学杂志, 2017, 36(9): 2605–2614 WU Q Q, LIANG Z S, LIU J J, et al. Effects of habitat fragmentation on biodiversity in China[J]. Chinese Journal of Ecology, 2017, 36(9): 2605–2614
[3] ALTIERI M A. The ecological role of biodiversity in agroecosystems[J]. Agriculture, Ecosystems & Environment, 1999, 74(1/3): 19–31
[4] FAHRIG L, BAUDRY J, BROTONS L, et al. Functional landscape heterogeneity and animal biodiversity in agricultural landscapes[J]. Ecology Letters, 2011, 14(2): 101–112
[5] CARVALHEIRO L G, SEYMOUR C L, NICOLSON S W, et al. Creating patches of native flowers facilitates crop pollination in large agricultural fields: Mango as a case study[J]. Journal of Applied Ecology, 2012, 49(6): 1373–1383
[6] TSCHARNTKE T, KLEIN A M, KRUESS A, et al. Landscape perspectives on agricultural intensification and biodiversity — ecosystem service management[J]. Ecology Letters, 2005, 8(8): 857–874
[7] FIEDLER A K, LANDIS D A, WRATTEN S D. Maximizing ecosystem services from conservation biological control: The role of habitat management[J]. Biological Control, 2008, 45(2): 254–271
[8] 孙玉芳, 李想, 张宏斌, 等. 农业景观生物多样性功能和保护对策[J]. 中国生态农业学报, 2017, 25(7): 993–1001 SUN Y F, LI X, ZHANG H B, et al. Functions and countermeasures of biodiversity conservation in agricultural landscapes: A review[J]. Chinese Journal of Eco-Agriculture, 2017, 25(7): 993–1001
[9] 朱教君, 郑晓. 关于三北防护林体系建设的思考与展望——基于40年建设综合评估结果[J]. 生态学杂志, 2019, 38(5): 1600–1610 ZHU J J, ZHENG X. The prospects of development of the Three-North Afforestation Program (TNAP): On the basis of the results of the 40-year construction general assessment of the TNAP[J]. Chinese Journal of Ecology, 2019, 38(5): 1600–1610
[10] 张帅, 丁国栋, 高广磊, 等. 基于数学期望的风向和风速对农田防护林网防风效能的影响[J]. 厦门大学学报: 自然科学版, 2018, 57(4): 510–516 ZHANG S, DING G D, GAO G L, et al. Influence of wind direction and speed on the windbreak efficiency of farmland shelterbelt networks based on mathematical expectation[J]. Journal of Xiamen University: Natural Science, 2018, 57(4): 510–516
[11] 史晓亮, 李颖, 邓荣鑫. 基于RS和GIS的农田防护林对作物产量影响的评价方法[J]. 农业工程学报, 2016, 32(6): 175–181 SHI X L, LI Y, DENG R X. Evaluation method for effect of farmland shelterbelts on crop yield based on RS and GIS[J]. Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(6): 175–181
[12] 孟平, 张劲松, 宋兆民, 等. 农林复合模式蒸散耗水的研究[J]. 林业科学研究, 1996, 9(3): 221–226 MENG P, ZHANG J S, SONG Z M, et al. Study on evapo-transpiration on agroforestry[J]. Forest Research, 1996, 9(3): 221–226
[13] DAINESE M, INCLÁN LUNA D, SITZIA T, et al. Testing scale-dependent effects of seminatural habitats on farmland biodiversity[J]. Ecological Applications, 2015, 25(6): 1681–1690
[14] DUFLOT R, DANIEL H, AVIRON S, et al. Adjacent woodlands rather than habitat connectivity influence grassland plant, carabid and bird assemblages in farmland landscapes[J]. Biodiversity and Conservation, 2018, 27(8): 1925–1942
[15] GELLING M, MACDONALD D W, MATHEWS F. Are hedgerows the route to increased farmland small mammal density? Use of hedgerows in British pastoral habitats[J]. Landscape Ecology, 2007, 22(7): 1019–1032
[16] CRITCHLEY C N R, WILSON L A, MOLE A C, et al. A functional classification of herbaceous hedgerow vegetation for setting restoration objectives[J]. Biodiversity and Conservation, 2013, 22(3): 701–717
[17] NEUMANN J L, GRIFFITHS G H, HOODLESS A, et al. The compositional and configurational heterogeneity of matrix habitats shape woodland carabid communities in wooded-agricultural landscapes[J]. Landscape Ecology, 2015, 31(2): 301–315
[18] MAUDSLEY M J. A review of the ecology and conservation of hedgerow invertebrates in Britain[J]. Journal of Environmental Management, 2000, 60(1): 65–76
[19] MORANDIN L A, KREMEN C. Hedgerow restoration promotes pollinator populations and exports native bees to adjacent fields[J]. Ecological Applications, 2013, 23(4): 829–839
[20] 赵紫华, 欧阳芳, 贺达汉. 农业景观中不同生境界面麦蚜天敌的边缘效应与溢出效应[J]. 中国科学: 生命科学, 2012, 42(10): 825–840 ZHAO Z H, OUYANG F, HE D H. Edge effects and spillover effects of natural enemies on different habitat interfaces of agricultural landscape[J]. Scientia Sinica Vitae, 2012, 42(10): 825–840
[21] FU S L, ZOU X M, COLEMAN D. Highlights and perspectives of soil biology and ecology research in China[J]. Soil Biology and Biochemistry, 2009, 41(5): 868–876
[22] 宋立宁, 朱教君, 闫巧玲. 防护林衰退研究进展[J]. 生态学杂志, 2009, 28(9): 1684–1690 SONG L N, ZHU J J, YAN Q L. Review on the shelter forest decline[J]. Chinese Journal of Ecology, 2009, 28(9): 1684–1690
[23] 朱教君. 防护林学研究现状与展望[J]. 植物生态学报, 2013, 37(9): 872–888 ZHU J J. A review of the present situation and future prospect of science of protective forest[J]. Chinese Journal of Plant Ecology, 2013, 37(9): 872–888
[24] 尹文英, 胡圣豪, 沈韫芬, 等. 中国土壤动物检索图鉴[M]. 北京: 科学出版社, 1998 YIN W Y, HU S H, SHEN Y F, et al. Pictorical Keys to Soil Animals of China[M]. Beijing: Science Press, 1998
[25] 宋大祥. 中国农区蜘蛛[M]. 北京: 农业出版社, 1987 SONG D X. Spiders from Agricultural Regions of China[M]. Beijing: Agriculture Publishing House, 1987
[26] 黄其林, 田立新, 杨连芳. 农业昆虫鉴定[M]. 上海: 上海科学技术出版社, 1984 HUANG Q L, TIAN L X, YANG L F. Agricultural Insect Identification[M]. Shanghai: Shanghai Scientific & Technical Publishers, 1984
[27] 张治良, 赵颖, 丁秀云. 沈阳昆虫原色图鉴[M]. 沈阳: 辽宁民族出版社, 2009 ZHANG Z L, ZHAO Y, DING X Y. Color Atios of Insect in Shenyang[M]. Shenyang: Liaoning Nationality Publishing House, 2009
[28] 张巍巍. 昆虫家谱[M]. 重庆: 重庆大学出版社, 2014 ZHANG W W. Insect Genealogy[M]. Chongqing: Chongqing University Press, 2014
[29] 黄冰, HARPER D A T, HAMMER φ. 定量古生物学软件PAST及其常用功能[J]. 古生物学报, 2013, 52(2): 161–181 HUANG B, HARPER D A T, HAMMER φ. Introduction to PAST, a comprehensive statistics software package for paleontological data analysis[J]. Acta Palaeontologica Sinica, 2013, 52(2): 161–181
[30] 刘云慧, 宇振荣, 王长柳, 等. 坝上地区农田和恢复生境地表甲虫多样性[J]. 生态学报, 2011, 31(2): 465–473 LIU Y H, YU Z R, WANG C L, et al. The diversity of ground-dwelling beetles at cultivated land and restored habitats on the Bashang Plateau[J]. Acta Ecologica Sinica, 2011, 31(2): 465–473
[31] LEPŠ J, ŠMILAUER P. Multivariate Analysis of Ecological Data using CANOCO[M]. Cambridge: Cambridge University Press, 2003: 6–15
[32] 李凯. 农林复合生态系统林带对捕食性节肢动物种群动态的影响[D]. 北京: 北京林业大学, 2010: 6–7 LI K. The influence of forest belts on population dynamics of predatory arthropods in agroforestry system[D]. Beijing: Beijing Forestry University, 2010: 6–7
[33] GRAHAM L, GAULTON R, GERARD F, et al. The influence of hedgerow structural condition on wildlife habitat provision in farmed landscapes[J]. Biological Conservation, 2018, 220: 122–131
[34] CÉBRON A, CORTET J, CRIQUET S, et al. Biological functioning of PAH-polluted and thermal desorption-treated soils assessed by fauna and microbial bioindicators[J]. Research in Microbiology, 2011, 162(9): 896–907
[35] GARRATT M P D, SENAPATHI D, COSTON D J, et al. The benefits of hedgerows for pollinators and natural enemies depends on hedge quality and landscape context[J]. Agriculture, Ecosystems & Environment, 2017, 247: 363–370
[36] 张旭珠, 张鑫, 宋潇, 等. 植被边界带对相邻麦田地表步甲和蜘蛛分布及蚜虫发生的影响[J]. 生态学报, 2018, 38(23): 8442–8454 ZHANG X Z, ZHANG X, SONG X, et al. Effects of vegetated field margins on the distribution of epigaeic carabid beetles and spiders and aphid development in adjacent wheat fields[J]. Acta Ecologica Sinica, 2018, 38(23): 8442–8454
[37] 常虹, 张旭珠, 段美春, 等. 北京密云农业景观步甲群落空间分布格局[J]. 应用生态学报, 2012, 23(6): 1545–1550 CHANG H, ZHANG X Z, DUAN M C, et al. Spatial distribution pattern of carabid assemblage in agricultural landscape of Miyun County, Beijing[J]. Chinese Journal of Applied Ecology, 2012, 23(6): 1545–1550
[38] JONASON D, SMITH H G, BENGTSSON J, et al. Landscape simplification promotes weed seed predation by carabid beetles (Coleoptera: Carabidae)[J]. Landscape Ecology, 2013, 28(3): 487–494
[39] THIES C, ROSCHEWITZ I, TSCHARNTKE T. The landscape context of cereal aphid-parasitoid interactions[J]. Proceedings of the Royal Society B: Biological Sciences, 2005, 272(1559): 203–210
[40] FOURNIER E, LOREAU M. Effects of newly planted hedges on ground-beetle diversity (Coleoptera, Carabidae) in an agricultural landscape[J]. Ecography, 1999, 22(1): 87–97
[41] 戴漂漂, 张旭珠, 肖晨子, 等. 农业景观害虫控制生境管理及植物配置方法[J]. 中国生态农业学报, 2015, 23(1): 9–19 DAI P P, ZHANG X Z, XIAO C Z, et al. Habitat management and plant configuration for biological pest control in agricultural landscapes[J]. Chinese Journal of Eco-Agriculture, 2015, 23(1): 9–19
[42] TSCHARNTKE T, BRANDL R. Plant-insect interactions in fragmented landscapes[J]. Annual Review of Entomology, 2004, 49: 405–430
The effects of farmland shelterbelts on surface arthropod distribution: A case study in Changtu County, China*
BIAN Zhenxing, YANG Yibo, GUO Xiaoyu, ZHANG Yufei, YU Miao**
(College of Land and Environment, Shenyang Agricultural University, Shenyang 110866, China)
Improving farmland biodiversity is important for ecological agriculture. To explore how well farmland shelterbelts protect biodiversity, eight farmland shelterbelt units (unit = one field parcel; shelterbelt types: complete, incomplete, or extinct) in Jinjia Town, Changtu County, Liaoning Province, China were selected, and the surface arthropod distribution in adjacent farmlands was investigated using pitfall traps. Surface arthropods were sampled at 0, 50, 100, 150, and 200 m from the shelterbelt, and the shelterbelt vegetation characteristics were recorded. Analysis of variance and community ordination were used to analyze how the shelterbelt type, distance gradients, and shelterbelt vegetation structure affected the surface arthropod distribution. The results showed that the surface arthropod abundance was significantly higher in fields adjacent to complete and incomplete shelterbelts. The shelterbelt type had no significant effect on diversity; however, the surface arthropod community composition on the farmland adjacent to complete and incomplete shelterbelts differed from the extinct shelterbelts. The abundance gradient variation was significant in fields adjacent to complete and incomplete shelterbelts, demonstrating a low to high variation trend with away from shelterbelts. In all units, the diversity decreased as the distance toward the edge increased, and a significant edge effect was observed. Redundancy analysis (RDA) and Monte Carlo tests showed that the herb layer species abundance and the shelterbelt tree coverage were the primary factors affecting arthropod community distributions, accounting for 35.4% of the total surface arthropod population variation. Arthropod responses to the shelterbelt vegetation community significantly differed based on the species, carabids, and spiders present. The primary natural enemy of the local agricultural landscape was closely related to the shelterbelt vegetation structure; the carabid species diversity was positively associated with herb layer abundance, and the spider family diversity was positively associated with tree coverage. Farmland shelterbelts (a non-cropped habitat) significantly increased the number of surface arthropods in adjacent fields but did not affect species diversity. The herb layer abundance and shelterbelt tree coverage had a positive effect on natural enemy diversity (e.g., carabids and spiders). Strengthening agricultural landscape woodlands, such as increasing upper tree coverage and understory vegetation, improves the habitat quality and conserves farmland biodiversity, thereby promoting sustainable agriculture.
Farmland shelterbelts; Changtu County; Surface arthropods; Distribution; Community structure
P901

10.13930/j.cnki.cjea.200786
边振兴, 杨祎博, 果晓玉, 张宇飞, 于淼. 农田防护林对田间地表节肢动物分布的影响——以昌图县为例[J]. 中国生态农业学报(中英文), 2020, 28(12): 1835-1846
BIAN Z X, YANG Y B, GUO X Y, ZHANG Y F, YU M. The effects of farmland shelterbelts on surface arthropod distribution: A case study in Changtu County, China[J]. Chinese Journal of Eco-Agriculture, 2020, 28(12): 1835-1846
* 辽宁省自然科学基金项目(01064219009)资助
于淼, 主要从事数理统计与景观生态方面研究。E-mail: yumiao77@163.com
边振兴, 主要从事国土空间生态修复、耕地生态保护、农业景观生态方面研究。E-mail: zhx-bian@syau.edu.cn
2020-09-29
2020-10-08
* This study was supported by the Natural Science Foundation of Liaoning Province (01064219009).
, E-mail: yumiao77@163.com
Sep. 29, 2020;
Oct. 8, 2020

