核酸适配体在质谱中的应用与展望
杨捷威 王晨钰 罗黎 郭磊 谢剑炜

摘 要 核酸适配体(简称适配体)是一类重要的“化学抗体”型功能性生物分子,基于适配体的质谱技术在提供分子质量及结构特征等基础上,兼具了针对靶分子的高选择性及亲和富集特点,从而提供出高特异、高灵敏信息。本文综述了近年来适配体在质谱分析中的应用进展,重点评述了适配体在质谱分子相互作用表征中的应用、适配体作为离线型和在线亲和材料用于质谱分析测定等现状,其中结合多种质谱新技术, 通过创建或结合多种前处理或在线一体化信号增强方式,特别是适配体功能化纳米材料的应用,在相互作用表征、痕量靶分子选择性提取和高灵敏检测等质谱分析测定方面是研究的重点。最后,本文对适配体在质谱研究中的应用前景进行了展望。
关键词 适配体; 质谱; 相互作用表征; 纳米材料; 功能化; 评述
1 引 言
适配体是通过指数富集配体系统进化技术体外筛选得到的单链寡核苷酸序列,如脱氧核糖核酸(DNA)、核糖核酸(RNA)序列,能特异性识别靶分子,如小分子、生物大分子(蛋白质、酶、毒素、转录因子等)、病原体(病毒、细菌、细胞)、组织等,具有体积较小、结构灵活、变性复性快速可逆、易功能化修饰与标记、自身稳定性强和无免疫原性等优点[1]。适配体已在分析化学、药学、生物医学等多个领域得到应用,例如生物传感技术、DNA纳米技术、即时诊断、药物靶向递送等[2]。近年来,适配体作为亲和分子,已出现酶联适配体吸附剂、适配体型固定相、阵列式芯片、酶微反应器等多种形式,继而结合生物传感器、色谱、质谱(MS)等进行分析检测。
核酸适配体在质谱中的应用研究可分为两类模式: 一类是针对所形成靶分子-适配体复合物的天然结构进行质谱表征; 另一类是利用亲和材料,由生物相容性载体(如磁珠、树脂、纳米粒子等,负载适配体亲和分子)对分析物靶分子进行特异性提取、富集和净化,再对所捕获到的分析物进行质谱分析。适配体可作为离线前处理式亲和材料,需要采取合适的洗脱方式洗脱相对纯净的分析物,再进行质谱鉴定或液相色谱-质谱定量分析; 或直接用于在线亲和捕获富集和质谱靶向鉴定/测定“一体化”分析。
2 适配体在质谱分子相互作用表征中的应用
尽管已产生了具有高亲和力和选择性的多种靶分子的适配体,但缺乏高分辨率的结构数据以及当前各种生物物理表征方法的局限性等因素极大地阻碍了对适配体-靶分子相互作用机理的研究。质谱技术,特别是高分辨质谱技术,是靶分子-适配体相互作用表征的有力工具,可提供复合物分子量、结合比、选择性以及相互作用位点解析等多种信息。但是, 当适配体作为相互作用分子之一时,难点在于包括寡核苷酸在内的生物大分子电离效率低、相互作用结合位点解析困难,相互作用结构易受周围环境影响等,优点在于可以创造环境保持靶分子-适配体复合物的天然构象、特异性强、免标记、检测快速、样品量低、高通量等。基质辅助激光解吸电离-质谱技术(MALDI-MS)和液相色谱-电喷雾电离串联质谱技术(LC-ESI-MS/MS)是其中的代表性技术,交联结合质谱(XL-MS)、非变性质谱(Native MS)、氢/氘交换质谱(HDX MS)、自上而下质谱(Top-Down MS)、离子淌度联用质谱(IMS-MS)等工具则为之注入了新的活力。
引入化学交联方法,可精确绘制相互作用位点图谱。1999年,Golden等[3]首次利用ESI-MS鉴定了碱性成纤维生长因子155(bFGF155)与其内嵌5-溴-2-脱氧尿嘧啶(BrdU)的61 mer 适配体复合物,分别使用胰蛋白酶酶解、蛇毒磷酸二酯酶/碱性磷酸酶酶解,结合碰撞诱导电离(CID),确定出结合位点为bFGF155的一条九肽TGQY133KLGSK与61 mer适配体中的一个二聚核苷酸等。2017年,Lu等[4]结合XL-MS,设计了一种新颖的多功能化学探针,其结构中含有组蛋白H4的适配体序列、生物素标签、用于光交联的芳基叠氮光敏基团,以及使适配体与组蛋白易于解离的二硫键,实现了组蛋白H4的选择性标记和高效富集,并首次揭示出组蛋白H4与其适配体的结合区域处于N-末端尾部。
对非共价复合物可以直接进行质谱表征,无需化学交联。2005年,Keller等[5]报道了小分子(如妥布霉素、三磷酸腺苷(ATP)和核黄素等)与各自适配体在ESI-MS中的识别行为,发现氢键、π-π堆积对相互作用起到主要作用,但某些高亲和性适配体在气态电离时因为高库仑斥力而导致稳定性下降。2018年, Gulbakan等[6]首次使用非变性ESI-IMS-MS,提供了大量关于小分子(如腺苷、L-精氨酰胺、可卡因等)与适配体相互作用的基础信息(图1),发现电荷状态与适配体寡阴离子构象间的相关性,提示适配体-小分子相互作用在较低电荷态的复合物离子中得到更好保留,而较高电荷态的复合物离子在气相中更易解离,并揭示了化学计量结合比、结合特异性、小分子选择性以及适配体-小分子结合中的协同作用等。
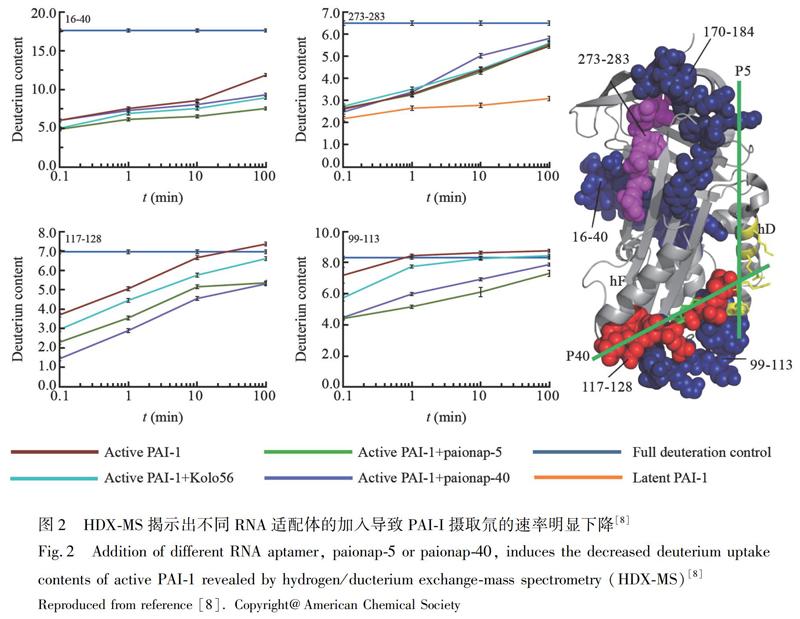
2013年,Chen等[7]首次报道了蛋白质-适配体复合物在MALDI-MS中的成功表征,仅需低样品量(1 pmol)和小体积(1~10 μL),使用非酸性基質6-氮杂-2-硫代胸腺嘧啶(ATT),可观察到凝血酶-凝血酶适配体(TBA)15/TBA29、血小板衍生生长因子-AB/BB及其适配体的非共价复合物峰,并可用于亲和力高低排序。2014年,Trelle等[8]利用HDX-MS研究了RNA适配体对靶蛋白-纤溶酶原激活物抑制剂1(PAI-1)的构象影响。PAI-1存在从活性构象到无活性构象(潜在状态)的过渡,此种过渡是折叠的蛋白质结构域未被共价修饰时可发生的最大的构象变化之一。研究发现,加入RNA适配体使RAI-1摄取氘的速率明显下降,活性构象得以稳定,进一步证实了适配体结合区域属于过渡态的结构不稳定区域(图2)。
非变性质谱是揭示结合比和推测结合位点的有力工具。2017年,Zhang等[9]通过高分辨傅立叶变换离子回旋共振(FTICR-MS)及四极杆-飞行时间串联质谱(QTOF-MS/MS)表征了凝血酶-TBA复合物。凝血酶和TBA15结合比受溶液离子强度影响,20~200 mmol/L NH4Ac存在时,凝血酶-TBA复合物呈1∶2型到1∶1型的变化,反映了该相互作用受静电作用调控的特性,进一步根据电子捕获电离(ECD)-MS推断出凝血酶和TBA间的可能结合位点为其纤维蛋白原结合位点,与晶体学数据一致。
3 适配体作为离线型亲和材料
目前, 以适配体作为离线型亲和材料的研究主要集中于适配体在不同类型支撑材料上的多种偶联策略研究,如金纳米粒子(AuNPs)、微(纳)磁性材料、氧化石墨烯(GO)、金属有机框架(MOF)[10]、微流控系统[11]、微阵列[12]、固相微萃取纤维[13]、纸基底[14]等,从而实现高偶联效率、适当密度和高捕获效率,这为适配体亲和质谱离线应用提供了灵活选择。相较于免疫捕获-质谱解析这一生物功能分子發现鉴定主要思路,适配体的应用在很大程度上克服了抗体的交叉反应活性问题。对于适配体自身的抗核酸酶稳定性、耐用性等,一般通过体外筛选过程或筛选后的化学修饰得到克服。
其中,适配体功能化微(纳)磁性材料得到了广泛关注,其用于富集提取时可方便实现磁性分离,可单独使用,也可与其它纳米材料复合使用。例如,对于金属离子和小分子,Shamsipur等[15]发展了适配体功能化的复合型磁性纳米粒子-GO材料(MNPs/GO),捕获全血和尿液中的痕量Pb2+后进行电感耦合等离子体质谱(ICP-MS)测定,检出限(LOD)低至50 ng/L。Lin等[16]以聚多巴胺(PDA)为单层吸附介质,通过戊二醛共价偶联制备了适配体功能化磁性MOF的新型分散固相萃取吸附剂M@PDA@UiO-66-Apt,可从土壤样品中高效选择性富集提取痕量多氯联苯(PCB)72和PCB106,采用气相色谱-串联质谱(GC-MS/MS)分析,LOD为10~15 ng/L,该吸附剂还可经洗脱后重复使用。该研究组随后还报道了新型的适配体功能化搅拌棒吸附萃取方法,GC-MS/MS对PCB72和PCB106的LOD可达3~4 ng/L,并成功用于PCB富集系数高的鱼类样品测定[17]。
2020年,Zeng等[18]构建了基于超支化适配体(HB-Apt)的核壳型金磁粒子(M@AuNPs),进而吸附到磁力搅拌子上形成生物活性涂层,所提取富集的PCB72和PCB106可在乙醇中搅拌脱附后进行气相色谱-质谱(GC-MS)分离及定量分析,获得了极高灵敏度(3~5 pg/g),该涂层可以循环使用至少60次。Zhang等[19]开发了一种适配体功能化的Mg/Al层状双氢氧化物磁性介孔碳(2~50 nm)型磁性固相萃取吸附剂,具备良好的化学稳定性,可特异性捕获痕量氯霉素,再经超高效液相色谱-串联质谱(UPLC-MS/MS)分析,LOD低至0.30 ng/L(0.94 pmol/L),并成功用于复杂血清、奶粉、鱼和鸡肉样品中的氯霉素测定。
靶蛋白鉴定与检测方面,多经不同材料(磁珠[20]、亲和柱、MNPs、复合磁性GO-AuNPs材料[21]、AuNPs/共价有机框架(COFs)等[22])或模块(微流控芯片[23]、微阵列等)提取富集洗脱后,或继续经胰蛋白酶酶解,再提交至MALDI-MS或LC-MS/MS进行肽质量指纹图谱鉴定或定量测定,提供了快速、灵敏的(多重)生物标志物分析新途径。Xiong等[24]首次合成了适配体功能化磁性介孔SiO2/ Au纳米复合材料,用于胰岛素检测,介孔材料的SiO2壳具有窄孔径分布(约2.9 nm),赋予其出色的尺寸排阻效应,7种不同尺寸的高丰度蛋白不造成任何干扰,LOD为 2 μg/L。 Wang等[25]构建了适配体功能化磁性MOF@Au,实现了人血清中胰岛素的快速灵敏检测, 其LOD为2 μg/L。
2019年, Chen等[26]制备了适配体功能化的层层自组装GO-AuNPs纳米复合材料,适配体的负载密度高达33.1 nmol/mg。该复合材料中,多支化聚乙烯亚胺有效吸附到AuNPs表面且显著增强了该载体的亲水性,有利于去除非特异性吸附。与传统酸提取法不能特异富集组蛋白相比,该材料可从核蛋白中高效特异捕获组蛋白,并快速有效发现其翻译后修饰的甲基化位点。2020年,Lupu等[27]针对人肝细胞生长因子的糖基化受体酪氨酸激酶C-Met及其两株DNA适配体,通过蛋白酶解表位提取质谱结合表面等离子体共振技术(PROTEX-SPR-MS),鉴定了相互作用位点和亲和力。适配体共价偶联的琼脂糖微型亲和柱与胰蛋白酶酶解后的C-Met肽段孵育后洗脱,再进行MALDI-MS鉴定,发现了不同相互作用位点,方法简捷高效。
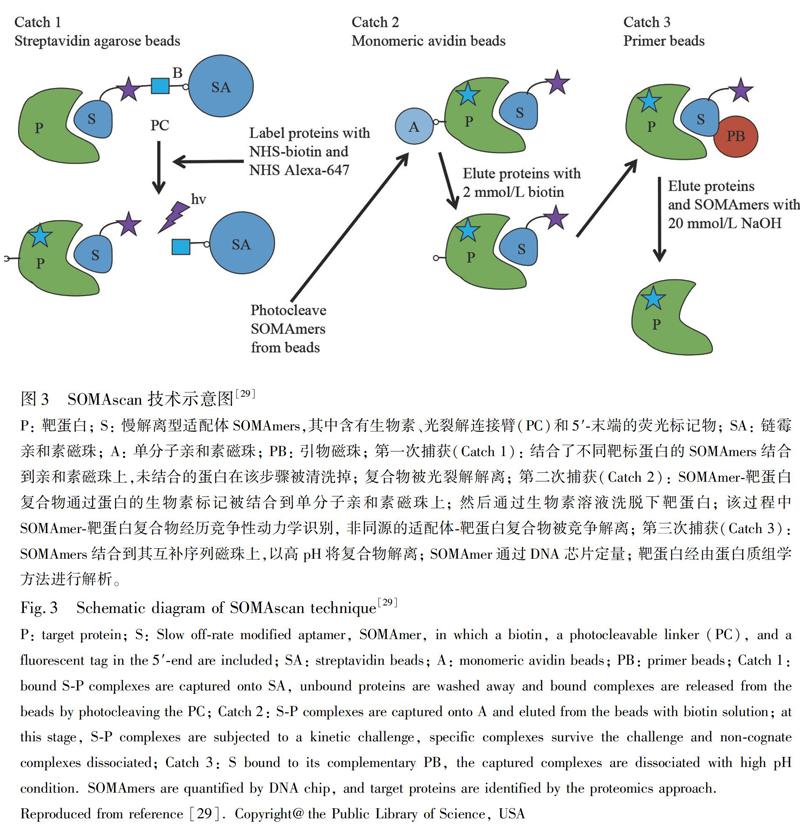
近年来,出现了大规模适配体联用进行蛋白质组学分析的临床样本应用研究报道。早在2008年,Berezovski等[28]已报道了适配体促进生物标志物发现(AptaBiD)技术,用于区分成熟和未成熟的活树突细胞的表面生物标志物,AptaBiD使用无偏向的适配体池,不需要适配体序列鉴定; 存在对不同靶蛋白的累积作用,在细胞分离中作用更强、更有效,从而结合蛋白质组学技术解释全面的生物标志物。2010年,SELEX技术发明者之一Gold等[29]发布了旨在分析临床样品的基于适配体的新型多重蛋白质组学平台SOMAscan(图3), 针对70 μL血浆或20 μg蛋白质样品,可通过1129种独特的慢解离型适配体SOMAmers同时定量测定1095种蛋白质,动态范围高达8个数量级,具备高灵敏度(40 fmol/L)和高特异性。已应用于血清、血浆、脑脊液、细胞提取物、腹水和外泌体[30~32]等。2018年,Jacob等[33]拓展使用SOMAscan,同时分析了4783种人类蛋白质,验证和发现了多种心肌损伤的早期生物标志物,样品通量远高于其它现有的蛋白组组学方法。2020年,SOMAscan方法所鉴定出的血清蛋白变化还用于区分败血症和非感染性全身性炎症[34]。
除利用适配体或适配体功能化支撑材料直接捕获分析外,还出现了其它新颖思路和方法。2017年,Ahmad等[35]报道了一种条形码DNA介导的信号放大策略,首先使用TBA15功能化的磁珠捕获凝血酶,并与TBA29和条形码DNA分子共同修饰的AuNPs一起形成夹心结构; 磁分离收集复杂基质(如人血清中的夹心复合物)后,用KCN溶解AuNPs,释放出的条形码DNA分子用于MALDI-MS检测。该策略展示了宽达7个数量级的线性范围和极佳的灵敏度,LOD为33 fg/L(0.89 amol/L)。最近,适配体功能化AuNPs标记技术结合ICP-MS还被用于灵敏、特异的细胞计数,例如,结合磁珠富集,对血清中的人肝癌细胞SMMC-7721的灵敏度为100cell/mL[36]; 结合荧光和AuNPs双标记适配体探针,对于全血中的MCF-7细胞,灵敏度为81cell/mL,同时还可实现荧光成像[37]。适配体功能化离线型新材料及应用见电子版文后支持信息表S1。
4 适配体用于在线亲和捕获富集和质谱鉴定/测定 “一体化”分析
适配体分子与MALD-MS结合使用时,可实现在线亲和捕获富集和质谱原位靶向鉴定/测定(“On-target”)的“一体化”分析,将适配体的特异性亲和捕获富集净化特性与MALDI-MS的原位解吸附电离能力完美契合,从而具备从复杂基质中直接提取鉴定痕量分析物的能力。2004年,Dick等[38]发表了首篇适配体亲和分子在质谱中的应用报道,即在线捕获-MALDI-MS方面的成功应用。将TBA共价结合在MALDI靶板载玻片表面,从血浆中捕获了凝血酶和凝血酶原。经洗涤有效去除大量非特异蛋白后,加入常用的小分子有机弱酸基质使得TBA的GQ结构打开,将靶蛋白从载玻片上解离下来后,直接进行MALDI-MS检测。这种捕获/释放/分析过程还可以循环实现。类似方法还用于从血清中2个重复长度的胰岛素连接多态性区域(ILPR2)特异性捕获胰岛素[39]和pmol/L水平的免疫球蛋白E等[40]。
从早期直接共价偶联适配体检测完整蛋白质的思路扩展,近年来多将适配体交联在支撑材料表面捕获多肽、靶蛋白, 并进行原位快速酶解,再加入α-氰基-4-羟基肉桂酸、2,5-二羟基苯甲酸、芥子酸等有机基质进行MALDI-MS鉴定或测定,克服了免疫亲和型MALDI-MS原位酶解时抗体分子本身发生酶解而产生高背景,严重干扰鉴定结果的缺陷。如Zhang等[41]将适配体共价交联到MALDI靶板金膜表面,成功地选择性檢出了复杂基质(如人血清)中浓度低至20 μg/L的胰岛素,还可从未稀释的人体尿液中高灵敏地检出低至66 μg/L的溶菌酶[42]。
2014年,Lee等[43]首次将适配体亲和分子与整合选择性富集靶标(ISET)策略结合使用(图4)。通过适配体功能化微珠,可从血清样品中特异性捕获低至0.37 ng/L(10 fmol/L)的凝血酶。ISET芯片既是样品制备平台,也是MALDI靶板,内含96个纳米孔道,每个纳米孔道底端含有多个出口通道以容纳微珠; 所有操作均在一孔中进行,不产生样品转移,样品损失和污染风险均非常低。使用时适配体功能化微珠首先捕获靶蛋白,然后加入到纳米孔中,酶解后加入有机基质,低真空度下在ISET靶板背面缓慢形成均匀结晶,反转ISET靶板即可高效、便捷地进行MALDI-MS分析,较之基于抗体的ISET,灵敏度显著增加。
适配体型纳米器件还可在免有机基质模式下进行MALDI-MS分析鉴定,克服了该技术在低质量段(<700 Da)众多基质峰的干扰。此模式被称为激光解吸电离-质谱(LDI-MS)或表面辅助激光解吸电离质谱(SALDI-MS)。2007年,Huang等[44]基于适配体偶联AuNPs首次直接实现ATP的LDI-MS,LOD为0.24 mg/L(0.48 μmol/L)。2012年, Guobakan等[45]首次报道了适配体共价偶联GO双功能平台,在复杂基质中成功选择性富集并实现了靶分子(如可卡因、腺苷等)的高效电离,较之单用GO作为表面辅助基质时的背景干扰大为降低。2015年,Gan等[46]开发了适配体功能化的SiO2@AuNPs,用于复杂生物样本中同时靶向富集和检测卡那霉素,牛奶基质中的LOD为0.58 μg/L(1 nmol/L)。目前所报道的适配体型纳米器件及应用还包括单壁碳纳米角检测ATP[47]、金锰氧化物(Au@MnO)杂化纳米花靶向肿瘤细胞并检测裂解液中的ATP[48]等。
纳米材料在LDI-MS中除作为表面辅助基质外,还可形成特征性的质量标记型探针,结合适配体的特异结合能力,可使探针的MS信号强度与分析物浓度成比例关系。Liu等[49]将TBA29选择性捕获凝血酶后的复合物浓缩沉积到硝酸纤维素膜(NCM)上,AuNPs/NCM形成高效无背景干扰的表面辅助基质,有效消除了仅AuNPs作为基质时诸多背景峰的干扰。凝血酶的结合降低了AuNPs表面上金簇原子的解吸和电离效率,引起MS中金簇信号强度的下降,以金簇信号作为高增强的靶蛋白标记探针,对凝血酶具有高灵敏度(LOD 1.8 ng/L,即50 fmol/L)和高选择性(其它1000倍蛋白质无干扰)。2015年,Chiu等发展了靶向粘蛋白1(MUC1)适配体修饰的二维金纳米膜,首次将LDI-MS用于循环肿瘤细胞检测,可检测到每毫升血液样本中低达10个人乳腺癌MCF-7细胞[50]。纳米材料辅助LDI-MS也可用于实现肿瘤组织的高灵敏质谱成像标记,例如 MUC1适配体修饰的AuNPs/GO[51]、核仁素适配体高密度功能化核壳型卫星状AuNPs[52],最低可检测到100个肿瘤细胞。2018年Han等[53]报告了一种基于单链DNA与AuNPs的质量标签间的竞争性非共价相互作用平台,可使用MALDI-MS灵敏检测生物标志物前列腺特异性抗原,LOD达到57 ng/L,较之传统光谱法提高了约两个数量级。2019年, Zhu等[54]向LDI-MS引入可与适配体形成竞争性吸附的小分子质量标签三聚氰胺,适用于临床和疫苗样品中的人乳头瘤病毒HPV 16 L1蛋白定量,LOD为58.8 ng/L。
近年来,适配体亲和分子也在飞速发展的常压原位电离技术和质谱流式细胞术(CyTOF-MS)中得到了成功应用,2017年,Zargar等[55]在纸喷雾电离-离子迁移谱(PSI-IMS)中,引入适配体固定化的纤维素纸,纸基底不仅作为电离源,而且还用于固定适配体以选择性提取分析物; 连续溶剂流同时作为洗脱和喷雾溶剂,可待因等分析物经基于适配体的选择性薄膜微萃取后洗脱、解吸和电离,灵敏度在μg/L水平。类似的还有碳点或碳纳米管修饰适配体改性纤维素纸喷雾检测血浆或唾液中甲基安非他明的报道,LOD为0.45~0.60 μg/L[56]。CyTOF-MS使用元素标签代替荧光团,利用ICP-MS技术对单个细胞进行多参数分析,多使用稳定稀土金属同位素标记抗体,检测特定的细胞特征。2018年,Mironov等[57]基于人酪氨酸激酶7受体的生物素化适配体,与165Ho标记的亲和素结合,通过CyTOF-MS鉴定阳性(人急性淋巴细胞白血病)和阴性(人Burkitt淋巴瘤)细胞,显示了良好的抗体替代性及与流式细胞术的可比性。
LC-MS、毛细管电泳-质谱(CE-MS)的在线富集方面,Gan等[58]制备了磁固相萃取(MSPE)适用的适配体磁性吸附剂(M@PDA@Apt),并开发了在线MSPE-LC-MS方法,用于测定尿液中同时存在的8-羟基-2′-脱氧鸟苷和单羟基化多环芳烃。与离线MSPE相比,在线方法的灵敏度提高了30~400倍,LOD为28~114 ng/L[59]。2020年, Pero-Gascon等[60]报道了一种在线适配体亲和固相萃取(SPE)CE-MS方法,预浓缩、分离和测定了血液中的α-突触核蛋白,LOD为0.2 mg/L,较之未耦合在线富集方法的灵敏度提高100倍。适配体功能化在线型新材料及用途见电子版文后支持信息表S2。
5 展 望
未来,核酸适配体将继续以其高亲和性、高特异性特点,结合适配体自身作为核酸分子的可扩增性、互补竞争特性,及在纳米材料上的多种复合功能化特性,在质谱分析测定方面得到广泛应用。(1)开发特异性更强、亲和力更高、稳定性更好的适配体,例如引入化学修饰碱基,增强与靶分子的相互作用力; 通过生物信息学方法改善适配体性能,包括模拟适配体选择、基于片段的适配体设计、高通量测序等; (2)拓展适配体更多的识别模式,从碱基修饰、GQ高级结构的形成与促进、多价适配体、适配体互补序列引导精确“投放”等多种途径进行设计改造。例如,酶联信号分子以及互补序列引导原位酶增强酶解等,从而实现靶蛋白的結构鉴定与区分,并提高选择性和灵敏度,降低假阳性率; (3)结合更高效的载体,如新型纳米材料、新型聚合物、主体分子等,优化不同亲和元件的核心路径,特别是深入揭示适配体功能化载体的表面识别特性,实现复杂基质中低丰度靶分子、靶分子-适配体复合物的高灵敏高特异检测,以及提高质谱成像的质量; (4)与高通量筛选评价、蛋白质组学等结合,在蛋白质功能调控、新药发现、临床诊疗领域发挥更大作用。
References
1 Rthlisberger P, Hollenstein M. Adv. Drug Deliv. Rev., 2018, 134: 3-21
2 Dunn M R, Jimenez R M, Chaput J C. Nat. Rev. Chem., 2017, 1(10): 0076
3 Golden M C, Resing K A, Collins B D, Willis M C, Koch T H. Protein Sci., 1999, 8(12): 2806-2812
4 Lu C, Tian S, Zhai G, Yuan Z, Li Y, He X, Zhang Y, Zhang K. ACS Chem. Biol., 2017, 12(1): 57-62
5 Keller K M, Breeden M M, Zhang J M, Ellington A D, Brodbelt J S. J. Mass Spectrom., 2005, 40(10): 1327-1337
6 Gulbakan B, Barylyuk K, Schneider P, Pillong M, Schneider G, Zenobi R. J. Am. Chem. Soc., 2018, 140(24): 7486-7497
7 Chen F, Gulbakan B, Zenobi R. Chem. Sci., 2013, 4(10): 4071-4078
8 Trelle M B, Dupont D M, Madsen J B, Andreasen P A, Jorgensen T J. ACS Chem. Biol., 2014, 9(1): 174-182
9 Zhang J, Loo R R O, Loo J A. J. Am. Soc. Mass Spectrom., 2017, 28(9): 1815-1822
10 Zhang Q, Yang Y, Zhi Y, Wang X, Wu Y, Zheng Y. J. Sep. Sci., 2019, 42(3): 716-724
11 Nguyen T H, Pei R J, Qiu C M, Ju J Y, Stojanovic M, Lin Q. J. Microelectromech. Syst., 2009, 18(6): 1198-1207
12 Ahn J Y, Lee S W, Kang H S, Jo M, Lee D K, Laurell T, Kim S. J. Proteome Res., 2010, 9(11): 5568-5573
13 Mu L, Hu X, Wen J, Zhou Q. J. Chromatogr. A, 2013, 1279: 7-12
14 Hashemian Z, Khayamian T, Saraji M. Anal. Bioanal. Chem., 2015, 407(6): 1615-1623
15 Shamsipur M, Farzin L, Amouzadeh Tabrizi M, Sheibani S. Mater. Sci. Eng. C, 2017, 77: 459-469
16 Lin S, Gan N, Cao Y, Chen Y, Jiang Q. J. Chromatogr. A, 2016, 1446: 34-40
17 Lin S, Gan N, Zhang J, Qiao L, Chen Y, Cao Y. Talanta, 2016, 149: 266-274
18 Zeng J, Wang Q, Gao J, Wang W, Shen H, Cao Y, Hu M, Bi W, Gan N. J. Chromatogr. A, 2020: 1614: 460715
19 Zhang Q, Zhou Q, Yang L, Wang X, Zheng Y, Bao L. J. Sep. Sci., 2020, 43(13): 2610-2618
20 Cho S, Lee S H, Chung W J, Kim Y K, Lee Y S, Kim B G. Electrophoresis, 2004, 25(21-22): 3730-3739
21 Xiong Y, Deng C, Zhang X. Talanta, 2014, 129: 282-289
22 Ge K, Peng Y, Lu Z, Hu Y, Li G. J. Chromatogr. A, 2020, 1615: 460741
23 Yang J, Zhu J, Pei R, Oliver J A, Landry D W, Stojanovic M N, Lin Q. Anal. Methods, 2016, 8(26): 5190-5196
24 Xiong Y, Deng C, Zhang X, Yang P. ACS Appl. Mater. Interfaces, 2015, 7(16): 8451-8456
25 Wang Z, Hu X, Sun N, Deng C. Anal. Chim. Acta, 2019, 1087: 69-75
26 Chen Y, Jiang B, Hu Y, Deng N, Zhao B, Li X, Liang Z, Zhang L, Zhang Y. Electrophoresis, 2019, 40(16-17): 2135-2141
27 Lupu L, Wiegand P, Huettmann N, Rawer S, Kleinekofort W, Shugureva I, Kichkailo A S, Tomilin F N, Lazarev A, Berezovski M V, Przybylski M. ChemMedChem, 2020, 15(4): 363-369
28 Berezovski M V, Lechmann M, Musheev M U, Mak T W, Krylov S N. J. Am. Chem. Soc., 2008, 130(28): 9137-9143
29 Gold L, Ayers D, Bertino J, Bock C, Bock A, Brody E N, Carter J, Dalby A B, Eaton B E, Fitzwater T, Flather D, Forbes A, Foreman T, Fowler C, Gawande B, Goss M, Gunn M, Gupta S, Halladay D, Heil J, Heilig J, Hicke B, Husar G, Janjic N, Jarvis T, Jennings S, Katilius E, Keeney T R, Kim N, Koch T H, Kraemer S, Kroiss L, Le N, Levine D, Lindsey W, Lollo B, Mayfield W, Mehan M, Mehler R, Nelson S K, Nelson M, Nieuwlandt D, Nikrad M, Ochsner U, Ostroff R M, Otis M, Parker T, Pietrasiewicz S, Resnicow D I, Rohloff J, Sanders G, Sattin S, Schneider D, Singer B, Stanton M, Sterkel A, Stewart A, Stratford S, Vaught J D, Vrkljan M, Walker J J, Watrobka M, Waugh S, Weiss A, Wilcox S K, WolfsonA, Wolk S K, Zhang C, Zichi D. PLoS One, 2010, 5(12): e15004
30 Hathout Y, Brody E, Clemens P R, Cripe L, Delisle R K, Furlong P, Gordish-Dressman H, Hache L, Henricson E, Hoffman E P, Kobayashi Y M, Lorts A, Mah J K, Mcdonald C, Mehler B, Nelson S, Nikrad M, Singer B, Steele F, Sterling D, Sweeney H L, Williams S, Gold L. Proc. Natl. Acad. Sci. USA, 2015, 112(23): 7153-7158
31 Billing A M, Ben Hamidane H, Bhagwat A M, Cotton R J, Dib S S, Kumar P, Hayat S, Goswami N, Suhre K, Rafii A, Graumann J. J. Proteomics, 2017, 150: 86-97
32 Finkernagel F, Reinartz S, Schuldner M, Malz A, Jansen J M, Wagner U, Worzfeld T, Graumann J, Von Strandmann E P, Mueller R. Theranostics, 2019, 9(22): 6601-6617
33 Jacob J, Ngo D, Finkel N, Pitts R, Gleim S, Benson M D, Keyes M J, Farrell L A, Morgan T, Jennings L L, Gerszten R E. Circulation, 2018, 137(12): 1270-1277
34 Shubin N J, Navalkar K, Sampson D, Yager T D, Cermelli S, Seldon T, Sullivan E, Zimmerman J J, Permut L C, Piliponsky A M. Crit. Care Med., 2020, 48(1): E48-E57
35 Ahmad R, Jang H, Batule B S, Park H G. Anal. Chem., 2017, 89(17): 8966-8973
36 Yang W J, Xi Z M, Zeng X X, Fang L, Jiang W J, Wu Y N, Xu L J, Fu F F. J. Anal. At. Spectrom., 2016, 31(3): 679-685
37 Yang B, Chen B, He M, Yin X, Xu C, Hu B. Anal. Chem., 2018, 90(3): 2355-2361
38 Dick L W, Mcgown L B. Anal. Chem., 2004, 76(11): 3037-3041
39 Connor A C, Frederick K A, Morgan E J, Mcgown L B. J. Am. Chem. Soc., 2006, 128(15): 4986-4991
40 Cole J R, Dick L W, Morgan E J, Mcgown L B. Anal. Chem., 2007, 79(1): 273-279
41 Zhang X Y, Zhu S C, Deng C H, Zhang X M. Chem. Commun. (Camb.), 2012, 48(21): 2689-2691
42 Zhang X, Zhu S, Xiong Y, Deng C, Zhang X. Angew. Chem. Int. Ed., 2013, 52(23): 6055-6058
43 Lee S J, Adler B, Ekstrom S, Rezeli M, Vegvari A, Park J W, Malm J, Laurell T. Anal. Chem., 2014, 86(15): 7627-7634
44 Huang Y F, Chang H T. Anal. Chem., 2007, 79(13): 4852-4859
45 Gulbakan B, Yasun E, Shukoor M I, Zhu Z, You M, Tan X, Sanchez H, Powell D H, Dai H, Tan W. J. Am. Chem. Soc., 2010, 132(49): 17408-17410
46 Gan J, Wei X, Li Y, Wu J, Qian K, Liu B. Nanomedicine, 2015, 11(7): 1715-1723
47 Ma R, Lu M, Ding L, Ju H, Cai Z. Chem. Eur. J., 2013, 19(1): 102-108
48 Ocsoy I, Gulbakan B, Shukoor M I, Xiong X, Chen T, Powell D H, Tan W. ACS Nano, 2013, 7(1): 417-427
49 Liu Y C, Chang H T, Chiang C K, Huang C C. ACS Appl. Mater. Interfaces, 2012, 4(10): 5241-5248
50 Chiu W J, Ling T K, Chiang H P, Lin H J, Huang C C. ACS Appl. Mater. Interfaces, 2015, 7(16): 8622-8630
51 Huang R C, Chiu W J, Lai P J, Huang C C. Sci. Rep., 2015, 5: 10292
52 Tseng Y T, Harroun S G, Wu C W, Mao J Y, Chang H T, Huang C C. Nanotheranostics, 2017, 1(2): 141-153
53 Han J, Li Y, Zhan L, Xue J, Sun J, Xiong C, Nie Z. Chem. Commun. (Camb.), 2018, 54(76): 10726-10729
54 Zhu L, Han J, Wang Z, Yin L, Zhang W, Peng Y, Nie Z. Analyst, 2019, 144(22): 6641-6646
55 Zargar T, Khayamian T, Jafari M T. J. Pharm. Biomed. Anal., 2017, 132: 232-237
56 Zargar T, Khayamian T, Jafari M T. Microchim. Acta, 2018, 185(2): 103
57 Mironov G G, Bouzekri A, Watson J, Loboda O, Ornatsky O, Berezovski M V. Anal. Bioanal. Chem., 2018, 410(13): 3047-3051
58 Gan H, Xu H. Anal. Chim. Acta, 2018, 1008: 48-56
59 Gan H, Xu H. Talanta, 2019, 201: 271-279
60 Pero-Gascon R, Benavente F, Minic Z, Berezovski M V, Sanz-Nebot V. Anal. Chem., 2020, 92(1): 1525-1533

